首页 > 医疗资讯/ 正文
[摘要] 背景与目的:人乳头状瘤病毒(human papilloma virus,HPV)感染状态在宫颈癌前病变诊断和宫颈癌分型中具有重要意义,而在宫颈病变中高危型(high-risk,HR)HPV感染通常与P16蛋白的过表达密切相关,因此在临床上对组织样本进行病理学诊断时将免疫组织化学(immunohistochemistry,IHC)检测的P16蛋白表达作为判断HPV感染情况的重要依据,但两者之间仍有部分不一致,其相关性有待深入研究,以更好地指导临床实践。方法:回顾性收集复旦大学附属肿瘤医院2020年1月—2023年12月进行宫颈活检或手术的618例患者的临床病理学资料(伦理批号:050432-4-2307E),采用聚合酶链反应(polymerase chain reaction,PCR)反向点杂交法检测HPV DNA多亚型,包括HR和低危型(low-risk,LR);采用IHC检测P16蛋白水平,比较两者的一致率,评估P16表达在判断HPV感染时的灵敏度和特异度。618例宫颈病变患者中,宫颈鳞癌92例,宫颈腺癌257例,高级别鳞状上皮内病变(high-grade squamous intraepithelial lesions,HSIL)79例,低级别鳞状上皮内病变(low-grade squamous intraepithelial lesions,LSIL)105例,慢性宫颈炎85例。结果:在宫颈鳞癌中,HR-HPV和P16的阳性率分别为88.0%(81/92)和91.3%(84/92),一致率为90.2%(83/92),P16在判断HR-HPV感染中的灵敏度和特异度为96.3%和45.5%;在宫颈腺癌中,HR-HPV和P16的阳性率分别为54.5%(140/257)和58.8%(151/257),一致率为82.5%(212/257),P16在判断HR-HPV感染中的灵敏度和特异度为87.9%和76.1%;在HSIL中,HR-HPV和P16的阳性率分别为75.9%(60/79)和70.9%(56/79),一致率为82.2%(65/79),P16在判断HR-HPV感染中的灵敏度和特异度为85.0%和73.7%;在LSIL中,HR-HPV和P16的阳性率分别为73.3%(77/105)和8.5%(9/105),一致率为33.3%(35/105),P16在判断HR-HPV感染中的灵敏度和特异度为10.4%和96.4%;在慢性宫颈炎中,HR-HPV和P16的阳性率分别为20.0%(17/85)和0.0%(0/85),一致率为80.0%(68/85),P16在判断HR-HPV感染中的灵敏度和特异度为0.0%和100.0%。在宫颈鳞癌、宫颈腺癌及HSIL中P16阳性与HPV16/18呈显著正相关(P=0.000),而在LSIL及慢性宫颈炎中无显著相关性(P>0.05)。结论:在宫颈鳞癌及宫颈腺癌中,P16阳性表达与HPV DNA阳性(HPV感染)的一致率较高,尤其P16表达与HPV16/18亚型感染显著相关。HSIL中P16阳性表达可以初步反映HPV感染情况,但在LSIL及慢性宫颈炎中,P16表达难以准确地反映HPV感染情况。P16与HPV DNA检测不一致可能受感染亚型、病理学类型、样本质量等多种因素影响,实际工作中应仔细分析或用多种方法确定HPV的感染状态。
[关键词] 宫颈病变;人乳头状瘤病毒;P16免疫组织化学;宫颈鳞癌;宫颈腺癌;高级别鳞状上皮内病变;低级别鳞状上皮内病变;慢性宫颈炎;一致率
[Abstract] Background and purpose: Human papilloma virus (HPV) infection status is crucial for diagnosing cervical precancerous lesions and classifying cervical cancer. High-risk (HR) HPV is often linked to P16 protein overexpression, so P16 detection via immunohistochemistry (IHC) is commonly used to assess HPV infection. However, the differences between HPV status and P16 expression remains unclear. An in-depth study of the correlation between HPV and P16 is essential for clinical guidance. Methods: We retrospectively collected clinical and pathological data of cervical lesions from 618 patients diagnosed at the Department of Pathology, Fudan University Shanghai Cancer Center from January 2020 to December 2023 (Ethical number: 050432-4-2307E). Polymerase chain reaction (PCR) reverse dot hybridization was used to detect HPV including HR and low-risk (LR) subtypes, and immunohistochemistry was used to detect P16 for comparative analysis. Based on different clinical and pathological diagnoses, the sensitivity and specificity of P16 expression in evaluating HPV infection were evaluated. Among the 618 cases of cervical lesions, there were 92 cases of cervical squamous cell carcinoma, 257 cases of cervical adenocarcinoma, 79 cases of high-grade squamous intraepithelial lesions (HSIL), 105 cases of low-grade squamous intraepithelial lesions (LSIL), and 85 cases of chronic cervical inflammation. Results: According to clinical diagnosis, the HR-HPV positive rate in cervical squamous cell carcinoma was 88.0% (81/92), the P16 positive rate was 91.3% (84/92), and the overall consistency rate between P16 and HPV detection was 90.2% (88/92); for HR-HPV infection, the sensitivity and specificity of P16 were 96.3% and 45.5%. The positive rate of HR-HPV in adenocarcinoma was 54.5% (140/257), the positive rate of P16 was 58.8% (151/257), and the overall consistency rate between P16 and HPV detection was 82.5% (212/257); for HR-HPV infection, the sensitivity and specificity of P16 were 87.9% and 76.1%. In HSIL, the HR-HPV positive rate was 75.9% (60/79), the positive rate of P16 was 70.9% (56/79), and the overall consistency rate between P16 and HR-HPV detection was 82.2% (65/79); for HR-HPV infection, the sensitivity and specificity of P16 were 85.0% and 73.7%. In LSIL, the HR-HPV positive rate was 73.3% (77/105), the positive rate of P16 was 8.5% (9/105), and the overall consistency rate between P16 and HR-HPV detection was 33.3% (35/105); for HR-HPV infection, the sensitivity and specificity of P16 were 10.4% and 96.4%. In chronic cervical inflammation, the HR-HPV positive rate was 20% (17/85), the positive rate of P16 was 0.0% (0/85); for HR-HPV infection, the sensitivity and specificity of P16 were 0.0% and 100.0%. There was a significant positive correlation between P16 positivity and HPV16/18 in cervical squamous cell carcinoma, adenocarcinoma, and HSIL (P=0.000), while there was no significant correlation in LSIL and chronic cervical inflammation (P>0.05). Conclusion: In cervical squamous cell carcinoma and adenocarcinoma, the consistency of P16 expression and HPV DNA positivity are high, especially in HPV16/18 subtype. There is a good concordance between HR-HPV positivity and P16 protein overexpression. The positive expression of P16 in HSIL may initially reflect HPV infection status. However, in LSIL and chronic cervicitis, P16 expression may not accurately correlate with HPV infection. The inconsistency between P16 and HPV DNA testing could be influenced by multiple factors, including HPV subtypes, histopathological categories, specimen quality, and technical limitations. In clinical practice, it is recommended to conduct comprehensive analysis or employ multiple diagnostic methods to confirm HPV infection status for precise evaluation.
[Key words] Cervical lesions; Human papilloma virus; P16 immunohistochemistry; Cervical squamous cell carcinoma; Cervical adenocarcinoma; High-grade squamous intraepithelial lesions; Low-grade squamous intraepithelial lesions; Chronic cervical inflammation; Consistency
宫颈癌是妇科常见的恶性肿瘤之一,目前普遍认为宫颈癌的发生与人乳头状瘤病毒(human papillomavirus,HPV)感染具有较高的相关性[1-2],HPV感染可引起宫颈病变,持续性HPV感染会促进宫颈低级别鳞状上皮内病变(low-grade squamous intraepithelial lesions,LSIL)向高级别鳞状上皮内病变(high-grade squamous intraepithelial lesions,HSIL)进展,直至产生浸润性宫颈癌。细胞学水平HPV E6/E7 RNA或DNA检测在宫颈癌早筛方面已取得了显著效果。P16蛋白是细胞周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)抑制蛋白[3],当HPV持续感染时,HPV整合到宿主基因组中,诱导致癌基因E6和E7的表达,E7蛋白抑制视网膜母细胞瘤蛋白(Rb)的活性导致P16蛋白过表达。因此在对组织样本进行病理学诊断时P16蛋白表达是间接反映HPV感染的重要标志物[4]。在口咽等头颈部鳞状细胞癌中,有研究[5-6]表明,对P16进行免疫组织化学(immunohistochemistry,IHC)检测是HPV感染可靠的替代指标,具有极高的特异度和灵敏度,一致率为93%~97%。对于宫颈病变也有研究[7-8]显示,P16蛋白水平、Ki-67增殖指数等IHC检测可为判断HPV感染及诊断提供重要参考依据。然而不同于口咽癌,宫颈病变病程长,病变程度和肿瘤病理学类型多样, HPV潜伏期久且感染亚型多种多样,同时在宫颈病变组织病理学诊断中,容易受到样本质量差及肿瘤细胞含量少等因素的影响,在临床实践过程中,常出现病理学形态、IHC-P16及HPV DNA/RNA检测结果不符等情况,可能对病理科医师的病理学诊断带来困扰。因此有必要对宫颈病变组织样本中P16蛋白水平与HPV分子检测结果进行对比分析,有助于对宫颈上皮内病变进行诊断及宫颈癌分型。本研究基于较大样本的临床回顾性数据,分析不同类型宫颈病变中P16表达与HPV DNA检测的一致率,探讨P16在宫颈病变组织样本中反映HPV感染状态的应用价值。
1 资料和方法
1.1 入组病例及组织处理
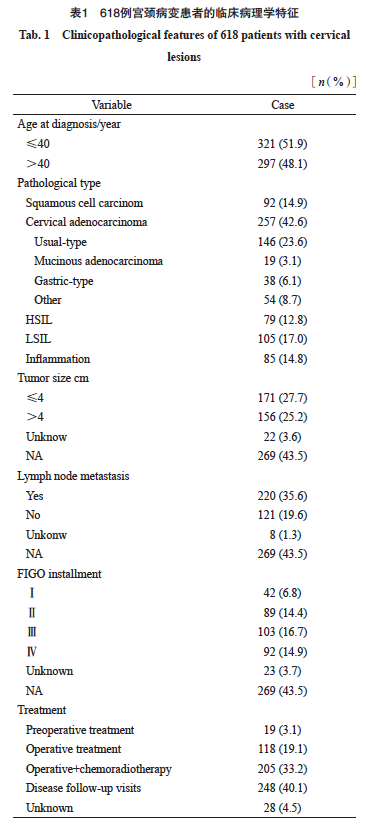
本研究获得复旦大学附属肿瘤医院医学伦理委员会的批准(伦理批号:050432-4-2307E)。回顾性收集2020年1月—2023年12月复旦大学附属肿瘤医院病理科确诊为宫颈鳞癌、宫颈腺癌、HSIL、LSIL及慢性宫颈炎的1 089例患者的临床病理学资料,排除部分随访信息缺失、IHC或HPV多亚型检测失败以及送检标本量不足的患者。最后共纳入618例患者,其中,宫颈鳞癌92例,宫颈腺癌257例,HSIL 79例,LSIL 105例,慢性宫颈炎85例,其临床病理学资料见表1。
所有病例病理取材后30 min内放置于4%甲醛溶液中固定12 h以上且不超过48 h;固定后将标本置于Leica HistoCore PEGASUS全自动组织脱水机(德国Leica公司)中,按75%、90%、95%、100%乙醇浓度梯度脱水,每个梯度常温常压5 min,结束后100%乙醇10 min;梯度脱水后分别在二甲苯Ⅰ、Ⅱ、Ⅲ中透明各5 min;在石蜡 Ⅰ、Ⅱ、Ⅲ中完成浸蜡,每缸60 min。组织浸蜡结束并完成包埋后对组织进行切片,切片厚度为4 μm,所有切片在IHC及DNA提取前,均于4 ℃冰箱中保存。
1.2 IHC检测
将4%甲醛溶液固定的石蜡包埋组织切片(4 μm)脱蜡,通过一系列酒精/水溶液复水后用3%过氧化氢溶液阻断内源性过氧化物酶,使用改良的柠檬酸盐缓冲液对组织进行热诱导抗原修复,并将其加热至110 ℃ 15 min。选用P16抗体(克隆号为E6H4,美国Roche公司),应用于靶组织60 min。使用MACH 4通用辣根过氧化物酶(horseradish peroxidase,HRP)聚合物检测系统(美国Biocare Health公司)完成P16抗体的检测后使用3,3’-二氨基联苯胺(3,3’-diaminobenzidine,DAB)显色。载玻片用改良的Mayer苏木精进行短暂复染。IHC-P16均采用全自动IHC染色仪(美国Ventana公司)检测[9]。IHC-P16判断方法如下:局灶着色或无色判断为P16阴性;当宫颈鳞状上皮自基底层至副基底层的细胞呈弥漫、连续着色时则判断为P16阳性[10]。所有IHC结果均由2名以上经验丰富的病理科医师阅片复核。
1.3 DNA提取及HPV检测
从石蜡组织中提取DNA,4 μm石蜡包埋组织切片3~5张,脱蜡和水化后,其中1张H-E染色用于观察肿瘤富集区域,将剩余白片对应区域刮入试管中并加入裂解液、蛋白酶K和RNA酶,采用QIAsymphony DNA迷你试剂盒通过全自动提取仪[凯杰企业管理(上海)有限公司]提取DNA,具体操作步骤按试剂盒说明书进行。并使用NanoDrop 2000超微量分光光度计对提取的DNA进行质检(10 ng/μL≤浓度≤100 ng/μL,1.6≤D260 nm/D280 nm≤2.1)。
采用反向点杂交法检测HPV多亚型,其中包含18种高危型(high-risk,HR)-HPV亚型(16、18、31、33、35、39、45、51、52、53、56、 58、59、66、68、73、82和83)及5种低危型(low-risk,LR)-HPV亚型(6、11、42、43和81)。HPV检测试剂盒货号为YNSC3202312398 [亚能生物技术(深圳)有限公司],该试剂盒包含试剂Ⅰ和试剂Ⅱ,试剂Ⅰ为预混液,包含HPV聚合酶链反应(polymerase chain reaction,PCR)扩增所需的引物、Mg2+、酶等,将富集肿瘤DNA 5 μL加至20 μL预混液中,按试剂盒要求及条件进行PCR,反应条件为:预变性50 ℃10 min,95 ℃ 15 min;94 ℃ 30 s,42 ℃ 90 s,72 ℃ 30 s,共进行30个循环;72 ℃ 5 min后结束PCR。试剂Ⅱ为杂交反应膜条,将膜条放入杂交盒内,并放置于亚能YN-48全自动杂交仪[亚能生物技术(深圳)有限公司]中进行检测,将PCR产物加入对应含有膜条的杂交盒内开始全自动杂交。在杂交仪中经过30 min PCR扩增产物与膜条杂交,洗涤未结合探针后加入3,3',5,5'-四甲基联苯胺(3,3',5,5'-tetramethylbenzidine,TMB)进行显色反应,显色15 min后可获得稳定结果。HPV判断方法:待杂交结束后,将反应膜条取出,膜条中的数字代表相应HPV亚型,内对照(internal control,IC)点为人持家基因β-actin,首先观察膜条中内控区域(IC点),如有清晰蓝色杂交点,则该膜条结果可用,若IC点不显色,则模版DNA质量差或含量极低,结果不可信。根据膜条上蓝色斑点显现位置读取相应位置上的基因型信息,若IC显色但其他亚型均无显色则为HPV阴性。
1.4 统计学处理
采用SPSS 21.0软件对数据进行统计学分析。统计各组HPV阳性率、HR-HPV阳性率,IHC-P16阳性率,同时计算灵敏度、特异度及一致率,结果以百分比表示,计算公式为:灵敏度=真阳性/(真阳性+假阴性);特异度=真阴性/(真阴性+假阳性)。计数资料以[n/n(%)]表示,灵敏度和特异度检测基于Fisher精确概率法,应用McMemar检验及Cohen Kappa协同分析,Kappa值及意义:Kappa值<0.00为相关性强度较弱;0.00~0.20为相关性强度较轻;0.21~0.40为相关性强度尚好;0.41~0.60为相关性强度中等;>0.61为相关性强度较高。将HPV结果分为3层:HPV16/18阳性、其他亚型阳性、阴性;将IHC-P16结果分为P16阳性和P16阴性,采用Spearman等级相关性分析,分别对宫颈鳞癌、腺癌、HSIL、LSIL及慢性宫颈炎中P16表达与HPV16/18阳性、其他亚型阳性、阴性进行相关性分析。P <0.05为差异有统计学意义。
2 结 果
HPV总体阳性率为62.9%(389/618),P16阳性率为48.7%(301/618)。HPV亚型分布以16、18亚型为主,具体分布见表2。其中宫颈鳞癌中有7例(7/92,7.6%)为HPV多种亚型感染,宫颈腺癌中有5例(5/257,1.9%)为HPV多种亚型感染,HSIL中有8例(8/79,10.1%)为HPV多种亚型感染,LSIL及慢性宫颈炎中分别有24例(24/105,22.8%)及7例(7/85,8.2%)为HPV多种亚型感染。
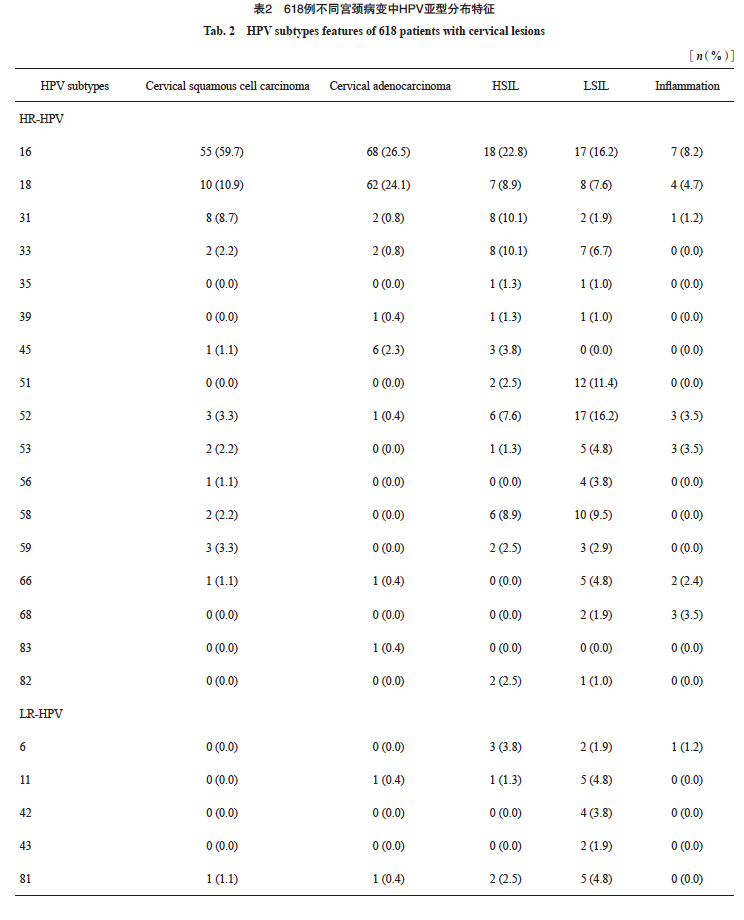
2.1 宫颈鳞癌中IHC检测P16与DNA检测HR-HPV阳性率的相关性
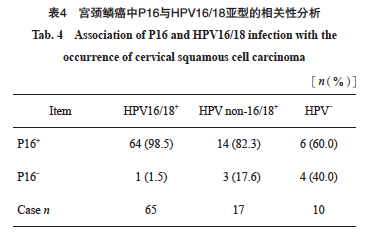
在92例宫颈鳞癌中,HPV阳性82例,阳性率为89.1%。HR-HPV阳性81例,阳性率为88.0%,LR-HPV阳性1例,阳性率为1.0%。IHC-P16阳性84例,阳性率为91.3%。其中HPV16亚型55例(55/81,67.9%),HPV18亚型10例(10/81,12.3%)。81例HR-HPV阳性病例中78例同时表现为P16阳性,P16在宫颈鳞癌中反映HR-HPV感染的灵敏度为96.3%,特异度为45.5%(表3)。P16与HR-HPV检测的总体一致率为90.2%(83/92),P16与HR-HPV结果差异无统计学意义且两种检测方法具有中等相关性(P>0.05,Kappa=0.473)。对HR-HPV与P16结果不一致的病例进行分析,3例HR-HPV阳性而P16阴性病例中,2例为HPV16弱阳型,1列为HPV33亚型(图1);在6例HPV阴性而P16阳性病例中, 5例为穿刺活检组织且肿瘤百分比较低,介于5%~15%之间(图2)。进一步分析P16阳性与HPV16/18的相关性,发现在宫颈鳞癌中,P16表达与HPV16/18阳性具有显著相关性(rs=0.423,P<0.000 1,表4)。
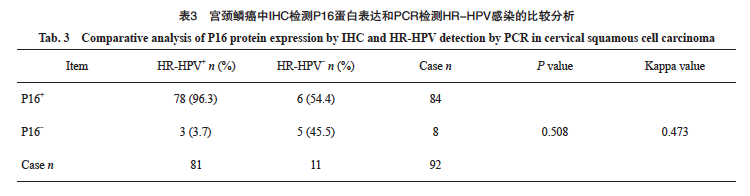
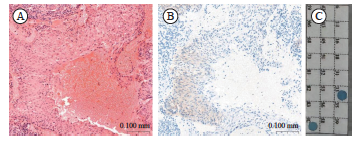
图1 宫颈鳞癌P16阴性而HPV阳性病例
Fig. 1 The case of cervical squamous cell carcinoma with P16 negative and HPV positive
A: Cervical squamous cell carcinoma (H-E staining, ×20); B: P16 immunostaining showed negative staining in the tumors; C: A representative PCR positive for LR-HPV DNA.
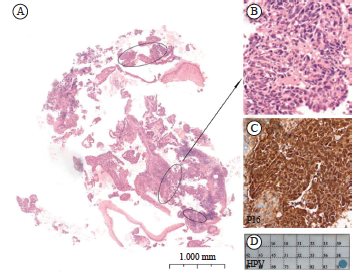
图2 宫颈鳞癌P16阳性而HPV阴性病例
Fig. 2 The case of cervical squamous cell carcinoma with P16 positive and HPV negative
A: Low-power scan of the cervical squamous cell carcinoma with about 15% of tumor cell content (the tumor area was highlighted by the circles) (H-E staining, ×10); B: The histological morphology of the cervical squamous cell carcinoma (H-E staining, ×40); C: P16 immunostaining showed positive staining in the tumors; D: Representative PCR showed negative in detection of HPV.
2.2 宫颈腺癌中IHC检测P16与DNA检测HR-HPV阳性率的相关性
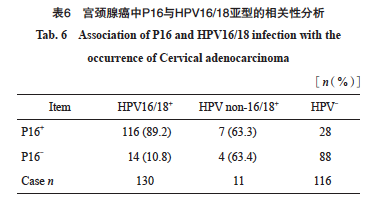
在257例宫颈腺癌中,HPV阳性141例,阳性率为54.9%。HR-HPV阳性140例,阳性率为54.5%,LR-HPV阳性1例,阳性率为0.4%。IHC-P16阳性151例,阳性率为58.8%。其中HPV16亚型68例(68/140,48.6%),HPV18亚型62例(62/140,44.3%)。140例HR-HPV阳性病例中123例同时表现为P16阳性,P16在宫颈腺癌中反映HR-HPV感染的灵敏度为87.9%,特异度为76.1%(表5)。P16与HR-HPV检测的总体一致率为82.5%(212/257)。P16与HR-HPV结果差异无统计学意义且两种检测方法具有高度相关性(P>0.05,Kappa=0.644)。对45例HR-HPV与P16结果不一致的病例进行分析,17例HR-HPV阳性而P16阴性病例中,15例诊断为腺癌(未进一步分类),1例为黏液腺癌,1例胃型腺癌,其中该例胃型腺癌明确诊断为非HPV相关型,且未合并其他宫颈病变,IHC结果P16阴性,但HPV为31亚型(图3A~3C);28例P16阳性而HR-HPV阴性病例中,16例为腺癌(未进一步分类),6例腺癌(非特指),7例腺癌(透明细胞型),1例胃型腺癌,其中该例胃型腺癌为P16强阳性,HPV阴性(图3D~3F)。进一步分析P16阳性与HPV16/18的相关性,发现在宫颈腺癌中,P16表达与HPV16/18阳性具有显著相关性(rs=0.654,P<0.000 1,表6)。
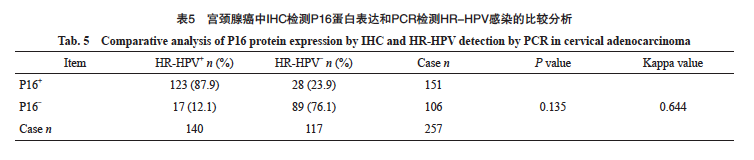
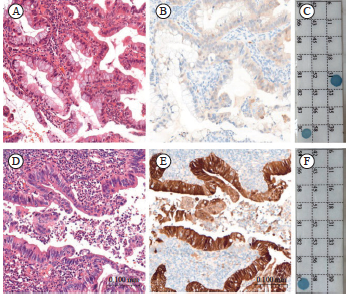
图3 宫颈胃型腺癌IHC-P16与HPV结果不一致病例
Fig. 3 The case of gastric type cervical adenocarcinoma discrepant findings between IHC-P16 and HPV
A: Gastric type cervical adenocarcinoma, non-HPV associated adenocarcinoma (H-E staining, ×20); B: P16 immunostaining showed negitive staining in the tumors; C: A representative PCR positive for HR-HPV DNA; D: Gastric type cervical adenocarcinoma, non-HPV associated adenocarcinoma (H-E staining, ×20); E: P16 immunostaining showed positive staining in the tumors; F: A representative PCR negitive for HR-HPV DNA.
2.3 HSIL中IHC检测P16与DNA检测HR-HPV阳性率的相关性
在79例HSIL中,HPV阳性63例,阳性率为79.7%。HR-HPV阳性60例,阳性率为75.9%,LR-HPV阳性3例,阳性率为3.8%。IHC-P16阳性56例,阳性率为70.9%。其中HPV16亚型16例(18/60,30.0%),HPV18亚型7例(7/60,11.7%)。60例HR-HPV阳性病例中51例同时表现为P16阳性,P16在HSIL中反映HR-HPV感染的灵敏度为85.0%,特异度为73.7%(表7)。P16与HPV检测的总体一致率为82.2%(65/79)。P16与HR-HPV结果差异无统计学意义且两种检测方法具有中等相关性(P>0.05,Kappa=0.547)。对14例P16与HR-HPV结果不一致的病例进行分析,9例P16阴性而HR-HPV阳性病例中,HPV16/18亚型阳性1例(16亚型),其余8例均为非HPV16/18亚型阳性(包括31、33、35、 39、45、51、52亚型);5例HR-HPV阴性而P16阳性病例中,3例为多灶性HSIL(图4)。进一步分析P16阳性与HPV16/18的相关性,发现在HSIL中,P16表达与HPV16/18阳性具有显著相关性(rs=0.478,P<0.000 1,表8)。
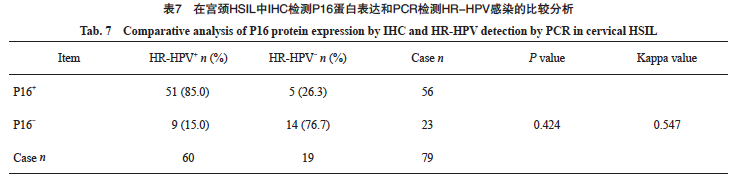
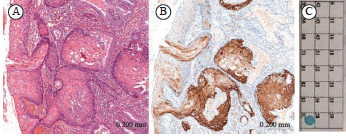
图4 宫颈HSIL中IHC-P16与HPV结果不一致病例
Fig. 4 The cervical HSIL discrepant findings between IHC-P16 and HPV
A: HSIL (H-E staining, ×20); B: P16 immunostaining showed positive staining in the tumors; C: A representative PCR negitive for HR-HPV DNA.
2.4 LSIL和慢性宫颈炎中IHC检测P16与DNA检测HR-HPV的相关性
在105例LSIL中,HPV阳性83例,阳性率为79%。HR-HPV阳性77例,阳性率为73.3%,LR-HPV阳性6例,阳性率为1.9%。IHC-P16阳性9例,阳性率为8.5%。其中HPV16亚型17例(17/77,22.1%),HPV18亚型8例(8/77,10.4%)。77例HR-HPV阳性病例中8例同时表现为P16阳性;28例HR-HPV阴性病例中,1例P16阳性。P16在LSIL中反映HR-HPV感染的灵敏度为10.4%,特异度为96.4%(表9)。P16与HR-HPV检测的总体一致率为33.3%(35/105)。P16与HR-HPV结果具有显著差异且两种检测方法相关性强度较轻(P<0.05,Kappa=0.038)。
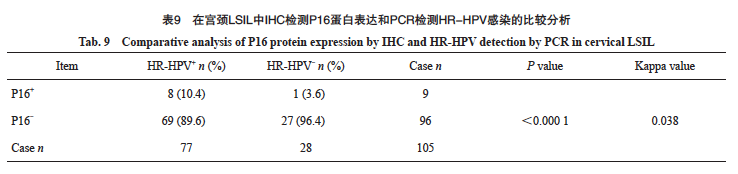
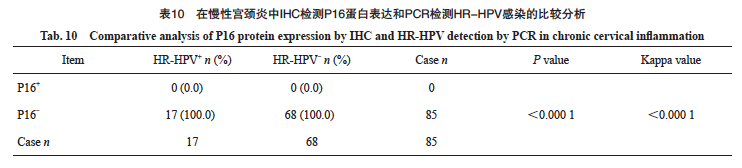
在85例慢性宫颈炎中,HPV阳性17例,阳性率为20%。HR-HPV阳性17例,阳性率为20.0%,1例病例合并LR-HPV。未见IHC-P16阳性病例,P16阳性率为0.0%。其中HPV16亚型7例(7/17,41.2%),HPV18亚型4例(4/17,23.5%)。P16在慢性宫颈炎中反映HR-HPV感染的灵敏度为0%,特异度为100%(表10)。P16与HR-HPV检测的总体一致率为80.0%(68/85)。P16与HR-HPV结果具有显著差异且两种检测方法相关性强度较弱(P<0.05,Kappa=0.000)。
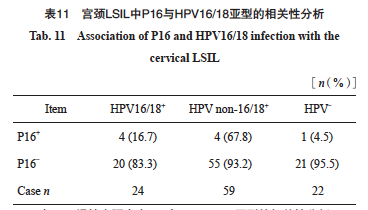
进一步分析P16表达与HPV16/18的相关性,发现在LSHL及慢性宫颈炎中,P16表达与HPV16/18阳性无显著相关性(rs=0.146,P=0.137,表11、12)。

3 讨 论
宫颈癌是常见的妇科恶性肿瘤之一,发病率逐年上升,发病率位居女性恶性肿瘤的第5位。有研究[11]表明,超过90%宫颈癌的发生、发展与HR-HPV持续感染相关。宫颈鳞癌是最常见的组织学类型,占病例总数的70%~75%;其次为宫颈腺癌,占病例总数的10%~25%[12]。宫颈病变由低级别病变至高级别病变,进而发展为宫颈癌被认为是一个连续的病理生理学过程,从低级别病变发展至宫颈癌病程可达10余年[13]。随着对宫颈癌临床病理学特征及发生机制认识的加深,仍有相当一部分宫颈癌与HPV感染不具有相关性,在接种HPV宫颈癌疫苗日趋普及的情况下,宫颈鳞癌发病率已出现下降趋势,而宫颈腺癌发病率有所升高[14]。宫颈病变在病理学诊断时,单一H-E切片在组织病理学镜检中容易受个人主观判断及取材等因素影响,造成不同医师诊断不一致,尤其对于LSIL(CIN1级)及HSIL(CIN2、CIN3级),而HPV状态对于宫颈上皮内病变具有重要辅助诊断价值。因此本研究分析临床中常用的HPV DNA与IHC-P16检测的相关性,对宫颈病变的准确诊断及宫颈癌精确分型具有重要意义。
P16是一种调节细胞生长和增殖的肿瘤抑制因子,在宫颈恶性病变中常呈高表达,因此P16在宫颈各阶段病变中具有重要的诊断价值。在HPV感染的情况下,HPV mRNA编码的致癌蛋白E6、E7蛋白在病毒的复制过程中发挥重要作用,参与宫颈癌的发生、发展[15]。HPV编码的E6蛋白可以稳定和修复染色体端粒末端的DNA序列,进而调控细胞周期;编码的E7蛋白可通过多种途径抑制Rb活性,阻断P16结合CDK4/6,提高P16NK4A基因的转录和翻译,致使P16蛋白过表达。因此IHC-P16结果常作为间接反映HPV感染状态的指标之一。由于P16/Cyclin D1竞争性结合CDK4/6从而负反馈调节P16蛋白表达这一通路受多种因素调节,因此并不能完全准确地反映HPV的感染状态。病理学诊断过程中出现IHC-P16结果与HPV检测不一致时,会给医师客观诊断带来困扰。因此,本研究从宫颈病变的进程及病理学类型两个方面,对P16与HPV的一致率进行比较分析,为医师选择合适的诊断指标提供参考 依据。
除IHC检测P16蛋白外,目前针对HPV的分子检测包含DNA和RNA两个层面,本研究采用的反向点杂交法是从DNA层面对HPV进行检测,主要针对HPV的L1编码蛋白的相应DNA区域[16]。本研究中宫颈鳞癌的HPV阳性率为88%,HR-HPV与P16蛋白表达的一致率为90.2%,P16可以很好地反映HR-HPV感染(灵敏度为96.3%),但仍有有6例P16表现为弥漫强阳性而HPV DNA为阴性,分析其原因,其中5例均为活检标本,1例为肺转移灶切除标本,5例活检肿瘤百分比介于5%~15%,因此肿瘤细胞百分比低及提取DNA浓度和质量均欠佳可能是造成HPV检测阴性的主要原因之一。另外,有研究[17]显示,随着病变程度的不断增加,当LSIL进展为宫颈鳞癌后,游离于细胞质内的HPV会逐步整合到宿主DNA中,在整合过程中,常发生L1编码区段的丢失,这也使得DNA层面的HPV分子检测在宫颈鳞癌中后期的检出能力有所降低从而产生假阴性的可能,这可能是我们检测的1例宫颈鳞癌肺转移标本中,难以检测到HPV感染的原因之一。虽然P16在宫颈鳞癌中与HPV检测的一致率较高,可以作为替代检测手段,但对于转移灶的鉴别诊断,仍要结合病史IHC-P16及HPV结果综合评判HPV感染的真实状态。
对于宫颈腺癌而言,新版世界卫生组织(World Health Organization,WHO)分类[18]更着重强调依据HPV感染进行分类,即HPV相关性腺癌和非HPV相关性腺癌,HPV相关性腺癌中,普通型占60%~80%,黏液型占5%~10%;非HPV相关性腺癌则以胃型腺癌为主,其次为子宫内膜样腺癌及少量中肾型腺癌。目前大多医疗机构仍根据形态学表现及P16蛋白水平和Ki-67增殖指数初步推断其与HPV的相关性[8]。P16在宫颈腺癌中的阳性率为60%~80%[19],本研究对257例宫颈腺癌进行分析发现,P16阳性率为58.8%,与现有研究结果基本一致。通过P16作为HPV阳性的判断依据时,141例HPV阳性病例中,仅有123例表现为P16阳性,其灵敏度为86.9%,特异度为76.1%。胃型腺癌作为最常见的非HPV相关性腺癌,HPV及P16多为阴性,本研究中2例明确诊断为胃型腺癌,1例出现P16弥漫阳性,1例为HR-HPV31亚型,提示在宫颈腺癌的HPV感染检测中P16蛋白和HPV-DNA检测都有可能出现假阳性的可能。有文献[20]指出,26%的健康人群中存在HPV感染,如出现长期慢性炎症、机体免疫低下等因素时,瞬时感染的HPV仍处于游离状态,虽然未整合至上皮细胞的宿主DNA中,但此时HPV检测仍可能出现阳性结果,这也是非HPV相关性腺癌中,HPV检测仍可能为阳性的原因之一。同时有研究[21]指出,通过显微切割,对肿瘤组织精确分离,提取肿瘤组织DNA时避免周缘上皮组织的干扰,能够降低非HPV相关性腺癌中HPV的阳性率。同时,P16作为间接反映HPV感染的检测指标,P16的表达受多种因素调节。因此在宫颈腺癌中,病理科医师在判断HPV感染情况时,不能够完全以宫颈鳞癌P16表达模式推断HPV感染情况,一方面应充分认识到非HPV相关性腺癌患者仍存在HPV潜在感染可能,但该感染并非直接致癌因素[21];另一方面P16可能因其他机制导致高表达而非HPV感染所致。对于两者不一致或与病理学形态不一致的病例除了对相关检测(IHC和PCR)结果进行仔细复核,还可采用HR-HPV E6/E7 mRNA等方法进一步验证,特别是在非HPV相关性腺癌中如出现P16或HPV DNA阳性的情况时。
已有研究[22]表明,在慢性宫颈炎、轻度鳞状上皮不典型增生及大部分CIN1级宫颈LSIL中P16几乎不表达,或表达为个别阳性,此种表达模式通常被认为是P16阴性,但随着疾病进展,在CIN2、CIN3级宫颈HSIL及中度不典型增生中,P16阳性率显著增加,表现为细胞核深染的弥漫强阳性。虽然在宫颈病变的诊断中P16染色不代表任何病变级别,但是在CIN2级病变鉴别困难时仍可辅助诊断[23-24]。本研究的79例宫颈HSIL患者中,63例HPV阳性,其中P16阳性51例,灵敏度为85.0%;105例宫颈LSIL患者中,83例HPV阳性,其中仅9例P16呈阳性,灵敏度为10.8%;85例慢性宫颈炎中,P16全部为阴性,但仍有17例检测出HPV阳性。因此,随着宫颈病变程度加重,HPV感染率逐渐提高,此时P16反映HPV感染的灵敏度较低,尤其会漏检HPV16/18亚型之外的HR感染,若有进一步治疗需求时,仍需加做HPV分子学检测或参考宫颈细胞学液基薄层细胞学检查(thinprep cytologic test,TCT)+HPV检测结果。
现阶段,对于宫颈病变的活检和锥切以及宫颈恶性病变的组织标本,HPV定性及定量分析尚无“金标准”,相较于各类指南对宫颈脱落细胞学及宫颈癌筛查对HPV检测标准的制定,组织学HPV检测仍无相关指南参考。然而在组织病理学诊断中,HPV感染状态的明确对于提供准确病理学报告至关重要。因此本研究通过对蛋白层面(P16)及DNA层面(HPV反向点杂交法)判断HPV感染进行方法学比较,通过对618例不同阶段宫颈病变组织样本的研究发现,P16仅在宫颈鳞癌中作为反映HPV感染的指标时具有较高的灵敏度,可以作为反映HPV感染的指标;在宫颈腺癌及其他不同程度的上皮内病变中,结合本研究数据,P16作为常规诊断指标外,同时均应加做HPV检测,整合P16与HPV检测结果共同评价。对于HPV阳性而P16阴性的患者,应充分考虑HPV阳性是否为直接致病因素,或一过性感染,为患者提供准确信息;对于P16阳性而HPV阴性的患者,在排除由于HPV检测因为转录丢失等原因造成的假阴性结果外,要考虑是否为其他通路激活而造成P16阳性。基于本研究对病例的组织病理学诊断、P16表达检测及HPV DNA水平检测,认为DNA相关的HPV PCR检测仍可能是确定HPV感染情况的“金标准”。此外,P16与HPV检测的一致率同样取决于所感染HPV的亚型,在宫颈鳞癌、宫颈腺癌及HSIL中HPV16/18型感染与P16具有更高的一致率,而其他类型HPV感染,尤其是LR-HPV,P16灵敏度更低。关于两者不一致的具体机制及与病理学类型的关系尚需深入研究,在今后的实践中,还应进一步提高数据量,引入更多检测方法进行比较,以组织病理学类型为基础,对IHC、DNA/RNA多种方法学进行一致率及关联性分析,为宫颈病变的精准诊断及分型提供更多参考依据。
第一作者:
王皓晨,博士,主管技师。
通信作者:
任敏,博士,主治医师。
作者贡献声明:
王皓晨,任敏:确定、设计选题,收集并分析数据,撰写文章;贾利晴,杨瑜,王乾,郁成礼:进行实验;田田,凃小予,毕蕊:提供研究思路,分析研究方案可行性;柏乾明,朱晓丽,周晓燕,任敏:提供研究思路,分析研究方案可行性,参与文章的修订及终版文章的审核。
[参考文献]
[1] MIKAMI Y. Gastric-type mucinous carcinoma of the cervix and its precursors-historical overview[J]. Histopathology, 2020, 76(1): 102-111.
[2] MA X M, HARRIPERSAUD K, SMITH K, et al. Modeling the epidemiological impact and cost-effectiveness of a combined schoolgirl HPV vaccination and cervical cancer screening program among Chinese women[J]. Hum Vaccin Immunother, 2021, 17(4): 1073-1082.
[3] LARQUE A B, CONDE L, HAKIM S, et al. P16 (INK4a) overexpression is associated with CDKN2A mutation and worse prognosis in HPV-negative laryngeal squamous cell carcinomas[J]. Virchows Arch, 2015, 466(4): 375-382.
[4] WANG J L, ZHENG B Y, LI X D, et al. Predictive significance of the alterations of p16INK4A, p14ARF, p53, and proliferating cell nuclear antigen expression in the progression of cervical cancer[J]. Clin Cancer Res, 2004, 10(7): 2407-2414.
[5] FERRIS R L, WESTRA W. Oropharyngeal carcinoma with a special focus on HPV-related squamous cell carcinoma[J]. Annu Rev Pathol, 2023, 18: 515-535.
[6] KIAN ANG K, HARRIS J, WHEELER R, et al. Human papillomavirus and survival of patients with oropharyngeal cancer[J]. N Engl J Med, 2010, 363(1): 24-35.
[7] DA MATA S, FERREIRA J, NICOLÁS I, et al. P16 and HPV genotype significance in HPV-associated cervical cancer-a large cohort of two tertiary referral centers[J]. Int J Mol Sci, 2021, 22(5): 2294.
[8] RYU A, HONMA K, SHINGETSU A, et al. Utility of p16/ Ki-67 double immunocytochemistry for detection of cervical adenocarcinoma[J]. Cancer Cytopathol, 2022, 130(12): 983-992.
[9] ANGELICO G, SANTORO A, INZANI F, et al. An emerging anti-p16 antibody-BC42 clone as an alternative to the current E6H4 for use in the female genital tract pathological diagnosis: our experience and a review on p16ink4a functional significance, role in daily-practice diagnosis, prognostic potential, and technical pitfalls[J]. Diagnostics (Basel), 2021, 11(4): 713.
[10] ZITO MARINO F, SABETTA R, PAGLIUCA F, et al. Discrepancy of p16 immunohistochemical expression and HPV RNA in penile cancer. A multiplex in situ hybridization/immunohistochemistry approach study[J]. Infect Agent Cancer, 2021, 16(1): 22.
[11] BALOCH Z, YASMEEN N, LI Y Y, et al. Knowledge and awareness of cervical cancer, human papillomavirus (HPV), and HPV vaccine among HPV-infected Chinese women[J]. Med Sci Monit, 2017, 23: 4269-4277.
[12] HE Z M, CHEN R S, HU S Y, et al. The value of HPV genotypes combined with clinical indicators in the classification of cervical squamous cell carcinoma and adenocarcinoma[J]. BMC Cancer, 2022, 22(1): 776.
[13] NAN Z D, DOU Y, CHEN A W, et al. Identification and validation of a prognostic signature of autophagy, apoptosis and pyroptosis-related genes for head and neck squamous cell carcinoma: to imply therapeutic choices of HPV negative patients[J]. Front Immunol, 2023, 13: 1100417.
[14] GIANNELLA L, DI GIUSEPPE J, DELLI CARPINI G, et al. HPV-negative adenocarcinomas of the uterine cervix: from molecular characterization to clinical implications[J]. Int J Mol Sci, 2022, 23(23): 15022.
[15] FUSCONI M, CAMPO F, GALLO A, et al. Laryngeal cancer, HPV DNA vs E6/E7 mRNA test: a systematic review[J]. J Voice, 2017, 31(2): 248.e1-248248.e5.
[16] GRAVITT P E, PEYTON C L, APPLE R J, et al. Genotyping of 27 human papillomavirus types by using L1 consensus PCR products by a single-hybridization, reverse line blot detection method[J]. J Clin Microbiol, 1998, 36(10): 3020-3027.
[17] HERNANDEZ J, ELAHI A, SIEGEL E, et al. HPV L1 capsid protein detection and progression of anal squamous neoplasia[J]. Am J Clin Pathol, 2011, 135(3): 436-441.
[18] HÖHN A K, BRAMBS C E, HILLER G G R, et al. 2020 WHO classification of female genital tumors[J]. Geburtshilfe Frauenheilkd, 2021, 81(10): 1145-1153.
[19] LUO R Z, CHEN S L, LI M, et al. HPV E6/E7 mRNA in situ hybridization in endocervical adenocarcinoma: implications for prognosis and diagnosis[J]. Cancer Cell Int, 2021, 21(1): 643.
[20] GONZÁLEZ-YEBRA B, MOJICA-LARREA M, ALONSO R, et al. HPV infection profile in cervical lesions[J]. Gac Med Mex, 2022, 158(4): 222-228.
[21] 刘 彬, 吴泽妮, 刘潇阳, 等. 人乳头瘤病毒与子宫颈腺癌病因关系研究[J]. 中华肿瘤杂志, 2016, 38(4): 277-282.
LIU B, WU Z N, LIU X Y, et al. Distribution of human papillomavirus (HPV) among HPV positive cervical adenocarcinoma cases detected by laser capture microdisp (LCM)[J]. Chin J Oncol, 2016, 38(4): 277-282.
[22] GAJANIN R, GAJANIN Ž , VUJKOVIĆ Z, et al. Immunohistochemical expression of P16INK4a in inflammatory, preneoplastic and neoplastic cervical lesions[J]. Med Pregl, 2015, 68(3/4): 85-92.
[23] GOTHWAL M, NALWA A, SINGH P, et al. Role of cervical cancer biomarkers p16 and Ki67 in abnormal cervical cytological smear[J]. J Obstet Gynaecol India, 2021, 71(1): 72-77.
[24] CLARK J L, LU D, KALIR T, et al. Overdiagnosis of HSIL on cervical biopsy: errors in p16 immunohistochemistry implementation[J]. Hum Pathol, 2016, 55: 51-56.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)