首页 > 医疗资讯/ 正文
血管重构是内膜新生、动脉粥样硬化和肺动脉高压等多种血管疾病共同的病理学基础,发病机制极其复杂,发现更加有效的干预策略一直是血管病研究的主要目标。
2025年5月10日,南京医科大学陈琪教授研究团队在Nature Communications杂志上发表题为“Endothelial major vault protein alleviates vascular remodeling via promoting Parkin-mediated mitophagy”的研究论文,首次揭示内皮细胞穹窿主体蛋白(MVP)促进线粒体自噬、减轻血管重构的新作用机制,为建立相关疾病干预新方法提供了理论依据。

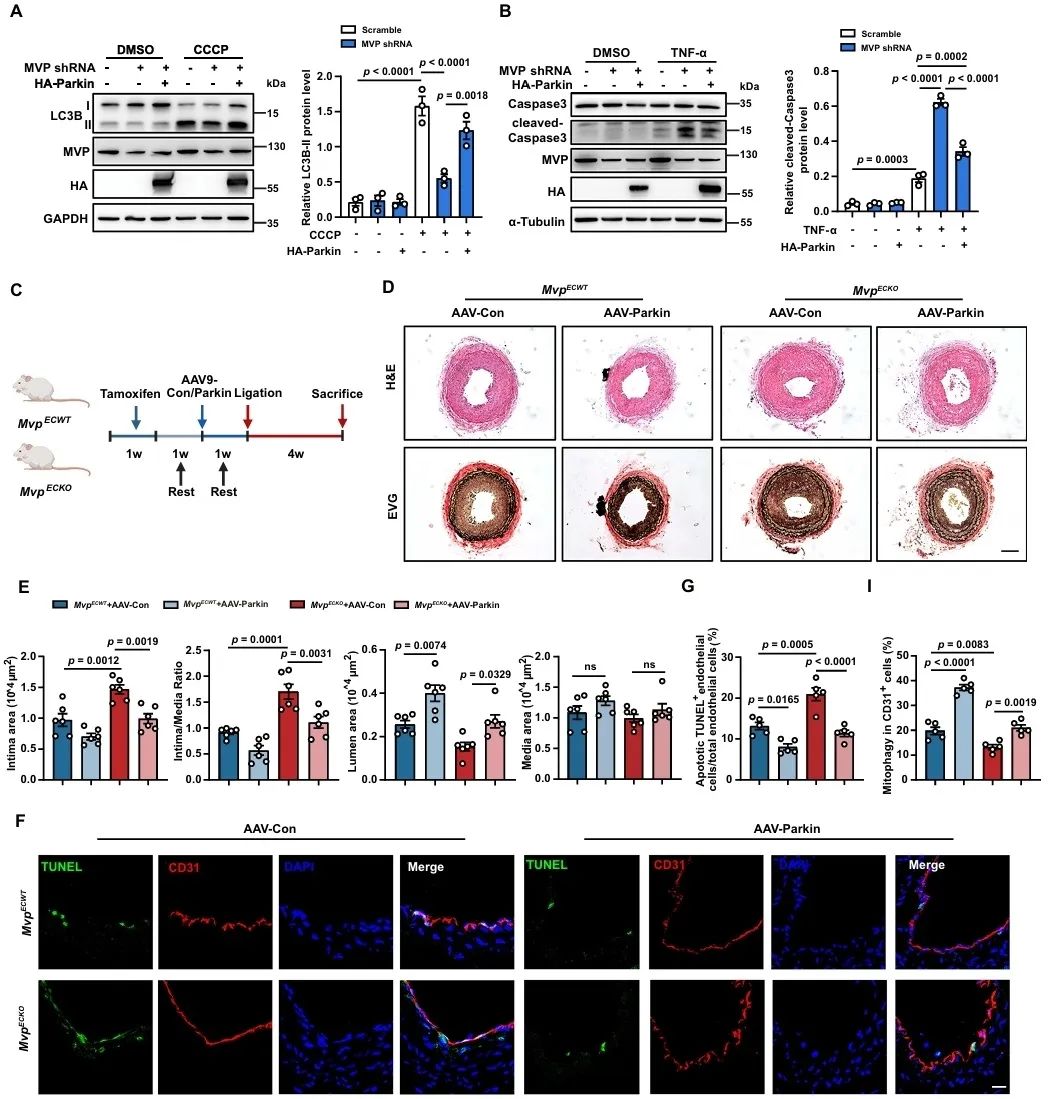
研究者在研究动脉粥样硬化和血管内膜新生的过程中发现,MVP在人和小鼠的动脉斑块和新生内膜的内皮细胞中表达上调,可能与血管生成、内皮细胞迁移和凋亡等功能有关。为了深入探究MVP对血管重构的影响,研究者构建了他莫昔芬诱导的内皮细胞Mvp特异性敲除小鼠(MvpECKO),进行颈动脉结扎建立内膜新生模型,发现内皮细胞MVP缺失明显加剧结扎侧血管内膜新生和血管狭窄。将MvpECKO小鼠与Apoe-/-小鼠杂交,获得MvpECKO Apoe-/-小鼠,结果发现这种小鼠更容易发生动脉粥样硬化。利用缺氧诱导小鼠形成肺动脉高压,可见内皮MVP缺失加重肺动脉重塑和肺动脉高压。上述结果表明,内皮细胞MVP具有拮抗血管重构的作用。
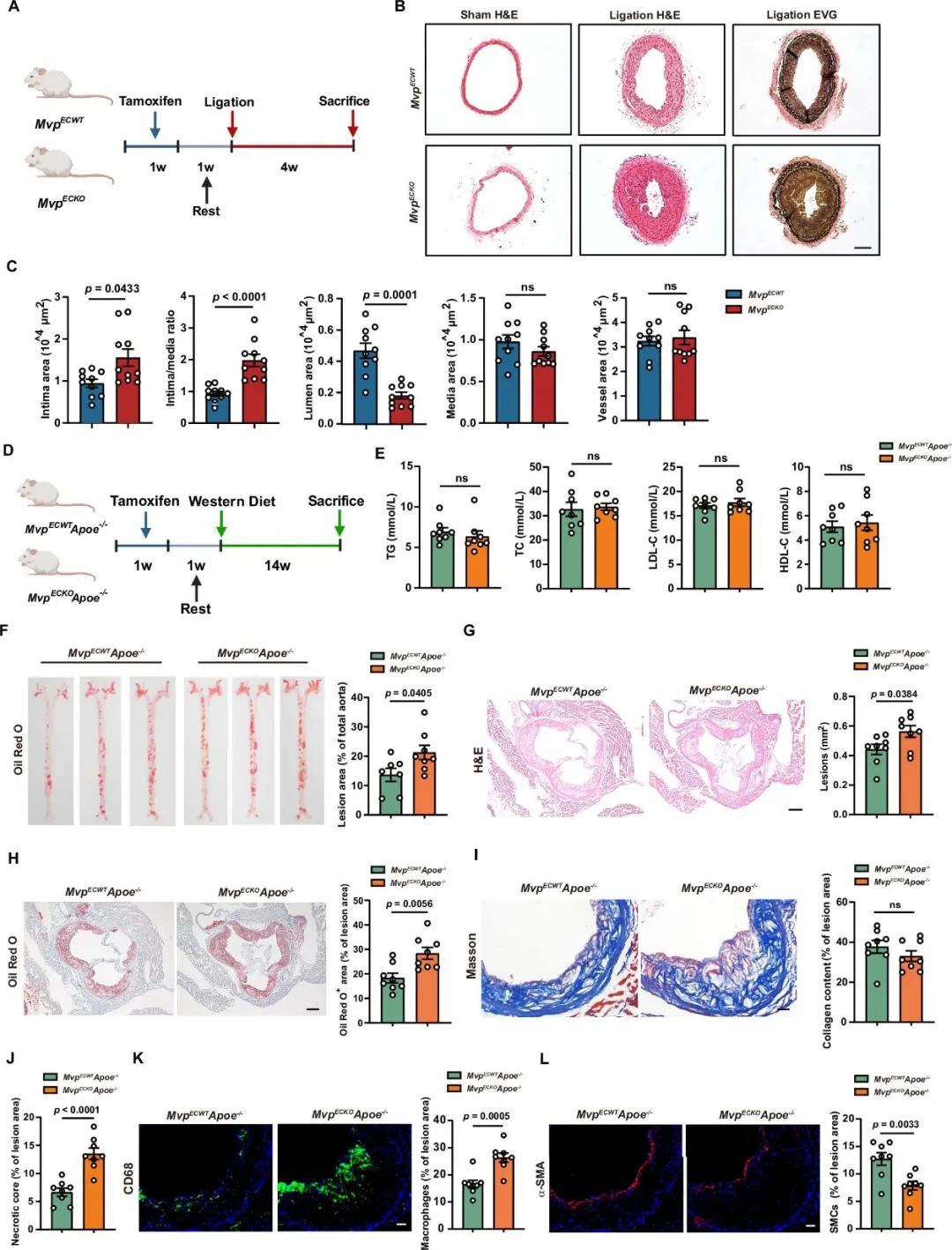
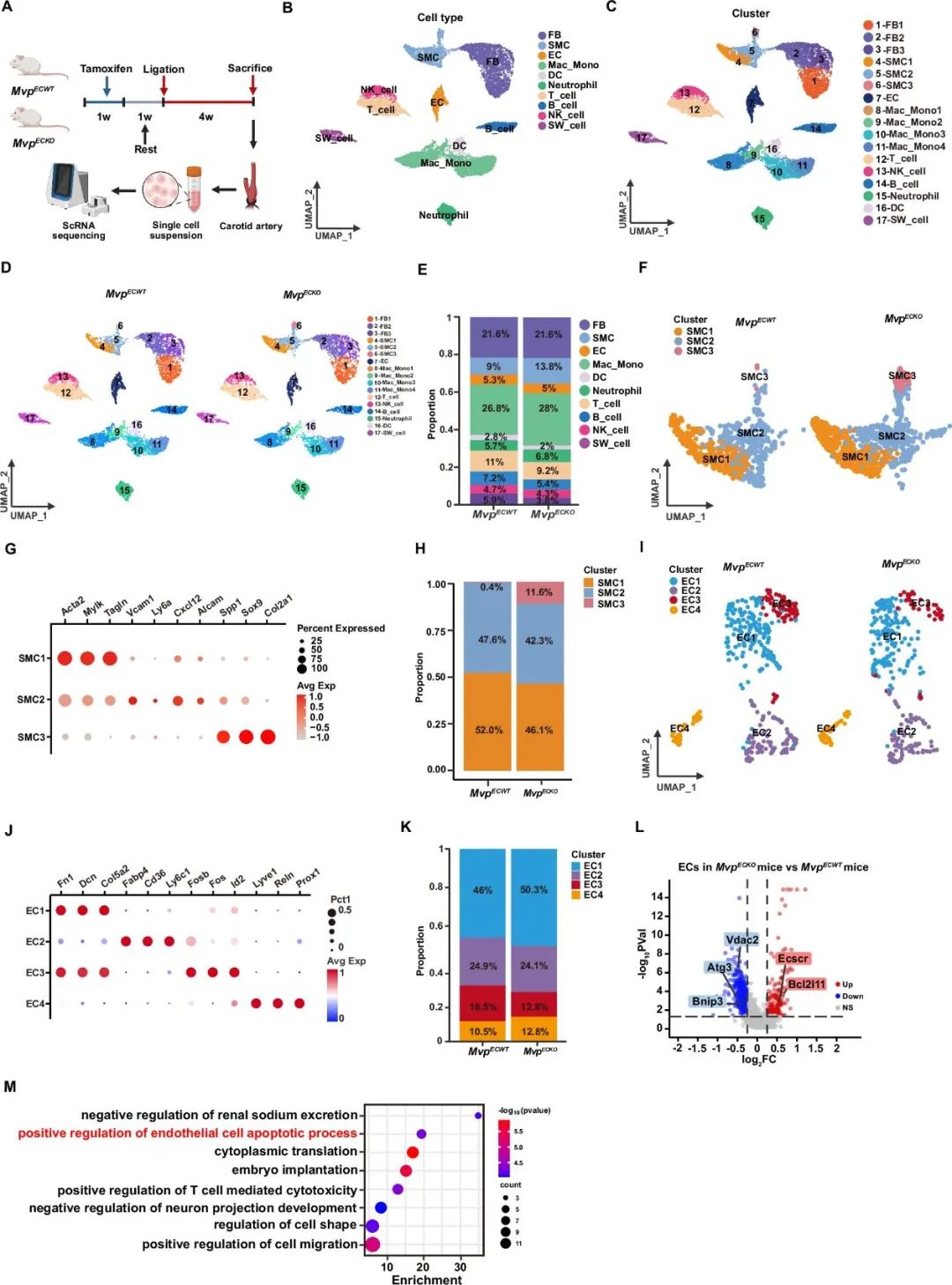
为了无偏倚表征内皮MVP缺失对内膜新生的细胞组成和表型变化的影响,研究者对结扎28天后的小鼠颈动脉开展单细胞RNA测序。结果表明,内皮MVP缺失导致血管壁细胞比例发生变化,平滑肌丰度增加,软骨细胞样SMC增多,内皮细胞中凋亡基因表达明显增加。
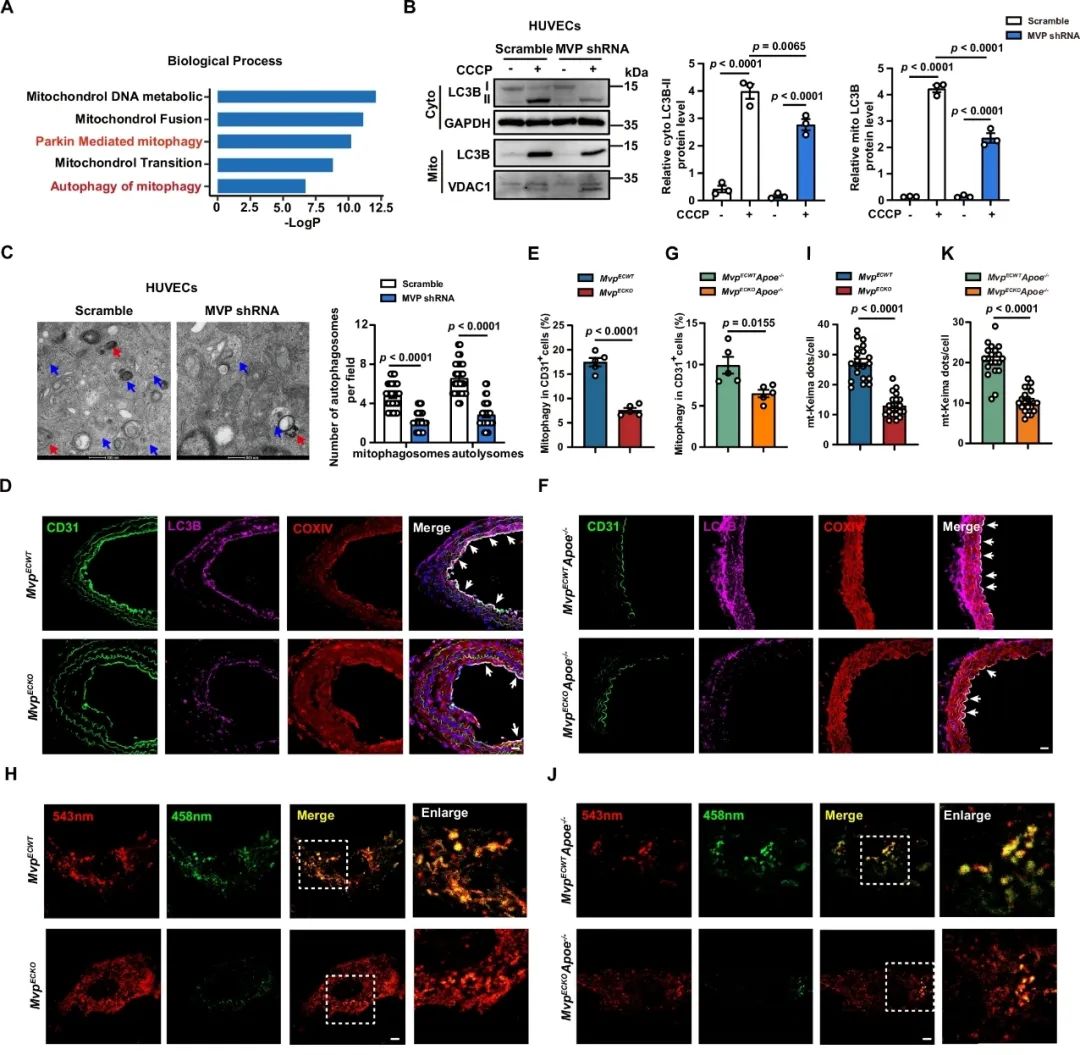
在后续的机制研究中研究者发现,MVP缺失加重内皮细胞中的氧化应激和线粒体功能障碍,下调MVP明显抑制内皮细胞线粒体中自噬标志物LC3B-II的表达,降低线粒体自噬小体和自噬溶酶体的数量。利用线粒体自噬抑制剂(CsA)处理细胞能明显逆转MVP的抗凋亡作用。在体和离体的实验结果说明,MVP可能通过促进线粒体自噬发挥抗凋亡作用。
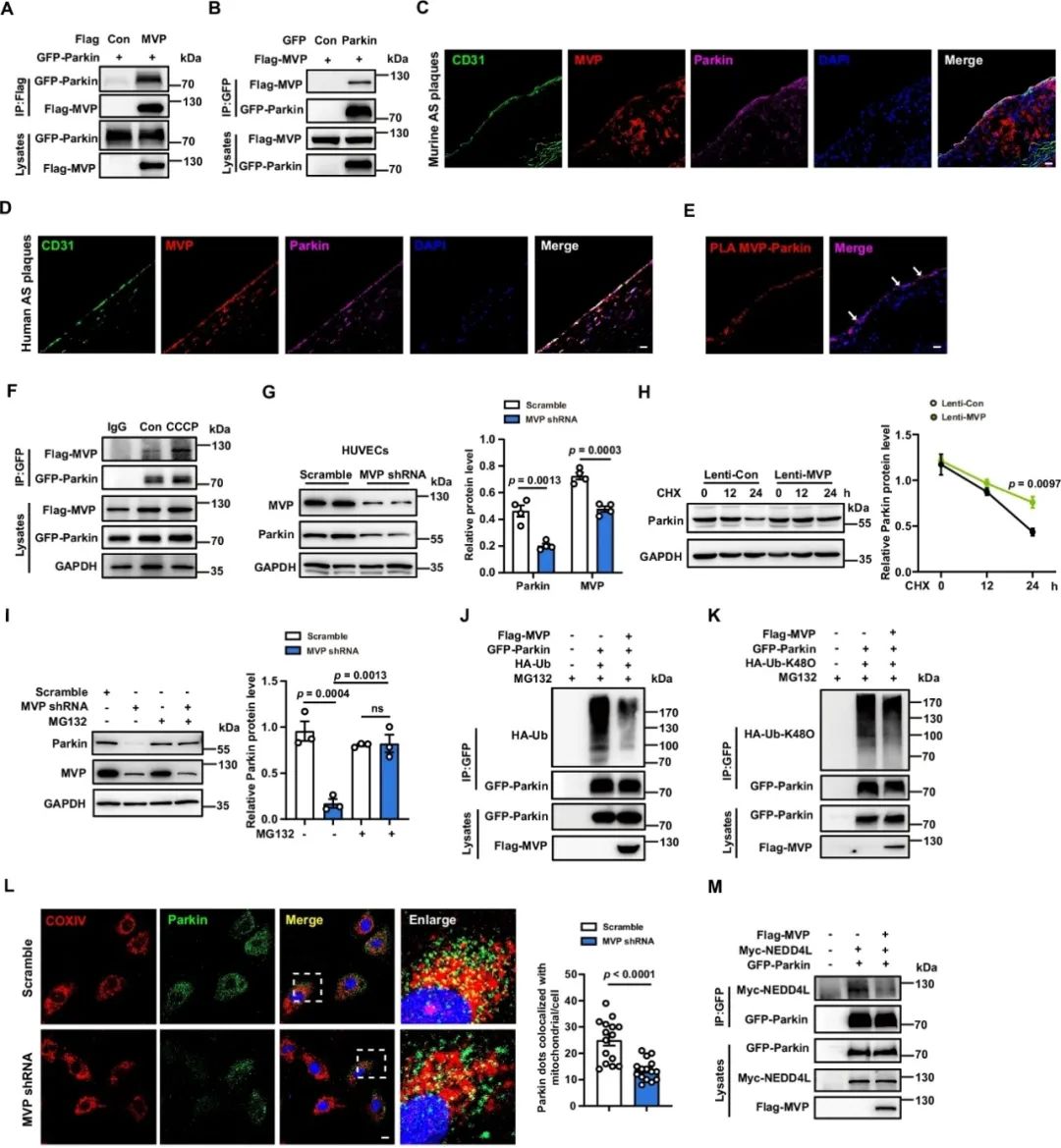
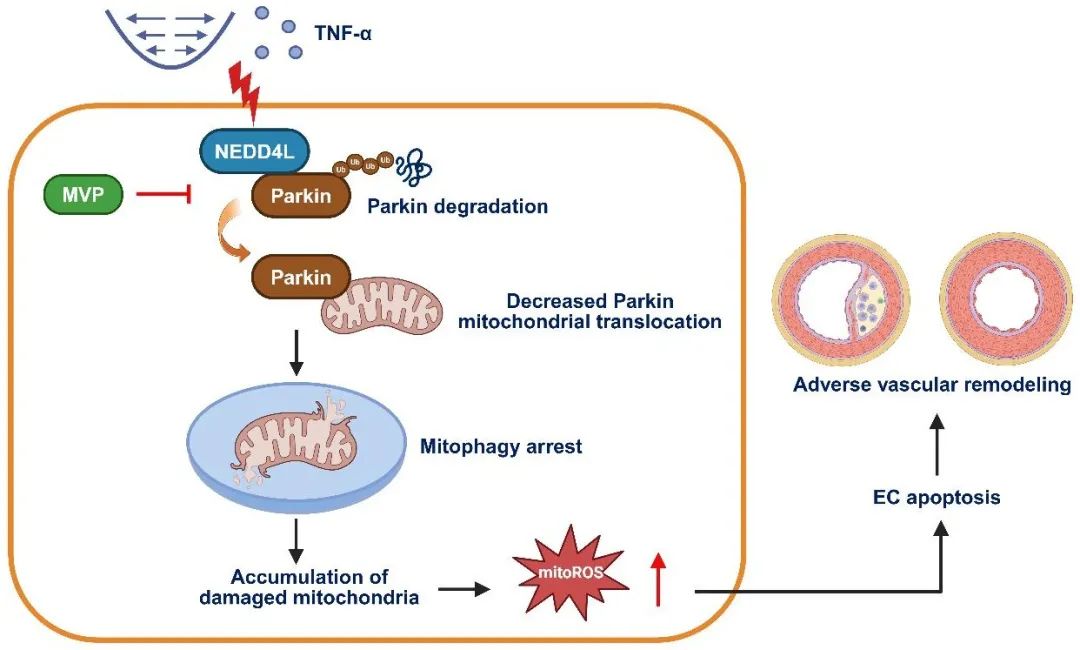
进一步的研究结果还表明,MVP与线粒体自噬的关键调控分子Parkin特异性结合,这种结合抑制了NEDD4L与Parkin的结合以及继发性的NEDD4L对Parkin的泛素化降解,从而维持Parkin稳定性,并促进其向线粒体的易位和随后的线粒体自噬。
最后,MVP-Parkin轴在内皮细胞凋亡和血管重构中的治疗学作用通过在体实验得到确认。在MvpECKO小鼠血管内皮细胞中过表达Parkin可逆转MVP缺失诱导的线粒体自噬不足和内皮细胞凋亡,显著减缓血管内膜新生。如果敲降Parkin,即使再恢复表达MVP也无对血管重构的保护作用。
综上,该项研究通过建立不同的小鼠血管重构疾病模型,发现内皮细胞MVP可以直接与Parkin结合,导致E3连接酶NEDD4L从Parkin上解离,从而抑制Parkin泛素化,激活Parkin介导的线粒体自噬,减轻内皮细胞凋亡和血管重构。该研究揭示MVP/NEDD4L/Parkin反应轴可能是阻止内膜增生和动脉粥样硬化的新靶点,不仅为阐明血管重构中内皮抗损伤机制提供了新的理论依据,还为防治重要血管病变提供了潜在分子靶点。
南京医科大学基础医学院陈琪教授、贲晶晶教授和江斌副教授为论文的共同通讯作者,南京医科大学江斌副教授、博士研究生白帆、胡运福为共同第一作者。该项研究得到国家自然科学基金、江苏省心血管病转化医学协同创新中心和江苏省心血管病分子干预重点实验室等的资助。
原文链接:
https://www.nature.com/articles/s41467-025-59644-y
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)