首页 > 医疗资讯/ 正文
自体和非自体来源的核酸是触发免疫反应的重要的危险信号。当它们在细胞质和循环中出现异常时,都可能作为损伤相关分子模式(DAMPs)和病原体相关分子模式(PAMPs),通过核酸传感器启动危险信号。在急性呼吸窘迫综合征(ARDS)、脓毒症、创伤和缺血等危重疾病中,核酸的异常积聚和大量释放被抗病毒先天免疫受体检测到,从而引发炎症反应,导致危重患者的发病和死亡。过去十年间,核酸感应在危重症中的作用逐渐受到关注,为疾病治疗提供了潜在靶点。2025年3月Christian Bode等人发表在《Signal Transduction Target Therapy》上的一篇题为《Cytosolic nucleic acid sensing as driver of critical illness: mechanisms and advances in therapy》的综述,聚焦于细胞质核酸感应,深入探讨了其在危重疾病中的作用机制及治疗进展。文章系统性地阐述了核酸感应如何通过激活先天免疫受体引发炎症反应,进而推动疾病进展。通过对DNA和RNA传感器及其配体的详细分析,揭示了核酸感应途径在急性呼吸窘迫综合征(ARDS)、脓毒症、创伤和缺血等疾病中的关键作用,并探讨了相关的治疗策略,为临床治疗提供了新的思路和靶点。

核酸传感器
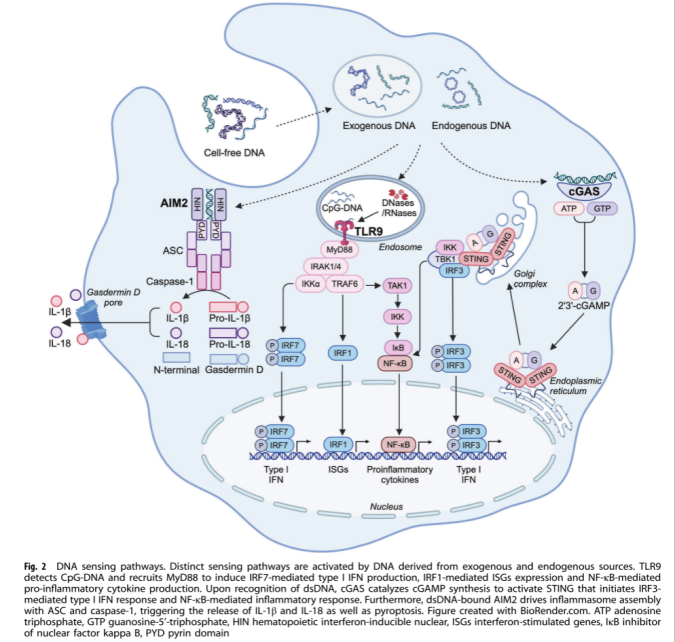
DNA传感器 (图2)
TLR9 TLR9是一种识别含有未甲基化CpG二核苷酸的DNA的受体,主要在B细胞和浆细胞样树突状细胞(pDCs)中表达。TLR9通过MyD88依赖性途径激活I型IFN反应和NF-κB,促进促炎细胞因子的释放。在失活状态下,TLR9保留在内质网中,通过高尔基体转运至溶酶体后被激活。例如,在细菌感染中,TLR9能够识别细菌DNA,激活免疫细胞,启动抗菌免疫反应。
TLR9在肿瘤免疫中也发挥着复杂的作用。一方面,它可以识别肿瘤细胞释放的DNA,激活免疫细胞,产生抗肿瘤免疫反应。例如,在某些肿瘤模型中,TLR9的激活能够促进树突状细胞的成熟和功能,增强其对肿瘤抗原的呈递能力,进而激活T细胞介导的抗肿瘤免疫。另一方面,TLR9的持续激活也可能导致免疫耐受或免疫抑制,影响抗肿瘤免疫的效果。
CGAS-STING cGAS-STING途径是识别胞质双链DNA(dsDNA)的关键途径。cGAS识别DNA后催化合成第二信使2’3’-cGAMP,激活STING,进而通过IRF3启动I型IFN反应。STING还参与自噬和程序性细胞死亡等过程。在病毒感染中,cGAS-STING途径能够有效识别病毒DNA,激活抗病毒免疫反应。
cGAS-STING途径在肿瘤免疫中具有双重作用。一方面,其激活能够促进肿瘤细胞的识别和清除,增强机体的抗肿瘤免疫。另一方面,持续的cGAS-STING激活可能导致肿瘤细胞的适应性改变,促进肿瘤的进展和转移。此外,肿瘤微环境中的细胞和因素也可能影响cGAS-STING途径的活性,进而影响肿瘤的发展。
AIM2炎症小体 AIM2是一种细胞质dsDNA传感器,通过其C末端结构域结合DNA,N末端结构域介导蛋白-蛋白相互作用。AIM2激活后,通过招募ASC和caspase-1,导致IL-1β和IL-18的释放,并引发细胞焦亡。在炎症反应中,AIM2炎性小体的激活能够有效清除病原体,但过度激活也可能导致组织损伤。
AIM2炎性小体与其他炎性小体之间存在相互作用和调控关系。例如,AIM2与NLRP3炎性小体在某些疾病中可能协同作用,共同调节炎症反应的强度和持续时间。在自身免疫性疾病中,AIM2的过度激活可能导致自身DNA的异常识别,引发自身免疫反应。在某些遗传性疾病中,AIM2基因的突变可能导致炎性小体的持续激活,引起慢性炎症和组织损伤。
其他DNA传感器 如IFI16、DDX41和ZBP1等也参与DNA感应过程,激活I型IFN和炎症反应。IFI16是一种在病毒感染中发挥重要作用的DNA传感器。它能够识别病毒DNA,激活炎性小体,促进细胞因子的释放,增强抗病毒免疫反应;DDX41作为一种DNA解旋酶,除了参与DNA感应外,还在DNA复制和修复过程中发挥重要作用,维持基因组的稳定性。在某些癌症中,DDX41的表达异常可能导致基因组不稳定,促进肿瘤的发生和发展;ZBP1能够识别DNA病毒和某些细菌DNA,激活细胞的抗病毒和抗菌反应。ZBP1的激活可诱导细胞焦亡和坏死,释放炎症介质,增强免疫反应。
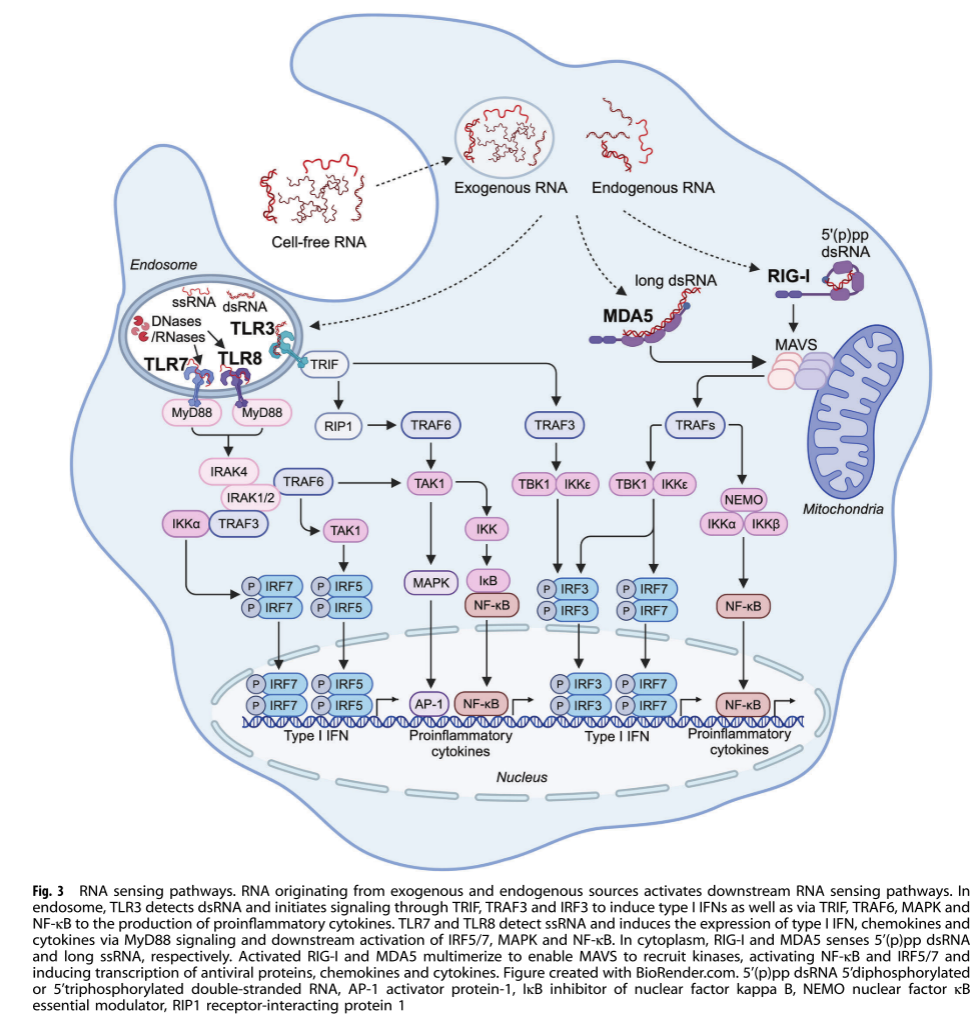
RNA传感器(图3)
TLR3/7/8 TLR3识别长双链RNA,TLR7和TLR8识别短富U双链RNA或单链RNA。它们通过TRIF或MyD88途径激活I型IFN和促炎细胞因子。例如,在病毒感染中,TLR3能够识别病毒RNA,激活抗病毒免疫反应。
TLR3、TLR7和TLR8的异常激活与多种疾病相关。在自身免疫性疾病中,这些传感器的过度激活可能导致自身RNA的异常识别,引发自身免疫反应。在某些过敏性疾病中,TLR3等传感器的激活可能参与过敏反应的启动和放大。
RIG-I样受体 RIG-I和MDA5识别双链RNA,通过MAVS激活NF-κB和IRF3/5/7,诱导I型和III型IFN产生。例如,RIG-I在流感病毒等RNA病毒的感染中发挥重要作用,能够快速启动抗病毒反应。RIG-I样受体的激活还可通过调节免疫细胞的活性和功能,影响适应性免疫反应。例如,RIG-I的激活能够促进树突状细胞的成熟和功能,增强其对T细胞的激活能力,进而增强细胞免疫反应。
其他RNA传感器 如NLRP1炎性小体和PKR等,参与RNA感应和抗病毒免疫。例如,PKR能够识别病毒RNA,抑制病毒复制。
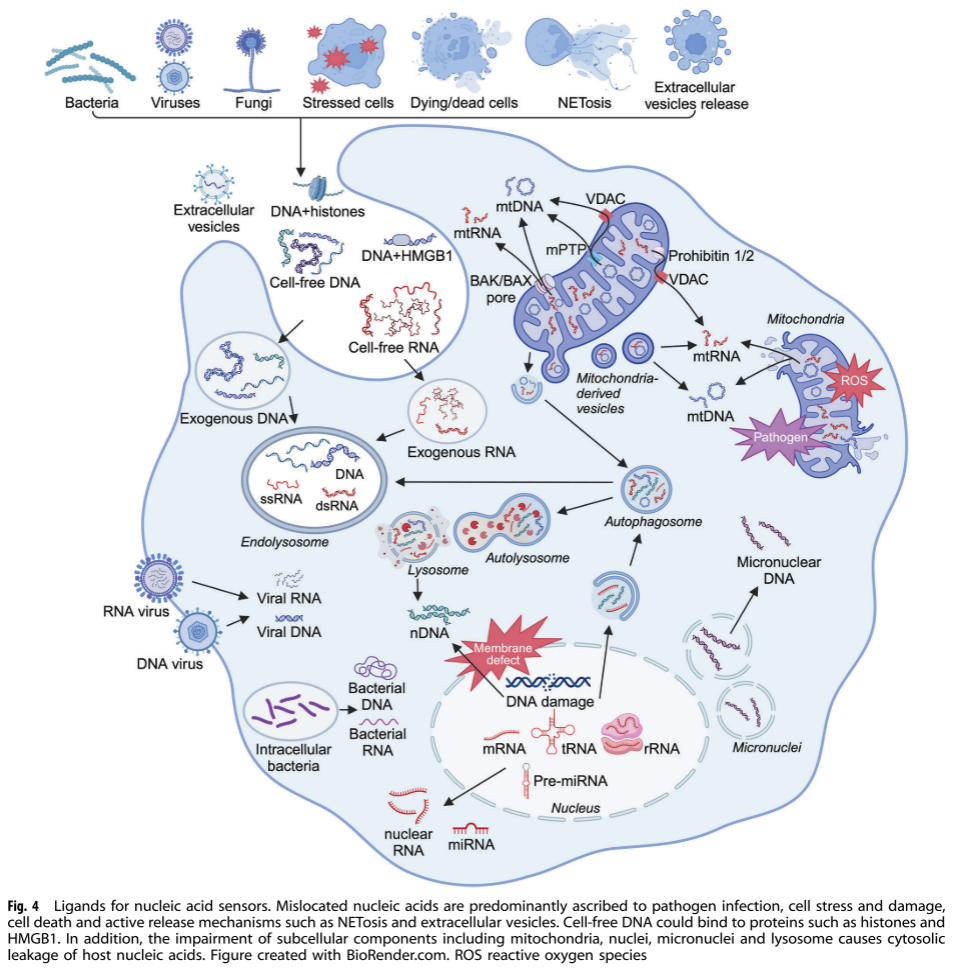
核酸传感器的配体(图 4)
非自身DNA 微生物DNA通过未甲基化的CpG基序激活TLR9等传感器,介导抗菌免疫。例如,细菌DNA中的CpG基序能够被TLR9识别,激活免疫反应。
自身DNA 内源性 DNA 来源多样,mtDNA 在应激条件下可通过线粒体通透性转换孔(mPTP)、BAX/BAK 和 VDAC 等途径释放到细胞质中,激活 cGAS-STING 等信号通路。基因组 DNA 可因核膜缺陷、溶酶体降解受损等原因释放到细胞质中,激活核酸传感器。细胞游离 DNA(cfDNA)在健康个体中也存在,但在病理状态下其水平和模式会发生显著变化,可通过多种细胞死亡机制释放,包括凋亡、自噬、坏死等。
游离RNA 由多种RNA类型组成,可通过外泌体等途径释放,具有临床意义。cfRNA 包括多种类型,如mRNA、长链非编码RNA、tRNA、microRNA和环状RNA等。它们可以通过外泌体等途径释放到细胞外,具有重要的临床意义。在危重症中,cfRNA 可作为疾病诊断和预后的生物标志物。例如,在急性呼吸窘迫综合征中,cfRNA 水平的变化可以反映肺部炎症的程度;在脓毒症中,cfRNA 的异常表达与全身性炎症反应相关。此外,cfRNA 还可以调节免疫反应,影响疾病的发展。
胞质RNA RNA 病毒在复制过程中会产生 dsRNA,可被 RNA 传感器识别。不同类型的 RNA 病毒产生的 dsRNA 长度和结构不同,激活的传感器也有所差异。真核细胞中,核 RNA 经过高度修饰,可避免被 RNA 传感器识别。而线粒体 RNA(mtRNA)结构和修饰类似于原核 RNA,在线粒体屏障功能障碍时,可被 MDA5 和 PKR 等传感器识别。
核酸感应在危重疾病中的作用
ARDS
细菌性肺炎相关性ARDS 细菌DNA通过TLR9和cGAS-STING途径激活炎症反应,导致肺损伤。例如,金黄色葡萄球菌、肺炎链球菌等细菌感染可导致肺部炎症,通过激活TLR9和cGAS-STING途径,释放促炎细胞因子,加重肺损伤。
病毒性肺炎相关性ARDS 以 IAV 感染为例,TLR9 在 IAV 感染患者中表达上调,但它在病毒肺炎相关 ARDS 中的作用存在争议。cGAS-STING 途径在 IAV 感染中被激活,可介导抗病毒免疫,但过度激活可能导致炎症和 ARDS。AIM2 炎性小体在 IAV 感染中可被激活,促进炎症反应。此外,TLR3、TLR7/8、RIG-I 和 MDA5 等 RNA 传感器在 IAV 感染中也发挥着重要作用,参与抗病毒免疫和炎症反应的调节。
COVID-19相关相关ARDS 在 COVID-19 相关 ARDS 中,SARS-CoV-2 感染可导致肺部炎症,通过激活 cGAS-STING 途径,释放大量促炎细胞因子,加重病情。研究表明,cGAS-STING 途径的过度激活可能导致炎症风暴,进一步加剧肺组织的损伤。此外,TLR3、TLR7/8 和 RIG-I 等 RNA 传感器也参与了 COVID-19 的免疫反应。例如,TLR7 在识别病毒 RNA 后,通过 MyD88 途径激活 NF-κB,促进促炎细胞因子的释放。RIG-I 则通过识别病毒 dsRNA,激活 MAVS 信号通路,诱导 I 型 IFN 的产生,增强抗病毒免疫反应。
脓毒症
DNA传感器 在脓毒症中,TLR9 和 cGAS-STING 途径的激活导致全身性炎症反应。例如,细菌 DNA 中的 CpG 基序通过 TLR9 激活免疫细胞,释放大量促炎细胞因子,如 TNF-α、IL-6 和 IL-1β,导致全身性炎症。此外,cGAS-STING 途径的激活还可诱导细胞焦亡和坏死,进一步加重组织损伤。研究表明,cGAS-STING 途径在脓毒症中的过度激活可能导致免疫抑制,影响患者的预后。
RNA传感器 TLR7/8 和 RIG-I 等 RNA 传感器在脓毒症中也发挥重要作用。例如,TLR7 在识别病毒 RNA 后,通过 MyD88 途径激活 NF-κB,促进促炎细胞因子的释放。此外,RIG-I 通过识别病毒 dsRNA,激活 MAVS 信号通路,诱导 I 型 IFN 的产生,增强抗病毒免疫反应。然而,过度的 RNA 传感器激活可能导致炎症反应失控,加重脓毒症的病理过程。
创伤
DNA传感器 在创伤后,cfDNA 的释放激活 TLR9 等途径,引发炎症反应和凝血异常。例如,创伤后,cfDNA 水平显著升高,通过激活 TLR9 途径,释放促炎细胞因子,导致炎症反应和凝血功能障碍。此外,cfDNA 还可以通过与组蛋白结合,形成核糖核蛋白复合物,进一步增强炎症反应。研究表明,cfDNA 的水平与创伤的严重程度和预后密切相关,可作为创伤后炎症反应的生物标志物。
RNA传感器 虽然 RNA 传感器在创伤中的研究较少,但 TLR7 在创伤后炎症反应中发挥一定作用。例如,TLR7 在识别 RNA 配体后,通过 MyD88 途径激活 NF-κB,促进促炎细胞因子的释放。此外,TLR7 的激活还可导致中性粒细胞的活化和募集,加重炎症反应和组织损伤。
缺血/再灌注损伤(IRI)
心肌梗死和IRI TLR9、cGAS-STING和AIM2炎性小体等途径参与心肌损伤和修复。例如,在心肌缺血后,mtDNA 释放到胞质中,激活 cGAS-STING 途径,导致心肌炎症和损伤。研究表明,cGAS-STING 途径的激活可诱导心肌细胞的焦亡和坏死,进一步加重心肌损伤。此外,AIM2 炎性小体的激活也可导致 IL-1β 和 IL-18 的释放,促进炎症反应。例如,在心肌梗死模型中,AIM2 炎性小体的激活可导致心肌炎症和功能障碍,而 AIM2 的缺失则可减轻心肌损伤。
肝IRI和肾IRI 在肝 IRI 中,DNA 和 RNA 传感器途径被激活,导致肝细胞损伤和炎症反应。例如,坏死肝细胞释放的 DNA 通过 TLR9 诱导中性粒细胞释放细胞因子,促进肝脏炎症。此外,cGAS-STING 途径的激活可导致肝细胞的焦亡和坏死,进一步加重肝损伤。在肾 IRI 中,mtDNA 释放到胞质中,激活 cGAS-STING 信号,导致肾小管上皮细胞的损伤和炎症反应。研究表明,cGAS-STING 途径的激活可诱导肾小管上皮细胞的焦亡,加重肾损伤。
核酸感应在非危重疾病中的作用
癌症 核酸感应在癌症免疫治疗中受到关注,其在控制肿瘤发展中的作用存在争议,可能与特定环境触发因素有关。
自身免疫 核酸感应异常与自身免疫疾病的发生发展密切相关,如 TLR9、cGAS-STING 途径以及 RNA 传感器的异常激活可导致自身免疫疾病。
代谢紊乱 核酸感应可影响代谢过程,在不同细胞类型和器官中具有不同的作用,如在肥胖、非酒精性脂肪性肝炎和糖尿病等疾病中,NA 感应与炎症和代谢异常相关。
衰老 随着年龄的增长,细胞内的核酸代谢和修复能力下降,导致核酸异常积聚。这些异常的核酸通过激活核酸传感器,引发慢性炎症反应,促进衰老过程。例如,在衰老的免疫细胞中,cGAS-STING 途径的激活可导致 I 型 IFN 的持续产生,引发慢性炎症。此外,线粒体功能障碍导致 mtDNA 释放到胞质中,进一步激活 cGAS-STING 途径,加重炎症反应。研究表明,SIRT6 等表观遗传调节因子的缺失可导致 cGAS-STING 途径的异常激活,促进衰老相关疾病的发生。此外,衰老细胞中核酸传感器的过度激活还可导致组织损伤和功能障碍,影响机体的健康寿命。
针对核酸传感器的治疗策略
核酸清除 通过DNase和RNase降解细胞外核酸,或使用纳米材料清除核酸,减少炎症反应。例如,重组人DNase I能够降解NETs中的DNA,减轻炎症和组织损伤。
此外,抑制胞质DNA释放和异常积累是限制DNA传感激活的另一种方式。环孢素A(一种mPTP抑制剂)、VBIT4(一种VDAC抑制剂)和MSN-125(一种BAX/BAK抑制剂)抑制mtDNA释放可阻断cGASSTING激活,减轻肝脏IRI(图5)。
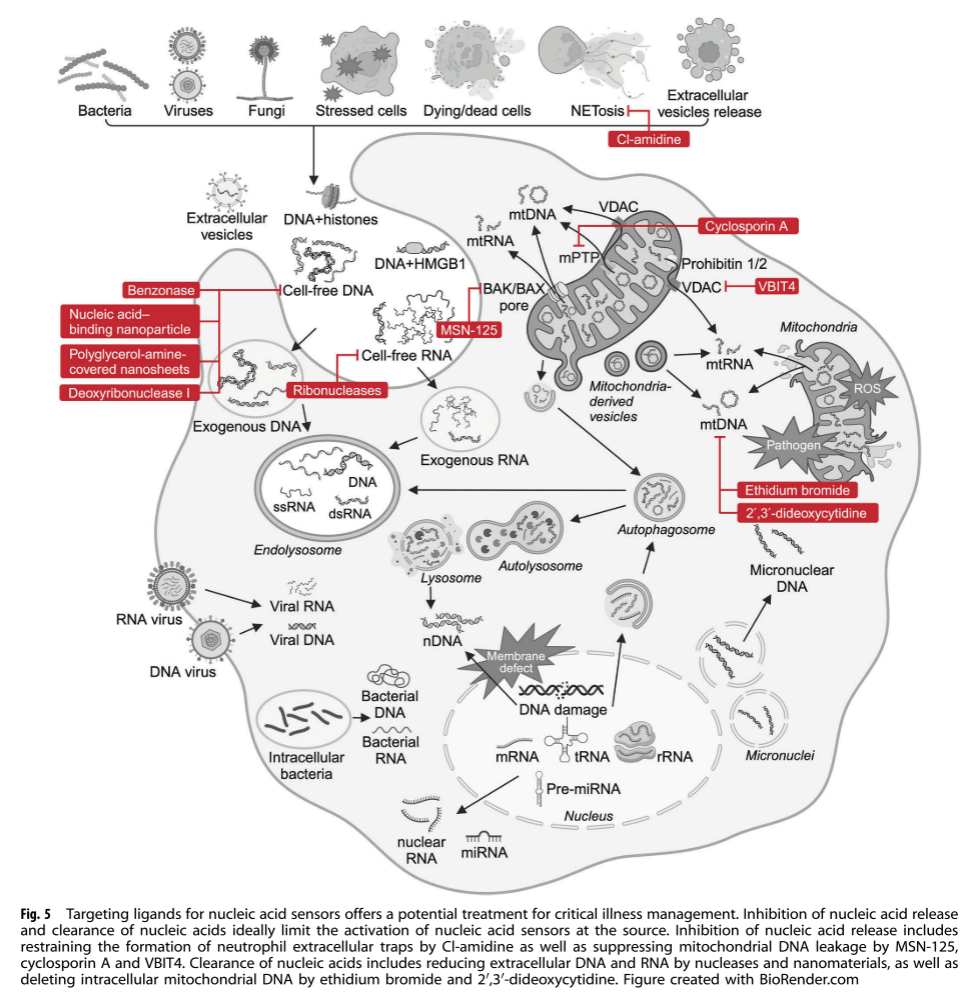
靶向DNA传感器 如TLR9、cGAS-STING等途径的激动剂或抑制剂,调节炎症反应(图 6)。例如,STING激动剂在癌症治疗中显示出潜力,能够增强抗肿瘤免疫反应。
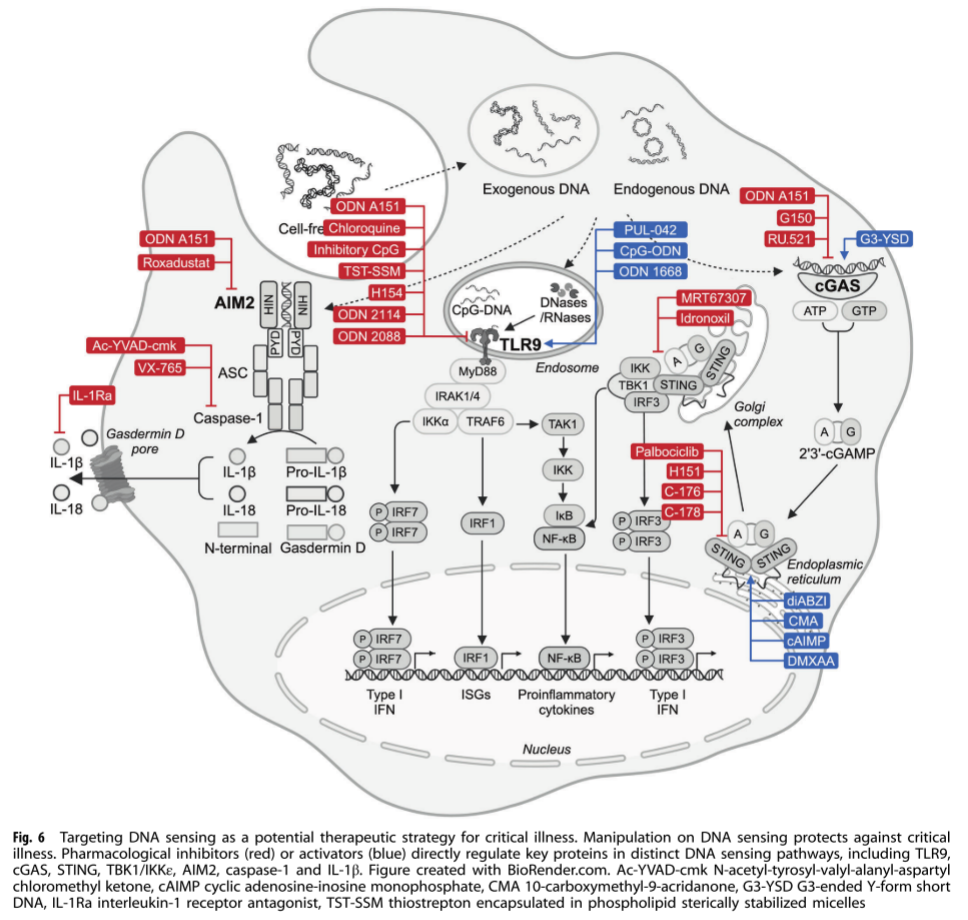
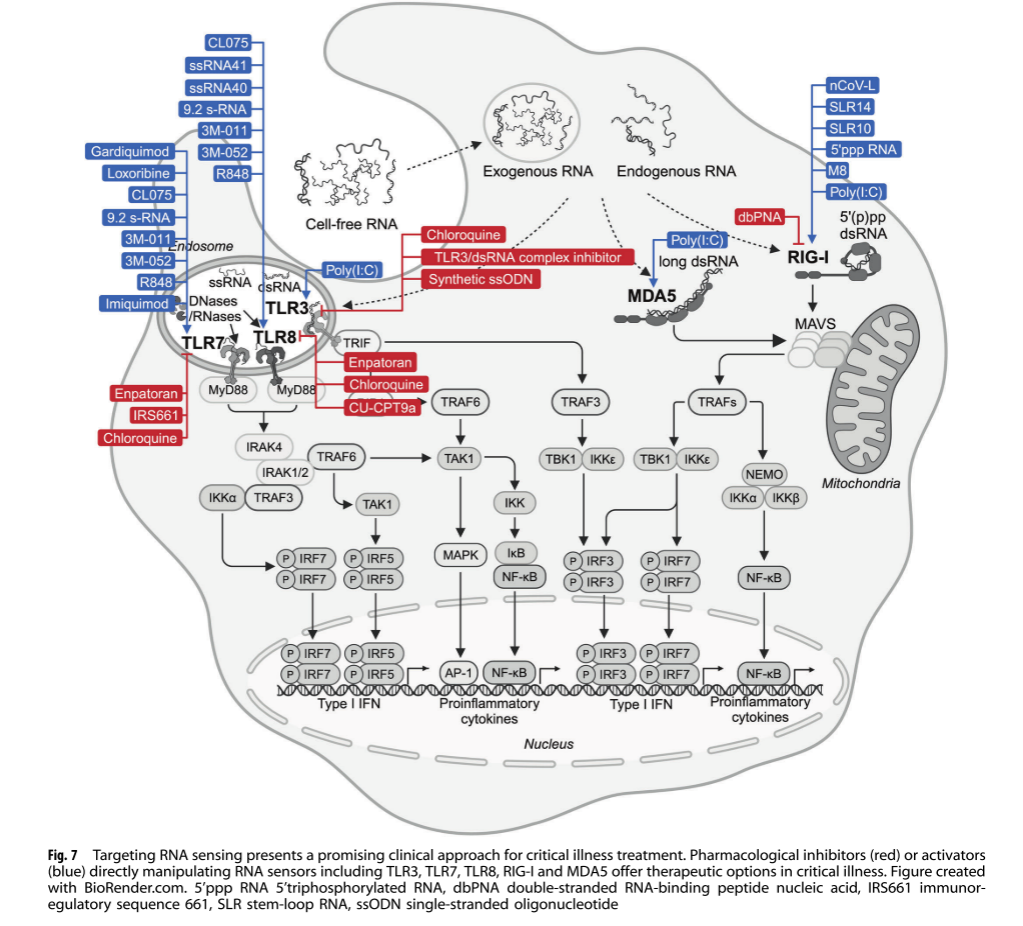
靶向RNA传感器 如TLR3、TLR7/8、RIG-I等途径的激动剂或抑制剂,影响抗病毒免疫和炎症反应(图7)。例如,TLR7激动剂在某些病毒感染的治疗中能够增强免疫反应。
其他 RNA 传感器如 PKR 和 OAS/RNase L 也受到关注。例如,PKR 抑制剂可减轻病毒感染引起的过度炎症反应,而 OAS/RNase L 系统的激活可增强抗病毒免疫反应。此外,合成的短双链 RNA 可通过直接与 RIG-I 结合,触发 IFN 诱导,增强抗病毒免疫反应。这些 RNA 传感器的靶向治疗策略为抗病毒治疗和炎症相关疾病的管理提供了新的思路。
结论
核酸作为DAMPs和PAMPs,在多种危重症中水平升高,通过激活TLR3/7/8/9、cGAS-STING、AIM2、RIG-I和MDA5等信号通路,引发宿主免疫反应和组织损伤,促进疾病进展。深入研究核酸变体及其下游感应途径,有望为危重疾病的治疗带来更多突破,未来需要进一步探索和开发更具针对性和有效性的治疗方案。
述评
本文阐述了细胞质核酸感应作为重症驱动因素的机制和治疗进展。文章全面介绍了核酸传感器的发现历程、种类及其作用机制,详细阐述了DNA和RNA传感器在激活免疫反应中的关键作用。通过对危重疾病如ARDS、脓毒症、创伤和缺血中的核酸感应机制进行深入探讨,揭示了核酸感应与炎症反应之间的密切联系。同时,文章还讨论了核酸感应途径在非危重疾病中的作用,并提出了多种针对核酸传感器的治疗策略,包括核酸清除和靶向DNA/RNA传感器的治疗方法。总体而言,本文为理解核酸感应如何推动危重疾病提供了全面的视角,并为未来的治疗研究提供了潜在的方向。
参考文献:
Chen Z, Behrendt R, Wild L, Schlee M, Bode C. Cytosolic nucleic acid sensing as driver of critical illness: mechanisms and advances in therapy. Signal Transduct Target Ther. 2025;10(1):90. Published 2025 Mar 19.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)