首页 > 医疗资讯/ 正文
NLRP3 炎性体是一种多蛋白复合物,可被感染、细胞内和环境刺激因子等多种刺激激活,在免疫反应中起着关键作用。激活的 NLRP3 炎性体能够寡聚化并与接头蛋白 ASC 相互作用,进而招募并激活 caspase-1,导致细胞炎性坏死(pyroptosis)。然而,NLRP3 如何感知这些不同的刺激以及其激活的具体机制尚不清楚。近年来,蛋白质相分离作为一种新的细胞内调控机制受到关注,它能够通过控制分子浓度或隔离不需要的蛋白质来调节细胞过程。
近日,国际权威期刊Cell Research上在线发表了题为“Signal-induced NLRP3 phase separation initiates inflammasome activation”的最新研究成果,该研究揭示了信号依赖的 NLRP3 相分离是其激活的关键步骤。研究发现,ZDHHC7 介导的 NLRP3 持续棕榈酰化和 NLRP3 FISNA 结构域中的内在无序区域(IDR)在这一过程中起着重要作用,其中 IDR 中的三个保守疏水残基至关重要。多种 NLRP3 激活刺激因子,包括 K⁺外流和 NLRP3 相互作用分子(如咪喹莫德、棕榈酸和心磷脂),均能引起 NLRP3 构象变化,诱导其相分离和激活。此外,两亲性分子(如二醇类化合物)和化疗药物(如多柔比星和紫杉醇)可通过降低 NLRP3 的溶解度直接诱导 NLRP3 相分离,而不依赖 ZDHHC7。这些发现为 NLRP3 相分离提供了最直接的机制基础,并为 NLRP3 相关疾病的治疗提供了新的靶点。

研究首先通过 CRISPR-Cas9 基因组筛选,确定了 ZDHHC7 在 NLRP3 激活中的关键作用。ZDHHC7 是一种棕榈酰基转移酶,能够对 NLRP3 进行棕榈酰化修饰。实验发现,ZDHHC7 缺陷的细胞中,NLRP3 的激活受到显著抑制。进一步的机制研究显示,ZDHHC7 介导的 NLRP3 棕榈酰化降低了 NLRP3 的溶解度,从而促进了其相分离。研究还发现,NLRP3 的 FISNA 结构域中的 IDR 是相分离的关键区域,其中三个保守的疏水残基对于多价弱相互作用至关重要。通过一系列体外和细胞实验,研究人员证实了多种 NLRP3 激活刺激因子均能诱导 NLRP3 的相分离,并且这一过程依赖于 ZDHHC7 介导的棕榈酰化。此外,研究还发现两亲性分子和化疗药物能够通过降低 NLRP3 的溶解度直接诱导其相分离,而不依赖 ZDHHC7。这些发现揭示了 NLRP3 相分离的多种触发机制,包括离子浓度变化、分子相互作用以及溶解度降低等。
综上所述,本研究深入探讨了NLRP3炎性体激活的分子机制,发现信号诱导的 NLRP3 相分离是其激活的关键步骤。ZDHHC7 介导的 NLRP3 棕榈酰化和 IDR 区域的疏水残基在这一过程中发挥重要作用。研究还揭示了多种 NLRP3 激活刺激因子如何通过不同的机制诱导 NLRP3 相分离,为 NLRP3 相关疾病的治疗提供了新的思路和潜在的药物靶点。这些发现不仅增进了我们对 NLRP3 炎性体激活机制的理解,还为开发针对 NLRP3 的特异性抑制剂提供了重要的结构和功能基础。
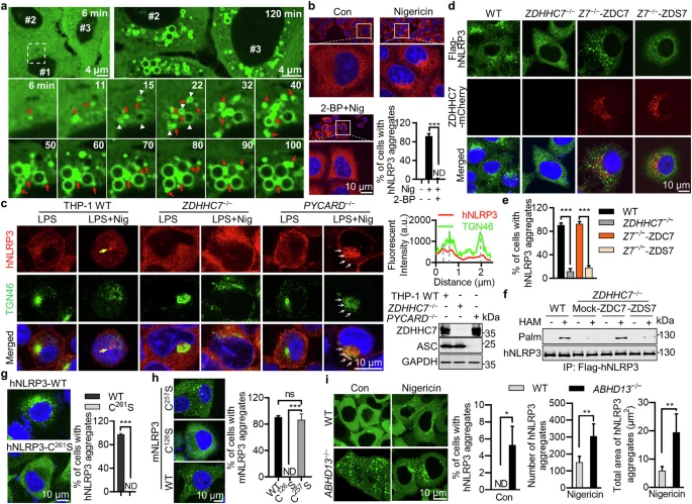
图 ZDHHC7介导的NLRP3棕榈酰化是NLRP3聚集所必需的
原始出处:
Signal-induced NLRP3 phase separation initiates inflammasome activation. Cell Res. 2025 Apr 1. doi: 10.1038/s41422-025-01096-6. Epub ahead of print. PMID: 40164768.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)