首页 > 医疗资讯/ 正文
牙周炎是一种由细菌生物膜引发的慢性进行性炎症性疾病,其特征为牙周组织持续遭到破坏,最终导致牙槽骨丧失和牙齿脱落。牙周炎的发病机制涉及复杂的免疫和炎症反应。当致病微生物侵入牙龈组织时,宿主免疫系统会启动一系列炎症反应来对抗感染。然而,这些反应过度或持续激活可能会导致组织自我损伤,造成牙周组织的不可逆破坏。

作为牙周炎早期炎症反应中的关键免疫细胞,巨噬细胞在牙周组织中发挥着双重作用,既能清除病原体,也可能引发局部炎症损伤,从而对炎症的进展起到显著作用。巨噬细胞可以分化为不同的功能表型,包括促炎性的M1型巨噬细胞和抗炎性的M2型巨噬细胞。在受感染的组织中,巨噬细胞最初会极化为M1表型以帮助清除病原体。随后,巨噬细胞会极化为M2表型,以介导抗炎反应并促进组织修复。在牙周炎的发病过程中,M1型巨噬细胞被激活,产生大量促炎细胞因子,如肿瘤坏死因子-α(TNF-α)和白细胞介素-1β(IL-1β),加剧局部炎症反应,导致组织破坏和骨吸收。相比之下,M2型巨噬细胞分泌抗炎因子,如白细胞介素-1受体拮抗剂(IL-1RA)和白细胞介素-10(IL-10),这些因子可减轻炎症并促进组织修复。研究表明,在受牙周炎影响的牙周组织中,M1/M2型巨噬细胞的比例通常会升高,而降低该比例已被证实可减轻牙周炎的严重程度。因此,调节巨噬细胞极化,减少M1型巨噬细胞的比例并增强M2型巨噬细胞的功能,可能是治疗牙周炎的一种有效策略。
近年来,间充质干细胞(MSCs)因其在组织修复和免疫调节方面的潜力而备受关注,使其广泛应用于各种自身免疫性和炎症性疾病的研究和治疗。间充质干细胞可以通过旁分泌可溶性因子、释放外泌体、代谢重编程和线粒体转移等机制来调节巨噬细胞的极化,这些机制可抑制M1型巨噬细胞的形成并促进M2型极化,从而减轻局部炎症反应并促进组织修复。间充质干细胞的这种免疫调节能力为探索其在牙周炎治疗中的应用提供了新途径。
诱导多能干细胞(iPSCs)是一类通过将体细胞(如成纤维细胞)重编程为多能状态而产生的细胞。诱导多能干细胞具有在体外无限增殖的能力,并能分化为几乎所有人体细胞类型。因此,诱导多能干细胞在再生医学、组织工程和疾病建模方面具有巨大潜力。此外,由于它们来源于体细胞,使用诱导多能干细胞可避免与胚胎组织相关的伦理问题。诱导多能干细胞来源的间充质干细胞(iPSC-MSCs,简称iMSCs)是通过诱导多能干细胞定向分化产生的间充质干细胞的一个亚类。诱导多能干细胞来源的间充质干细胞继承了传统间充质干细胞的多向分化潜能和免疫调节能力,同时克服了传统间充质干细胞在来源可用性和数量上的限制。作为间充质干细胞的一种新兴来源,诱导多能干细胞来源的间充质干细胞已逐渐成为自身免疫性和炎症性疾病研究的一个有前景的焦点。临床试验已报道了静脉注射诱导多能干细胞来源的间充质干细胞治疗激素抵抗性急性移植物抗宿主病的安全性和有效性,两年的随访结果进一步证实了诱导多能干细胞来源的间充质干细胞在治疗应用中的安全性。此外,诱导多能干细胞来源的间充质干细胞相比传统间充质干细胞表现出更强的增殖能力。与直接从骨髓、脂肪组织或其他传统来源获取的间充质干细胞不同,诱导多能干细胞来源的间充质干细胞提供了一种稳定的细胞来源,可以通过非侵入性方法获得,避免了传统间充质干细胞采集所需的创伤性操作。 此外,诱导多能干细胞来源的间充质干细胞受供体年龄或健康状况的影响较小。这些优势使诱导多能干细胞来源的间充质干细胞成为牙周炎等炎症性疾病研究和再生治疗应用中极具潜力的候选细胞。鉴于目前对诱导多能干细胞来源的间充质干细胞对巨噬细胞极化影响的了解有限,本研究调查了诱导多能干细胞来源的间充质干细胞在炎症环境中对巨噬细胞极化的调节作用及其潜在机制。此外,还探索了诱导多能干细胞来源的间充质干细胞对结扎诱导的牙周炎的治疗效果。我们的研究结果表明,诱导多能干细胞来源的间充质干细胞通过NF-κB信号通路抑制M1型巨噬细胞极化,并减轻牙周炎中的牙槽骨丧失。
研究方法:从诱导多能干细胞中生成诱导多能干细胞来源的间充质干细胞,并对其分化潜能进行表征。在炎症条件下(脂多糖(LPS)和干扰素-γ(IFN-γ)刺激),使用THP-1来源的巨噬细胞评估诱导多能干细胞来源的间充质干细胞对巨噬细胞极化的影响。进行共培养实验、细胞因子分析、活性氧(ROS)检测、转录组分析、流式细胞术、逆转录定量聚合酶链反应(RT-qPCR)和蛋白质免疫印迹分析,以阐明潜在机制。在结扎诱导的牙周炎小鼠模型中,使用显微计算机断层扫描(micro-CT)、组织学分析和免疫荧光染色评估诱导多能干细胞来源的间充质干细胞的治疗潜力。
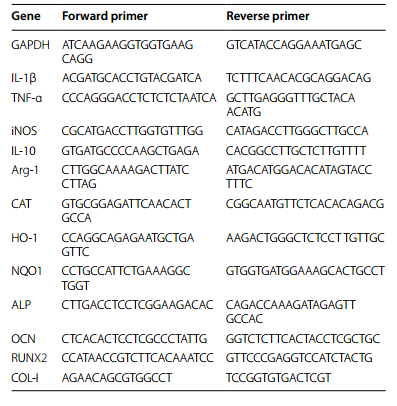
用于qRT-PCR的引物序列
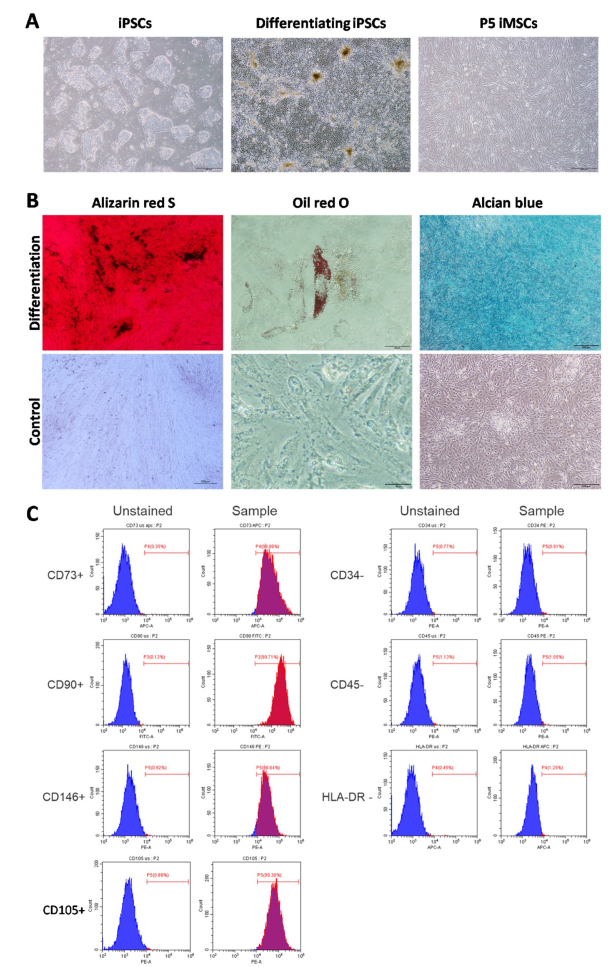
iMSC形态、分化潜能和细胞表面标志物的表征。A左图显示了iPSC的典型集落形态,中图说明了诱导分化14天后iPSC的形态变化,右图描绘了P5代iMSC中间充质干细胞的特征性形态。B茜素红S染色的钙沉积结果,油红O染色用于脂滴,阿辛蓝染色用于软骨基质。C流式细胞术分析显示iMSC上细胞表面标志物的表达
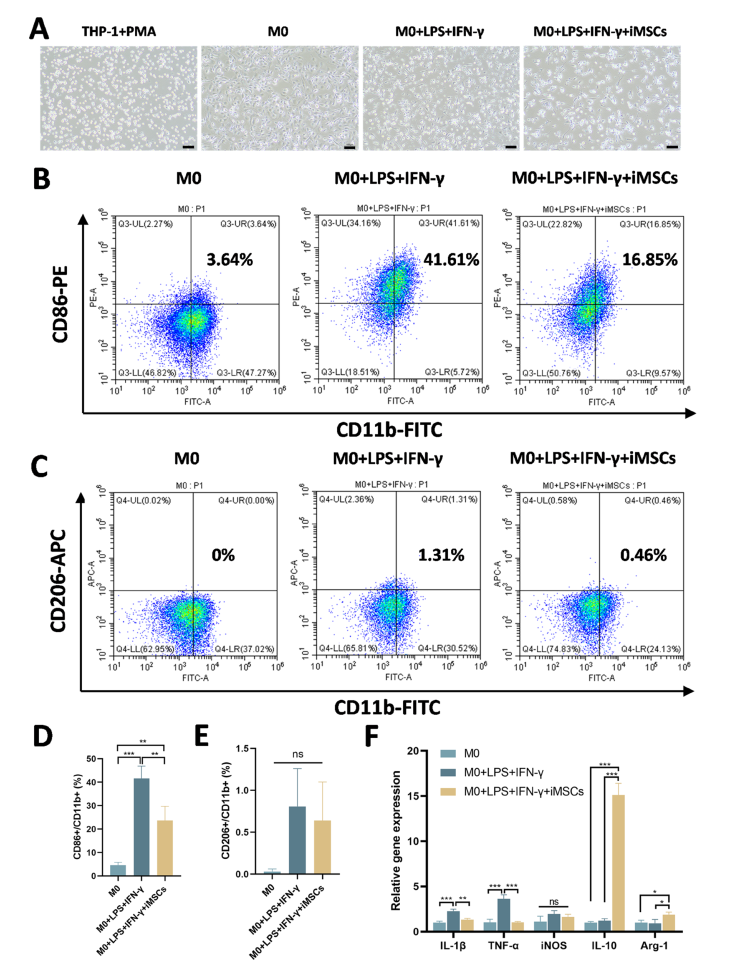
iMSCs对M1巨噬细胞极化的抑制作用A.不同条件下THP-1细胞和巨噬细胞的代表性图像。从左至右:用PMA刺激THP-1细胞48小时,在无PMA培养基中培养M0巨噬细胞48小时,用LPS和IFN-γ诱导M1巨噬细胞,和与iMSC共培养的M1巨噬细胞。100 μm. B M1巨噬细胞极化的流式细胞术。右上象限表示CD 11 B +/CD 86 +M1巨噬细胞的比例。C M2巨噬细胞极化的流式细胞术。右上象限表示CD 11 B +/CD 206+的比例M 2巨噬细胞。D定量流式细胞术分析表明处理组之间CD 86 +/CD 11b+细胞比例的显著差异。E定量流式细胞术分析表明各组之间CD 206 +/CD 11b+细胞比例没有显著差异。F巨噬细胞炎症和抗炎标志物基因的表达,包括IL-1β、TNF-α、iNOS、IL-10和Arg-1。*P<0.05,**P<0.01,* P <0.001; ns,不显著(P>0.05)。
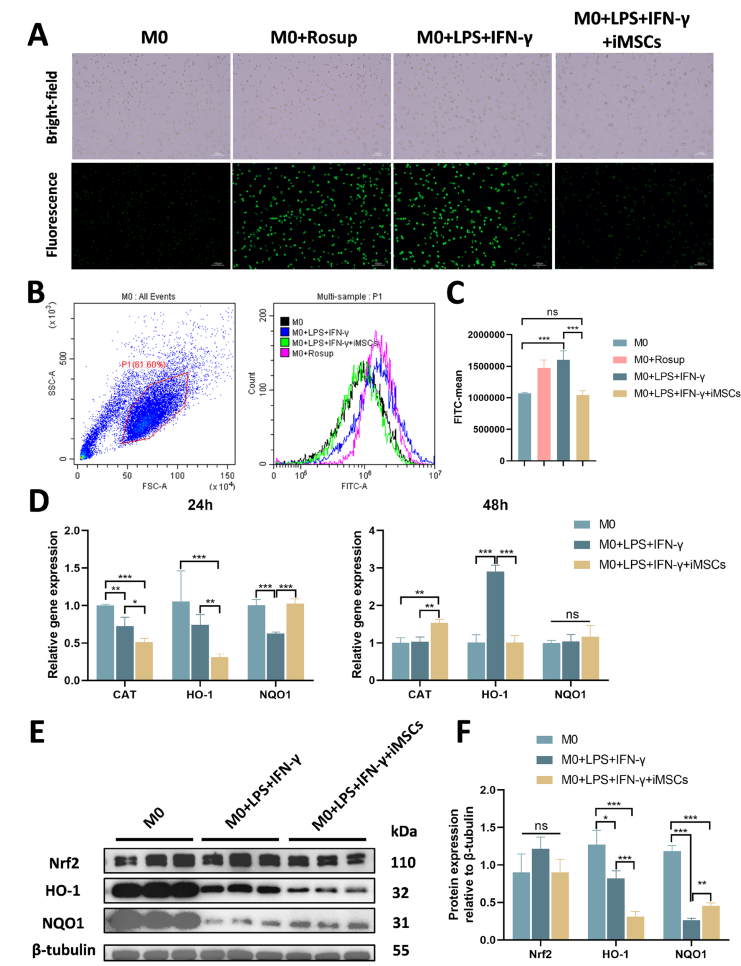
iMSC对LPS+IFN-γ刺激的巨噬细胞中氧化应激水平以及抗氧化基因和蛋白质表达的调节作用。使用二氯荧光素二醋酸酯染色,通过明视野和荧光显微镜成像观察巨噬细胞中的活性氧水平。B对异硫氰酸荧光素通道中的荧光强度进行流式细胞术分析,以评估不同处理组的活性氧水平。左图显示门控策略,右图显示每组的荧光强度分布。C通过测量平均荧光强度来评估ROS水平的定量(FITC-平均值)。D抗氧化基因的相对表达水平在24和48小时通过RT-qPCR测定巨噬细胞中的Nrf 2、HO-1、NQO 1的蛋白质表达水平。和NQO 1通过蛋白质印迹分析(全长印迹在补充图2A-D中呈现)。相对于β-微管蛋白表达进行Nrf 2、HO-1和NQO 1蛋白水平的定量分析。*P<0.05,**P<0.01,*P<0.001; ns,不显著(P>0.05)

转录组测序和通路验证。A维恩图显示了不同处理组巨噬细胞中差异表达基因的重叠。B GO分析的条形图显示了差异表达基因的功能富集。C GO分析的气泡图提供了显著富集的基因类别的详细概述。D通路分析的条形图显示了巨噬细胞中差异表达基因的富集。E Pathway分析的气泡图进一步突出了显著富集的信号通路。F GO树图说明了通过KEGG分析鉴定的关键信号通路的网络关系。G Western印迹分析显示了P-p65、p65、P-AKT和AKT蛋白(补充图2 E-I中给出了全长印迹)H相对于p65的P-p65蛋白表达的定量分析I相对于AKT的P-AKT蛋白表达的定量分析J使用流式细胞术评估M1极化,K流式细胞术统计学分析显示不同处理组间CD 86 +/CD 11b+细胞比例的差异。*P<0.05,**P<0.01,*P<0.001;无显著性差异(P>0.05)。
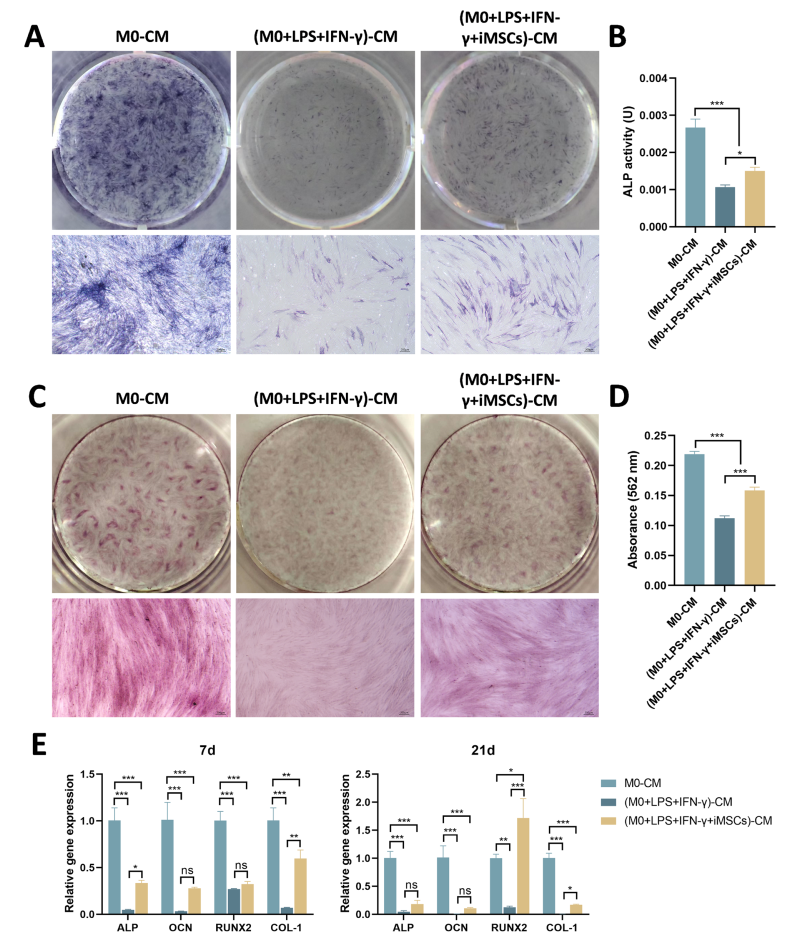
含有来自不同巨噬细胞组的条件培养基(CM)的成骨诱导培养基对PDLSC的成骨分化的影响。A第7天PDLSC的ALP染色。B第7天PDLSC中ALP活性的定量测量。C第21天PDLSC形成的矿化结节的茜素红染色。D半定量。第21天PDLSC中矿化结节形成的定量分析。E成骨相关基因的相对表达水平 *P<0.05,**P <0.01,*P <0.001; ns,不显著(P>0.05)
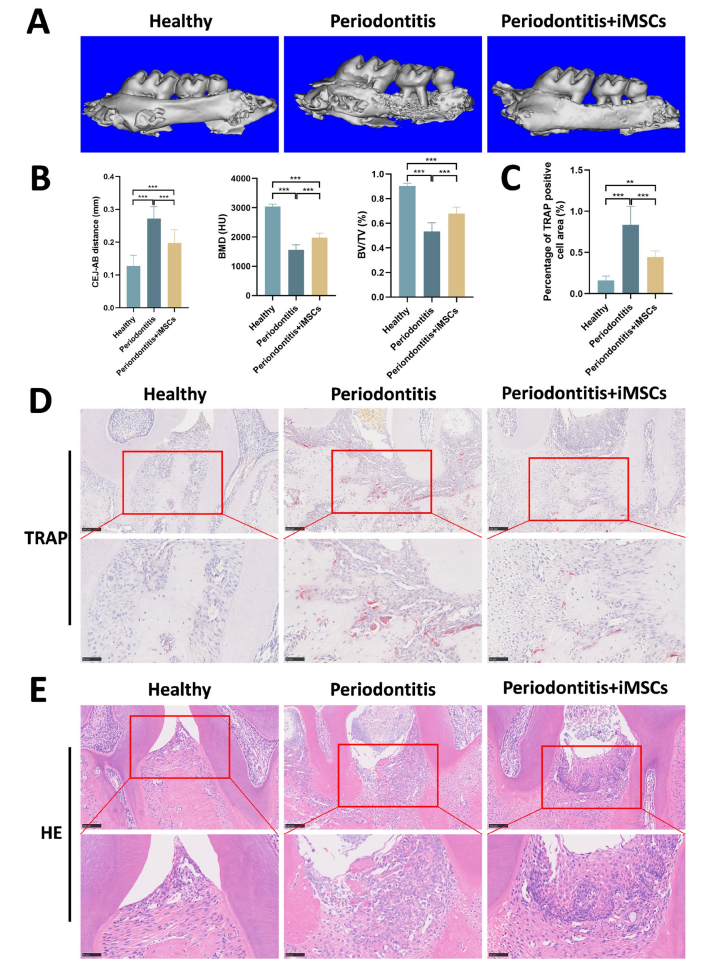
iMSCs对牙周炎小鼠牙槽骨丢失的保护作用。A Micro-CT重建图像显示了健康、牙周炎和iMSCs治疗组小鼠颌骨的形态学变化。B定量Micro-CT分析,包括测量CEJ-AB距离、BMD、和BV/TV. C TRAP的定量结果-D TRAP染色显示小鼠牙槽骨周围的破骨细胞活性。比例尺:100微米(上图)和50 μm E HE染色显示健康组、牙周炎组和iMSC治疗组的牙周组织的组织学变化。100 μm(上图)和50 μm(下图),*P<0.05,**P <0.01,*P<0.001; ns,不显著(P>0.05)

牙周组织中巨噬细胞标志物和NF-κB信号通路的免疫荧光染色。A代表性免疫荧光图像显示了健康、牙周炎和牙周炎+iMSCs组牙周组织中CD 68、iNOS和CD 206的表达。B定量分析了牙周组织中CD 68+、iNOS+、C.三组牙周组织中p65的代表性免疫荧光图像。D. p65细胞核数目的定量分析。E来自不同实验组的牙周组织中IL-17的代表性免疫组织化学(IHC)图像。100微米(上图)和50 μm F每个视野的IL-17阳性细胞的百分比面积的定量分析 *P<0.05,**P<0.01,* P <0.001; ns,不显著(P>0.05)
研究结果:诱导多能干细胞来源的间充质干细胞通过抑制NF-κB信号通路抑制M1型巨噬细胞极化。此外,诱导多能干细胞来源的间充质干细胞减少促炎细胞因子(IL-1β、IL-17)和活性氧(ROS)的产生,同时增强抗炎细胞因子(IL-10)和生长因子(血管内皮生长因子(VEGF))的分泌,从而改善炎症微环境。在炎症条件下,诱导多能干细胞来源的间充质干细胞保留了牙周膜干细胞(PDLSCs)的成骨潜能,并减轻了牙周炎小鼠的牙槽骨丧失。在体内,诱导多能干细胞来源的间充质干细胞减少了牙周组织中M1型巨噬细胞的数量,并抑制了NF-κB的激活,证实了其抗炎和免疫调节作用。
研究结论:诱导多能干细胞来源的间充质干细胞通过调节巨噬细胞极化、减少氧化应激和减轻与牙周炎相关的牙槽骨丧失,在牙周炎治疗中显示出显著的治疗潜力。这些发现为诱导多能干细胞来源的间充质干细胞的作用机制及其作为牙周疾病细胞治疗的应用提供了新的见解。
原始出处:
Liang, Chen; Yuanqing, Liu; Chenhao, Yu;Induced pluripotent stem cell-derived mesenchymal stem cells (iMSCs) inhibit M1 macrophage polarization and reduce alveolar bone loss associated with periodontitis.Stem Cell Res Ther 2025 May 2;16(1):223
猜你喜欢
- 科学认识安眠药:利弊权衡与合理使用指南
- 淋巴癌的治疗方式有哪些
- Hypertension:高可溶性纤维饮食可减轻缺氧引起的血管重塑和缺氧性肺动脉高压的发展
- World J Urol:前列腺癌放疗与炎症性衰老之间的关联如何?
- 夏季减肥的最佳方法是什么 夏季减肥推荐3个清肠小偏方
- 3款助眠食物 奥运宵夜多吃不怕胖
- 2022年1月28日简报:杭州两天累计确诊14例本土奥密克戎病例,可能已有三代病例传播;Moderna、辉瑞宣布启动奥密克戎特异性COVID疫苗试验
- 秦皇岛市工人医院超声波妇科治疗仪采购成交公告
- 新研究显示:运动干预对改善认知、记忆及执行功能的有效性
- 你知道频繁遗精的危害吗? 男性频繁遗精注意四大危害
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)