首页 > 医疗资讯/ 正文
PVRL
原发性玻璃体视网膜淋巴瘤(PVRL)是原发性中枢神经系统淋巴瘤(PCNSL)的一种罕见亚型,局限于眼内组织,其中约95%为弥漫性大B细胞淋巴瘤(DLBCL),可导致永久性视力丧失和中枢神经系统(CNS)受累,预后较差。PVRL常伪装成葡萄膜炎,早期诊断较为困难,对局部皮质类固醇的部分反应进一步导致诊断复杂化。诊断的金标准为细胞学分析;然而灵敏度较低,细胞因子分析和基因检测可作为补充诊断工具。目前尚无关于PVRL治疗方案的普遍共识,考虑到PVRL与PCNSL之间的相关性以及血视网膜屏障的存在,治疗中应同时涉及中枢和局部疗法。系统性大剂量静脉注射甲氨蝶呤(MTX)联合玻璃体腔内治疗可能有助于管理双眼眼内病变,但延缓CNS复发的疗效仍存在争议。对于年龄小于60岁的复发或难治性(R/R)PVRL患者,可考虑进行强化巩固化疗序贯自体干细胞移植。新型靶向治疗药物如伊布替尼和来那度胺已在R/R病例中显示出疗效。亟需开展大规模多中心前瞻性研究以确定最佳治疗策略。
北京同仁医院王亮教授团队(第一作者为首都医科大学王思语,第二作者为暨南大学爱尔眼科周索旺,第三作者为北京同仁医院血液内科高晶)近日于《Blood Science》发表综述,总结了PVRL诊断、治疗和预后的传统和新兴方法,以及每种方法的优势和局限性。现整理全文供参考。

流行病学
PVRL是极为罕见的原发性眼内肿瘤之一,其发病率正逐渐上升。在美国,PVRL的整体年龄校正发病率为每100万人中0.23例,并且在过去的三十年间呈现出上升趋势。这种上升趋势可能与免疫缺陷和免疫抑制患者数量的增加、预期寿命的延长以及诊断方法的进步有关。
老年人患PVRL的风险较高。确诊时的中位年龄超过63岁,且有超过20%的患者年龄在80岁以上。一项为期20年的回顾性分析显示,年龄≥60岁的个体患PVRL的发病率比<60岁的个体高出近18倍。人类免疫缺陷病毒(HIV)和Epstein-Barr病毒(EBV)感染是重要的危险因素,其发病率与CD4计数呈负相关。然而,在高效抗逆转录病毒疗法盛行的当下,获得性免疫缺陷综合征(AIDS)相关免疫缺陷的影响可能没那么重要。目前还没有其他已知的PVRL危险因素。
临床特征
PVRL的临床表现缺乏特异性,主要症状包括飞蚊症和无痛性视力下降,与难治性葡萄膜炎的典型表现相似。但PVRL患者年龄更大,就诊时视力更低,且女性患者比例低于葡萄膜炎患者,或有助于区分PVRL和葡萄膜炎。PVRL主要表现为双眼眼内受累。一项回顾性研究显示,50%到80%的病例存在双眼受累,但双眼病变程度可能不对称。
PVRL可能伴有神经系统症状,这些症状可能先于脑部病变的出现。最常见的神经系统症状包括行为和/或认知功能改变(25%到30%的患者)、偏瘫(10%到15%)、头痛(10%到15%)、失语(10%到15%)、癫痫(5%)以及共济失调(4%),这些症状通常会持续数周到数月。
VRL的病理特征为肿瘤细胞侵入眼内组织,如玻璃体、视网膜、前房和视神经,常伴有眼前节炎症。
玻璃体混浊可表现为“北极光”模式,大量细胞排列在玻璃体纤维上。玻璃体混浊还可表现为具有细腻纹理的幕状模式,呈放射状延伸。这些病变可通过超广角眼底成像观察到。此外,眼科超声检查显示红细胞物质与玻璃体混浊有关(图1)。
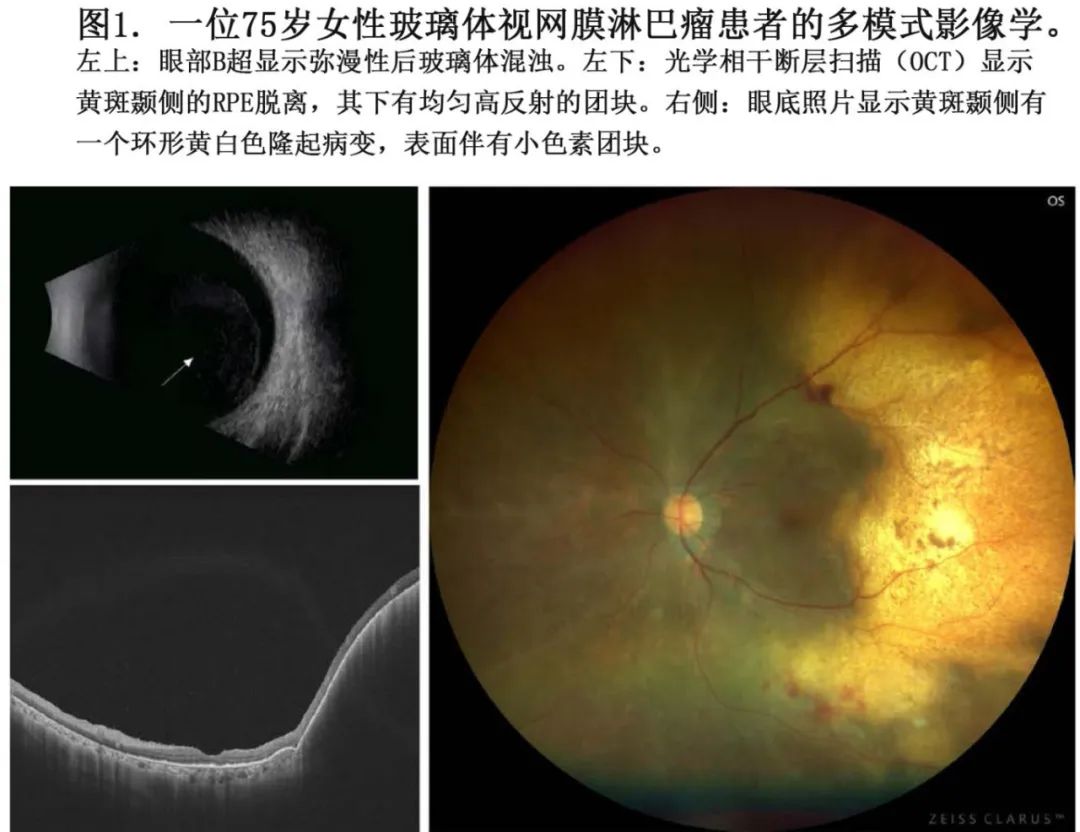
使用超广角眼底成像,视网膜下黄白色病变是PVRL的重要临床特征。这种病变在光学相干断层扫描(OCT)上表现为高度隆起的视网膜色素上皮(RPE)层和“垂直高反射柱”(VHRL),可能代表肿瘤的微扩散。眼底自发荧光(FAF)显示高自发荧光,与OCT图像上的视网膜下病变区域和结节状高反射点相对应。
视网膜浸润是PVRL的重要临床特征。彩色眼底照片显示白色视网膜浸润伴有玻璃体混浊、视神经水肿、血管周围鞘膜、RPE病变和浆液性视网膜脱离。由于淋巴瘤性RPE浸润改变了RPE的代谢,FAF图像呈现高荧光。相比之下,RPE上方的淋巴瘤浸润区域在FAF中似乎呈现低自发荧光,可能是因为肿瘤阻断了正常的RPE荧光。在视网膜病变自发消退后,RPE萎缩区域也可观察到低自发荧光。OCT显示视网膜下高反射病变,这些病变在接受治疗后可能会消退或进展为视网膜下纤维化。
诊断
对于临床上怀疑PVRL的患者,应进行非侵入性的眼部和CNS检查。磁共振成像(MRI)可能是CNS的首选检查方法,同时进行腰椎穿刺,以获取脑脊液(CSF)样本,在其中发现淋巴瘤细胞可确诊PCNSL。在PCNSL诊断明确且眼部影像学检查呈阳性后,进行眼内活检的意义不大。对于脑脊液细胞学检查阴性且影像学怀疑有颅内病变的患者,可能需要进行颅内活检。如果未观察到CNS受累,则需采集眼内样本进行检测(图2)。
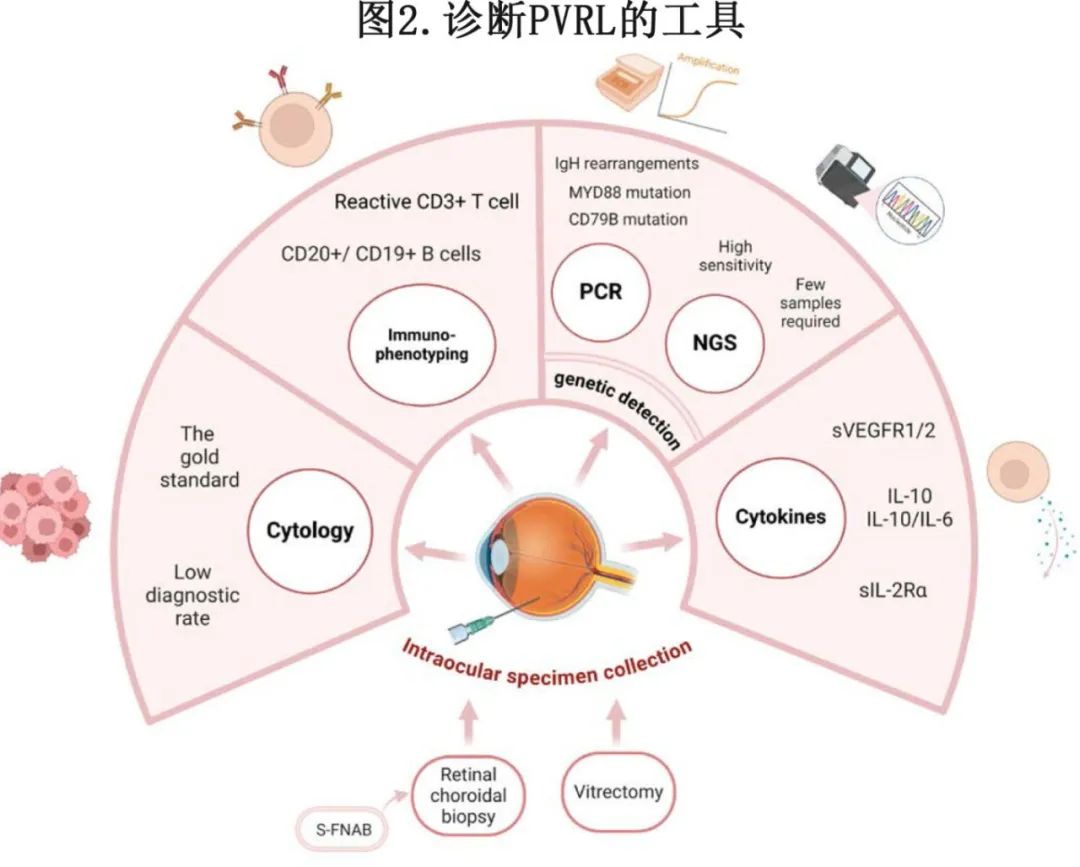
眼内标本采集
根据肿瘤细胞浸润的程度,眼内活检最常见的部位为玻璃体,而玻璃体切割术是首选,因其比视网膜或葡萄膜活检更具微创性。通过干性玻璃体切割术获取未稀释的样本用于细胞学和细胞因子分析,随后通过玻璃体切割术去除剩余的玻璃体,以收集稀释的样本并提高视力。稀释后的样本用于免疫球蛋白基因重排、基因突变分析、细菌或真菌培养和染色,以及对各种微生物进行PCR检测。鉴于糖皮质激素对淋巴细胞的抑制和溶解作用,患者应在玻璃体活检前几周停止使用糖皮质激素。
如果在玻璃体中未发现或仅发现少量肿瘤细胞,而视网膜病变提示PVRL,则建议进行视网膜脉络膜活检。最近的一项研究表明,可以使用41号硅胶细针穿刺活检(S-FNAB)获取视网膜脉络膜标本。该针非常细(0.0711毫米),且足够灵活,能够穿透视网膜和视网膜下空间以抽吸病变处的淋巴瘤细胞。与其他视网膜脉络膜活检方法相比,S-FNAB不会显著增加视网膜厚度,并且可对黄斑区进行采样。
细胞学检查
多项研究表明,细胞学检查是诊断VRL的金标准。细胞学检查方法有两种:常规涂片细胞学检查和细胞块制备,前者阳性率更高。鉴于基于形态学分析和免疫细胞化学的高特异性,细胞块方法可用于VRL和葡萄膜炎的鉴别诊断。淋巴瘤细胞是具有不规则核、多个明显核仁和稀疏细胞质的不典型大淋巴细胞,通常伴有小反应性T淋巴细胞浸润。尽管玻璃体细胞学是诊断的金标准,但阴性结果并不能明确排除PVRL,因其诊断率较低。诊断率低的原因可能包括:眼病理学家经验不足、样本量有限、样本中细胞数量少、玻璃体内的淋巴瘤细胞易碎以及与其他细胞结构的污染。
免疫组化或流式细胞术
在细胞学检查中也可能出现处于反应状态的不典型单核细胞,因此需要通过免疫组化进一步检查B/T细胞表面标志物。由于大多数PVRL来源于B淋巴细胞,免疫组化可以检测CD20+和CD19+B细胞以及反应性CD3+T细胞。
流式细胞术是另一种可靠的细胞表型检测方法,可检测大量细胞表面标志物,有助于区分PVRL和葡萄膜炎。此外,Igκ与λ的比例失衡(<0.1或>10)是B细胞肿瘤细胞克隆性的标志。
PCR检测基因突变
免疫球蛋白重链(IgH)重排 在PVRL患者中可检测到免疫球蛋白重链(IgH)基因重排,部分患者还可以检测到T细胞抗原受体(TCR)基因重排,有助于识别淋巴细胞的单克隆性和肿瘤性特征。关于该检测的最大规模研究于2011年由美国国立卫生研究院(NIH)发表,共检测了200例伪装综合征(114例确诊为PVRL,86例确诊为葡萄膜炎)患者的样本,结果显示所有患者中均存在IgH(109)或TCR(5)基因重排(敏感性100%;特异性99%)。在86例葡萄膜炎患者中,有1例IgH基因重排呈阳性。
染色体重排也可能转移到特定基因位置。t(14:18)易位将编码抗凋亡分子的Bcl-2基因转移到14号染色体上,导致B细胞中Bcl-2的过表达,从而延长其存活时间。在NIH进行的另一项研究中,72例经细胞学证实的玻璃体视网膜淋巴瘤患者中有41例细胞学上发现t(14:18)重排。
MYD88和CD79B突变 髓样分化初级反应基因88(MYD88)编码一种在先天免疫系统中被Toll样受体普遍使用的适配蛋白,在DLBCL中经常发生突变,特别是在免疫豁免部位,如CNS;约69%到88%的患者存在MYD88突变。如果在玻璃体液中的CD20+细胞中存在MYD88等位基因突变,就可以确诊PVRL。MYD88突变分析通常用作PVRL早期诊断的辅助工具。在疾病早期,玻璃体样本中的细胞数量不足,使得细胞学评估较为困难。此外,许多患者由于误诊为玻璃体炎而接受类固醇治疗,可能导致肿瘤细胞溶解。MYD88 PCR只需要4.93 ng/mL(或接近20000个细胞)就可以得出结果,并且不依赖于细胞的存在。与IgH PCR相比,检测MYD88突变所需的细胞数量更少,假阴性率更低,结果也更客观。
编码B细胞受体(BCR)的Igβ蛋白的CD79B基因突变是PVRL患者的另一个支持性诊断指标。Yonese等人发现PVRL中CD79B突变的阳性率为35%,远低于MYD88突变。因此,CD79B突变可能与PVRL的CNS进展有关。在上述研究中,所有携带CD79B突变的患者最终都发展为CNS疾病,尽管他们接受了系统性甲氨蝶呤(MTX)治疗。
新兴分子诊断工具:二代测序(NGS)
NGS是新兴的分子诊断工具,可指导PVRL精准分子靶向治疗的开发。 一项对23例VRL患者的玻璃体液进行NGS分析的研究显示,存在MYD88(91%)、CDKN2A(36%)、PIM1(32%)、IGLL5(27%)和ETV6(23%)突变,其中MYD88突变频率最高;MYD88、CDKN2A、PIM1、IGLL5和ETV6突变可视为VRL家族中的重要突变。在对PCNSL和VRL患者的脑部及玻璃体样本进行比较的NGS分析中,两种样本均发现存在MYD88 L265P突变和克隆以及CDKN2A的完全缺失;这些相似的基因突变表明两种肿瘤具有共同起源。
在之前提出的诊断标准中,玻璃体NGS检测的敏感性最高(0.85),而白细胞介素(IL)-10/IL-6比值的敏感性次之(0.83)。在Cani等人的研究中,NGS成功检测到细胞学反复显示假阴性的病例中的突变,表明NGS或可通过早期诊断和治疗来改善预后。尽管样本具有高粘度、细胞保存不良和细胞稀少等特点,可能导致PCR结果出现假阴性或假阳性,但NGS仍可提供准确结果。此外,仅需少量(低至500微升)的玻璃体样本即可进行NGS分析,从而为细胞学和其他诊断目的保留足够的样本。
细胞因子
IL-10及IL-10/IL-6比值 IL-10由恶性B淋巴细胞表达,而IL-6主要由炎症细胞表达。PVRL患者的房水或玻璃体样本中IL-10水平更高,远高于葡萄膜炎患者。IL-10/IL-6比值大于1.0高度提示淋巴瘤,而小于1.0则指示葡萄膜炎。Cassoux等人为眼内液中IL-10设定了具体阈值:房水为50 pg/mL(敏感性89%、特异性93%),玻璃体液为400 pg/mL(敏感性80%、特异性99%)。因此,IL-10浓度及IL-10/IL-6比值可用于协助诊断PVRL,并将其与葡萄膜炎区分开来。
在Lee等人的研究中,检测到3例存在广泛且严重的视网膜色素上皮下浸润的PVRL患者IL-6水平显著升高,可能与血视网膜屏障的破坏或反应性细胞的募集和分泌有关。由于各种原因,IL-10浓度或IL-10/IL-6比值的精确阈值可能因实验室而异。考虑到这些局限性,仅凭细胞因子分析无法诊断PVRL。
可溶性血管内皮生长因子受体(sVEGFR)1和VEGFR 血管内皮生长因子(VEGF)-A可通过VEGFR1和VEGFR2通路促进DLBCL细胞的有丝分裂。Takeda等人显示,系统性转移性视网膜淋巴瘤(SMRL)患者的sVEGFR1和sVEGFR2水平显著高于PVRL/PCNSL患者。因此,检测玻璃体液中sVEGFR1和/或sVEGFR2水平有助于PVRL/PCNSL与SMRL的鉴别诊断。
可溶性白细胞介素-2受体α(sIL-2Rα) sIL-2Rα通过包括具有抗肿瘤活性的CD8 T细胞在内的多条通路抑制T细胞生长。VRL患者血清中sIL-2Rα水平显著高于葡萄膜炎患者及对照组(P<0.05)。此外,存在视网膜下病变和玻璃体混浊的VRL患者sIL-2Rα水平高于主要表现为玻璃体混浊的患者(P=0.0027)。这些结果表明,sIL-2Rα可能是VRL与葡萄膜炎的诊断标志物,并有助于预测视网膜和/或视网膜下恶性淋巴瘤细胞浸润,以便早期发现和治疗及维持视力。
治疗
治疗目标是根除眼内疾病和预防 CNS 淋巴瘤,目前尚未确定 PVRL 的标准治疗方法。单独使用局部治疗(如眼部照射或 MTX 或利妥昔单抗玻璃体腔化疗)或联合全身化疗仍存在争议。对于复发或难治性 (R/R) 病例,推荐自体干细胞移植 (ASCT) 同时进行靶向治疗(如来那度胺或伊布替尼)(图3)。
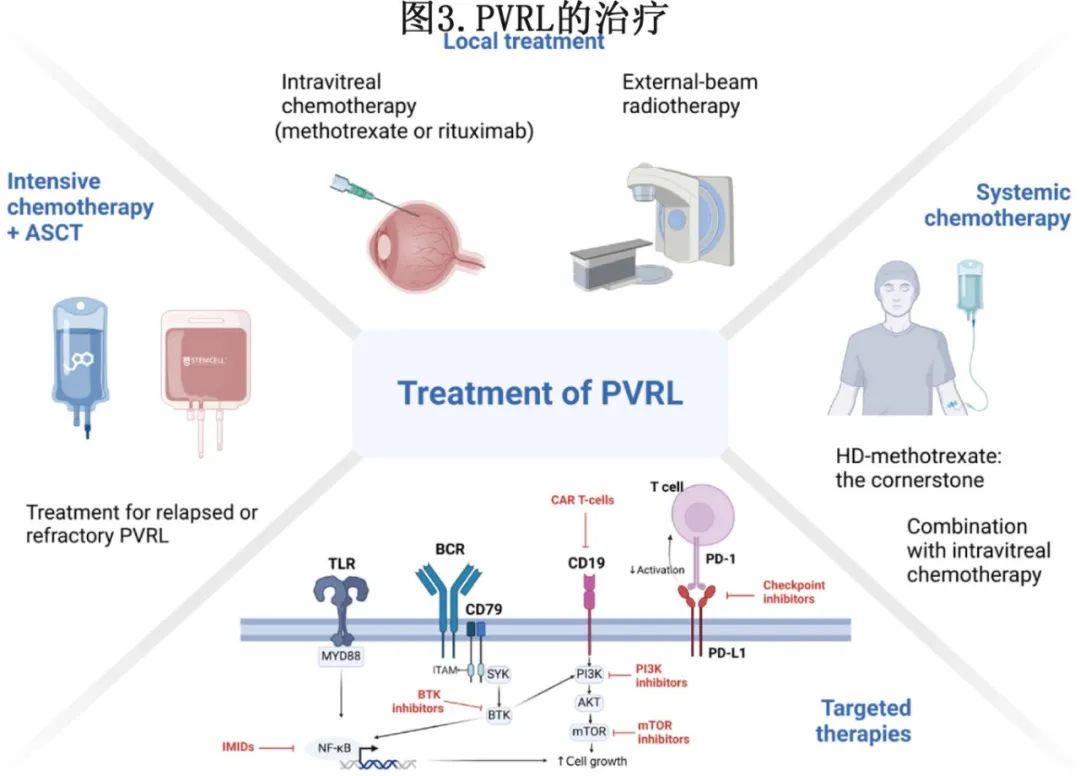
局部眼部治疗
局部眼部治疗包括玻璃体腔内MTX注射、玻璃体腔内利妥昔单抗(IVR)注射及外部束放疗(EBRT)。玻璃体腔内MTX注射剂量为0.4 mg/0.1 mL。在诱导期间,注射周期为每周两次,持续4周。后续注射可以根据临床反应和房水IL-10水平预先确定(1年内总共25次玻璃体腔内注射),或根据临床反应进行调整。一项针对81例VRL患者(134只患眼)的大规模回顾性分析强调了玻璃体腔内MTX治疗的疗效和安全性,平均注射次数为19次;然而平均在5次注射后即可达到完全缓解(CR),CR的标准为通过裂隙灯观察到玻璃体腔内淋巴瘤细胞消失。玻璃体腔内注射MTX可以达到高浓度的眼内MTX,从而确保疗效;但也可能导致眼部副作用,角膜病变是最常见的副作用,在前5次注射期间所有患者均有出现。幸运的是,通过多种方法可以减轻这种副作用,包括减少MTX剂量和延长注射间隔。因此,玻璃体腔内注射MTX不仅对VRL治疗有效,而且安全。
最近,IVR作为一种眼内局部替代疗法开始出现。利妥昔单抗是一种抗CD20单克隆抗体,通过靶向B细胞表面抗原来诱导肿瘤细胞凋亡。IVR的剂量为1mg/0.1mL。IVR的注射周期差异很大,对于PVRL患者的大队列尚未建立明确的治疗方案。Rishi等人评估了IVR单药治疗VRL的疗效和并发症。所有7例VRL患者的12只患眼中观察到完全消退,主要并发症为前葡萄膜炎(50%)和眼内压升高(25%)。然而在Larkin等人的研究中,48只接受IVR治疗的患眼中只有31只(64.6%)在中位3次注射后达到CR,且有7只患眼出现疾病复发。由于大多数关于IVR治疗的研究是病例报告或小病例分析,因此无法证明其疗效。总体而言,IVR注射显示出与MTX相当的疗效,且具有较低的局部毒性优势,例如与MTX相比角膜病变的发生率降低。
EBRT通常使用总共35到40 Gy的剂量,其中36 Gy的中位疗效最为令人满意。EBRT在双眼PVRL病变中特别有效,但无法预防CNS复发。白内障和放射性视网膜病变是EBRT的常见副作用。视网膜病变的发生率随着剂量的增加而增加。白内障可能会降低视网膜检查的敏感性,从而导致轻度视网膜病变的漏诊。
系统化疗
大剂量甲氨蝶呤(HD-MTX)是新诊断PCNSL全身化疗的基石。基于血脑屏障与血视网膜屏障(BRB)在解剖和功能上的相似性,对于PVRL患者,采用HD-MTX全身化疗是一种经验性治疗方法。在Kaburaki等人开展的一项前瞻性研究中,11例无CNS受累的PVRL患者接受全身静脉注射利妥昔单抗、甲氨蝶呤、丙卡巴肼和长春新碱(R-MPV)治疗,随后接受减量全脑放疗(rdWBRT)和静脉注射大剂量阿糖胞苷。4年CNS进展的累积发生率仅为10.0%,4年PFS为72.7%。该研究表明,预防性减量全脑放疗联合全身化疗可以有效抑制CNS转移,并改善预后。Hashida等人开展的一项回顾性研究表明,预防性全身化疗,特别是HD-MTX,并未降低大多数PVRL患者的CNS受累率,但显著延长了脑部受累的持续时间。因此,全身预防性化疗可能通过延长PFS来改善预后。
尽管全身给予HD-MTX可在玻璃体和房水中达到细胞毒性水平,但玻璃体液中该药物的低浓度可能导致部分患者的PVRL持续存在或复发。眼内化疗也未能防止复发;而全身化疗联合玻璃体腔内化疗或许可以弥补这些不足。迄今为止只有一项前瞻性研究评估了玻璃体腔内甲氨蝶呤联合全身化疗用于预防CNS进展,所有PVRL患者在接受玻璃体腔内甲氨蝶呤注射后均达到CR。在接受玻璃体腔内甲氨蝶呤联合全身大剂量甲氨蝶呤治疗的患者中,2年无CNS淋巴瘤生存率(CLFS)为58.3%,而单独接受玻璃体腔内甲氨蝶呤治疗的患者为37.5%。尽管接受联合化疗的患者CLFS更长,但由于背景因素(如中位年龄等)存在差异,直接比较并非合理。矛盾的是,一项对70例接受眼内和全身化疗的PVRL患者进行的回顾性队列分析得出结论,对于PVRL的主要治疗方法,CNS受累和死亡的平均时间并无差异。此外,多中心回顾性研究表明,全身化疗对CNS复发并无疗效。然而,仍需开展大规模前瞻性多中心研究来证实玻璃体腔内化疗联合全身化疗的疗效。
R/R PVRL的治疗
关于大剂量化疗(IC)和自体干细胞移植(ASCT)治疗PVRL的数据有限,大多数试验仅包括PCNSL,或者同时包括PCNSL和PVRL。在Soussain等人开展的一项前瞻性、多中心试验中,27例R/RPCNSL或VRL患者接受大剂量化疗+造血干细胞挽救(HCR)治疗。这种大剂量化疗方案结合了塞替派、白消安和环磷酰胺,已被证明对预后不良的系统性淋巴瘤患者有效,包括有CNS淋巴瘤受累的患者。结果显示,除了一例患者外,所有患者均达到CR。Soussain等人进行的另一项研究也得出了类似的结果,在20例接受IC+HCR治疗的R/R PCNSL或VRL患者中,16例CR,2例保持部分缓解,1例疾病稳定,1例疾病进展。这两项研究均表明,IC+HCR对R/R VRL有效。然而,Mainguy等人进行的一项LOC网络研究表明,尽管IC-ASCT后的生存结果较为理想,但在初次诊断为PVRL和PCNSL的患者中,IC-ASCT后复发率(特别是CNS复发率)仍然很高。应在IC-ASCT后定期进行脑部检查。一项纳入79例R/R PCNSL或VRL患者的回顾性研究发现,年龄是总生存率(OS)的独立影响因素。对于60岁以下的患者,联合治疗是可行的,但对于60岁以上的身体状况良好的患者,通过降低白消安剂量也可以耐受。
新型靶向治疗
来那度胺联合利妥昔单抗 来那度胺是一种具有强效抗增殖和免疫调节作用的药物,已被证明与利妥昔单抗联合治疗复发性CNS淋巴瘤有效。Ghesquieres等人开展的一项前瞻性Ⅱ期研究评估了来那度胺联合静脉注射利妥昔单抗(R2)用于治疗R/R PCNSL或PVRL患者的疗效。该研究纳入9例PVRL患者和10例继发性VRL患者,35%(9例)的患者达到CR。因此,R2方案可被视为不适合接受更强化挽救治疗的R/R PVRL患者的替代疗法。在Zhang等人开展的另一项前瞻性研究中,11例PVRL患者接受R2方案联合玻璃体腔内甲氨蝶呤治疗,随后进行来那度胺维持治疗。在首次评估时,11例患者中有10例达到CR。但8例患者出现复发,其中5例为CNS复发,3例为眼内复发。该研究表明,在玻璃体腔内甲氨蝶呤注射中加入R2方案是治疗PVRL的安全有效选择。应监测脑脊液中IL-10浓度以早期发现复发。
布鲁顿酪氨酸激酶抑制剂(BTKi) 在大多数VRL患者的玻璃体样本中检测到CD79B和MYD88的突变,这些突变增强B细胞受体(BCR)信号传导,促进B细胞的激活和存活。布鲁顿酪氨酸激酶(BTK)是BCR通路中的关键酶,可促进核因子κB(NF-κB)的核转位,从而导致B细胞增殖。因此,BTKi可以下调BCR通路,抑制恶性B细胞的增殖。BTKi已作为针对恶性B细胞淋巴瘤的靶向药物在临床上使用,但对PVRL患者的疗效尚未确定。为了进一步评估伊布替尼单药治疗VRL患者的疗效,Guan等人设计了一项单中心、前瞻性Ⅱ期研究。在纳入研究的10例VRL患者中,9例(90%)在接受1个月治疗后实现疾病控制(DC),7例(70%)出现症状完全缓解(CR),2例(20%)出现部分缓解;BTKi治疗VRL是可行的。Gao等人比较了BTKi单药治疗与联合治疗的效果。BTKi单药治疗组与联合治疗组的客观缓解率(ORR)相似(96% vs 89%),但BTKi单药治疗组的CR率低于联合治疗组(79% vs 92%);此外联合治疗组3/4级不良反应的发生率更高(45%)。因此,将BTKi与其他多种治疗方案联合使用可能代表未来的发展趋势。然而,随着这些药物的广泛使用,对BTKi的耐药性也已经出现。具有MYD88L265P和CD79A/B突变的ABC-DLBCL对伊布替尼有反应(缓解率为80%);然而,具有MYD88L265P突变但无CD79A/B突变的肿瘤对伊布替尼耐药,表明MYD88L265P突变可能与伊布替尼耐药有关。
T细胞或NK/T细胞PVRL
大多数PVRL属于DLBCL,而T细胞或NK/T细胞来源的PVRL较为罕见。当患者出现葡萄膜炎且对糖皮质激素治疗无反应时,在排除B细胞PVRL的可能性后,应考虑T细胞或NK/T细胞淋巴瘤的可能性。
细胞学检查仍然是T细胞PVRL诊断的金标准,苏木精-伊红(HE)染色通常显示具有不典型核的中至大型淋巴细胞。免疫组化检测显示淋巴细胞表达CD3,但不表达CD20。基因检测显示T细胞受体(TCR)基因重排。NK细胞PVRL的细胞学检查显示存在具有扭曲核的中等大小的肿瘤细胞。免疫组化显示CD3和CD56阳性,以及EBV编码的RNA。EB病毒(EBV)可通过房水样本的聚合酶链反应(PCR)分析检测到。鉴于IL-10主要由B淋巴细胞分泌,T细胞或自然杀伤(NK)/T细胞型PVRL的细胞因子分析显示IL-10浓度较低。
由于大多数关于T细胞或NK/T细胞PVRL的研究仅为病例报告或小规模回顾性病例研究,目前尚无推荐的治疗方案。治疗主要根据DLBCL PVRL的治疗方案进行,例如通过静脉注射或玻璃体腔内注射MTX。
预后
研究表明CNS受累的PVRL预后较差。PVRL的CNS受累率相对较高,约三分之一的PVRL患者在初次就诊时便诊断为PCNSL,42%到92%的患者在平均8到29个月内进展为PCNSL。CNS受累率受到不同临床特征的影响。在孤立性PVRL患者中,VRL复发、IL-10水平升高和视网膜色素上皮下(sub-RPE)浸润与CNS受累率高相关。房水IL-10水平升高与肿瘤负荷高和疾病活动性相关。视网膜色素上皮下浸润具有高度侵袭性,患者的生存时间更短。CNS受累和VRL复发是相互影响疾病进展的风险因素。遗传因素可以有效预测PVRL患者的中枢神经系统进展。Yoshifuji等人证明,ETV6缺失和PRDM1改变是PVRL CNS进展的主要风险因素。基于这两个遗传因素,患者可分为慢速、中速和快速进展组(分别为0、1和2个因素),从而指导临床管理。如前所述,全身预防性甲氨蝶呤化疗可能延缓CNS进展,改善预后。鉴于PVRL具有高度恶性且死亡率高,通常建议进行全身预防性化疗,以延缓疾病进展,且不会引起显著的不良反应。然而部分临床特征,如性别、双眼受累和视网膜浸润,并非PVRL的预后因素。通过评估这些预后因素,临床医生可以筛选出高危PVRL患者,为其提供特定治疗以延长生存期。
总结和未来方向
应进行眼科成像检查,如FAF和OCT,以区分PVRL和葡萄膜炎。人工智能(AI)的发展可能会提高基于成像的PVRL诊断水平。与AI相比,临床医生的能力有限且不可避免地存在不一致性。AI可通过深度学习和对大量眼科成像数据的建模,提供更客观的诊断结果。尽管玻璃体样本的细胞学分析仍然是诊断的金标准,但其灵敏度有限。可以结合其他检测手段,包括IgH基因重排分析、检测MYD88L265P突变和细胞因子分析,以提高PVRL诊断的特异性和灵敏度。
由于该疾病较为罕见,目前仍缺乏大规模前瞻性研究,因此对于PVRL的最佳治疗策略尚未达成共识。靶向治疗的出现为PVRL患者带来了希望。在临床试验中,针对BCR信号通路发挥作用的靶向药物,如BTK抑制剂和免疫调节剂(例如来那度胺),已显示出良好的疗效。此外,包括磷脂酰肌醇3激酶(PI3K)/雷帕霉素靶蛋白(mTOR)抑制剂在内的新型靶向治疗,以及包括CAR-T细胞治疗和免疫检查点抑制剂在内的免疫治疗,越来越多地应用于PCNSL的治疗。这些方法显示出对CNS受累的PVRL的潜在疗效,但还需要在临床试验中进一步验证。进一步探索PVRL的发病机制,以及对PVRL患者进行详细的个体分子水平分析,可能会为开发更先进的靶向药物提供新的见解。
参考文献
Wang, Si-Yua Zhou, Suo-Wang; Gao, Jing; Wang, Liang. Primary vitreoretinal lymphoma: diagnosis, treatment, and prognosis—a review of current knowledge and future directions. Blood Science 7(2):p e00233, June 2025. | DOI: 10.1097/BS9.0000000000000233
猜你喜欢
- 崩漏怎么治疗呢?什么是崩漏
- 冬季皮肤瘙痒怎么回事
- Alzheimer's & Dementia:创伤性脑损伤与社区老年人30年认知变化
- Lancet Oncol.| 泽尼达妥单抗治疗HER2-扩增、不可切除、局部晚期或转移性胆道癌患者(HERIZON-BTC-01)
- Nat Commun:中国科学院施剑林等团队合作研究设计了2-DG和DBG支架,用于增强癌症压电催化免疫治疗
- 超九成处于“僵尸状态” 互联网医院为何雷声大雨点小
- 上千元的亲子游泳课:有的教练无资质、有的泳池不卫生
- 中国科学院高飞/王红梅/内蒙古大学郭旭东揭示胎儿卵巢中Foxl2表达细胞的命运
- 奥尔良嫩烤鸡腿的做法-香辣味烘焙菜谱
- 中年男人怎样去脚气最有效
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)