首页 > 医疗资讯/ 正文
三分之一的子宫内膜癌(EC)存在错配修复缺陷(MMRd)。其中,70%是由MLH1基因启动子的体细胞高甲基化引起的;其余病例由林奇综合征或MMR基因的双体细胞失活所导致。尽管MMRd型EC通常预后良好至中等,但已有报道称其在治疗反应和生存率方面存在异质性。本研究旨在通过免疫组织化学(IHC)和MLH1基因甲基化分析,研究MMRd型EC三种亚型在病理侵袭性和无事件生存期(EFS)方面的差异。本研究回顾性纳入接受子宫内膜癌手术分期的患者。对所有患者进行IHC分析,以评估MMR状态和p53状态。对IHC检测MLH1阴性的MMRd患者进行甲基化分析。MMRd人群分为:1)MLH1基因高甲基化型(MLH1-HyMet);2)MLH1基因未甲基化型(MLH1-UnMet);3)IHC检测显示仅MSH2和/或MSH6或PMS2阴性型(non-MLH1)。
在1171名接受手术分期和IHC评估的患者中,362名(30.9%)被归类为MMRd型并纳入分析。其中,59.7%(n = 216)为MLH1-HyMet型,11%(n = 40)为MLH1-UnMet型,29.3%(n = 106)为non-MLH1型。与MLH1-UnMet型和non-MLH1型相比,MLH1-HyMet型与年龄较大、体重指数较高、肿瘤体积较大、子宫肌层浸润较深、显著的淋巴血管间隙浸润、早期和低风险疾病的发生率较低相关。即使在调整分期和肿瘤组织学因素后,MMRd各亚型之间的EFS相似。然而,可以观察到MLH1-HyMet型有预后较差的趋势,尤其是在晚期/转移性病例中。
与其他MMRd各亚型相比,MLH1基因高甲基化的MMRd型EC表现出更具侵袭性的临床病理特征。然而,尽管在高甲基化亚组中观察到EFS较差的提示性趋势,尤其是在晚期病例中,但MMRd各亚型之间未检测到显著的预后差异。
-
在EC中,MMRd亚型之间的潜在差异尚未得到充分研究;
-
与未甲基化的MMRd型EC相比,MLH1基因高甲基化的EC表现出更具侵袭性的特征;
-
未检测到MMRd亚型之间存在显著的预后差异;
-
然而,观察到MLH1基因高甲基化的肿瘤有预后较差的趋势。
研究背景
与其他妇科恶性肿瘤不同,在过去30年里,EC的发病率急剧上升了132%,并且世界卫生组织估计,在未来20年内,因这种恶性肿瘤导致的全球死亡人数将增加超过70%。
多达三分之一的EC患者存在MMRd。EC中的MMRd可能是后天获得的,也可能是由于四个DNA MMR基因(MLH1、MSH2、MSH6或PMS2)中的至少一个,或者是EPCAM基因(导致MSH2的下游沉默)存在基因缺陷所致。MMRd状态可以通过IHC检测出来,这是一种广泛可用且可重复的方法,它能够评估错配修复蛋白的表达情况(MLH1、MSH2、MSH6和PMS2)。通过IHC评估,若四种蛋白中至少有一种呈阴性染色,就可以确定为MMRd状态,这会导致体细胞突变的积累,包括微卫星重复序列中的插入和缺失,进而导致高微卫星不稳定性(MSI-H)和高体细胞突变频率。这些在编码区域的突变事件所产生的结果是生成大量新的移码肽抗原。这些移码肽新抗原的丰富程度与强烈的CD3 + 和CD8 + T细胞反应相关,这也就解释了MMRd肿瘤对免疫检查点抑制剂(ICIs)表现出更高的敏感性。
绝大多数 MMRd型EC是通过启动子区域的高甲基化使MLH1基因发生体细胞失活(约占所有MMRd病例的70%-75%)。高达20%-30%的MMRd型EC在MMR基因中存在胚系致病性变异,从而引发一种常染色体显性遗传性疾病,即林奇综合征(LS),这会增加患多种肿瘤的易感性,尤其是结直肠癌和子宫内膜癌。未表现出上述两种情况的病例是由MMR基因的散发性双体细胞失活引起的,通常被称为“林奇样”肿瘤。
MMRd型EC大多在疾病早期被检测出来,总体预后良好到中等。然而,已有报道称MMRd型肿瘤存在化疗耐药性,这或许可以解释为什么与错配修复功能正常(MMRp)的晚期患者相比,MMRd型晚期患者的预后更差。由于肿瘤及肿瘤周围环境富含炎症,ICIs已被证明是MMRd型晚期/复发患者的有效二线治疗选择。然而,据报道,接受ICIs治疗的不同MMRd亚组在客观缓解率(ORR)和生存率方面存在差异,因此这表明MMRd组本身可能存在潜在的异质性。
MMR蛋白的稳定性由异二聚体结构来维持。特别是在绝大多数情况下,MLH1与PMS2形成异二聚体,而MSH2与MSH6形成二聚体。由于MLH1和MSH2是必需的伴侣蛋白,MLH1基因突变或启动子甲基化通常会导致PMS2同时缺失,而MSH2的变异则会导致MSH6同时缺失。PMS2和MSH6的变异可能会导致各自蛋白的单独表达缺失。
很少有研究表明,在MMRd型EC中,与未甲基化的亚组相比,MLH1启动子甲基化的亚组表现出更具侵袭性的临床行为。然而,到目前为止,关于MMRd状态对EC患者生存的影响的研究结果并不一致,而且不同MMRd亚型的预后价值也尚未得到全面的探究。
本研究的目的是通过IHC和MLH1启动子甲基化分析,探究MMRd型EC亚型在病理侵袭性和预后方面的潜在差异。
研究结果
在接受EC初次手术分期和完整IHC评估的1,171例患者中,362例(30.9%)被归类为MMRd并纳入分析。表1详细显示了IHC评估的MMRd蛋白阴性表达。根据IHC分型和甲基化分析结果,MMRd患者可分为MLH1-HyMet型(216/362,59.7%)、MLH1-UnMet型(40/362,11%)和non-MLH1型(106/362,29.3%)。中位随访42个月(IQR: 30-59)。本研究人群中没有患者接受ICI的一线治疗。
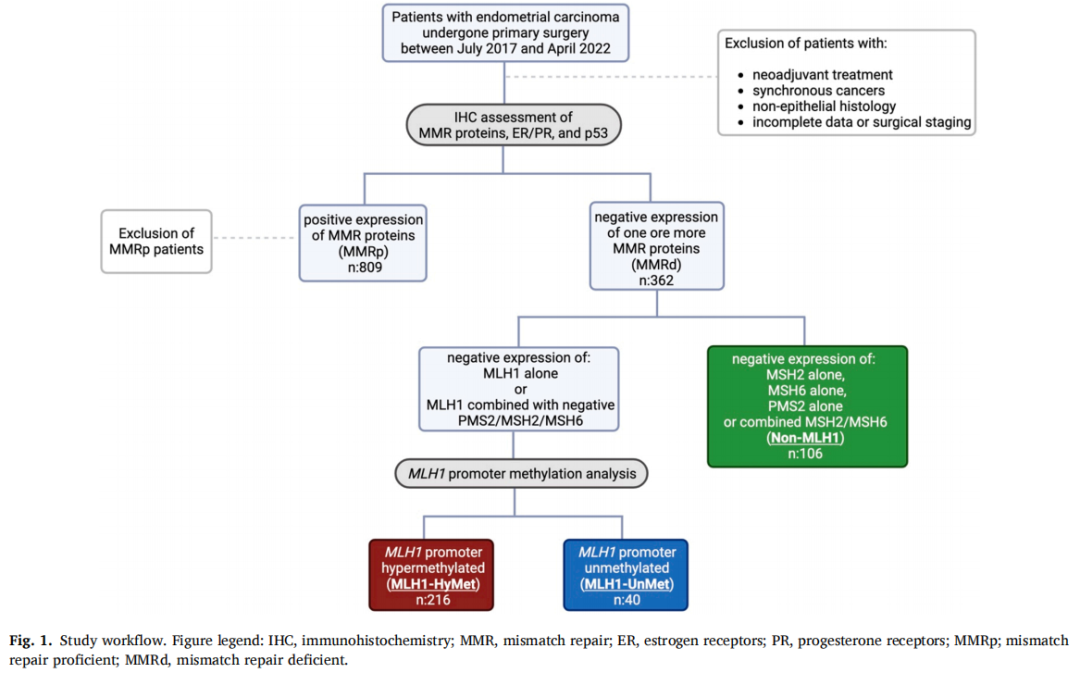
图1
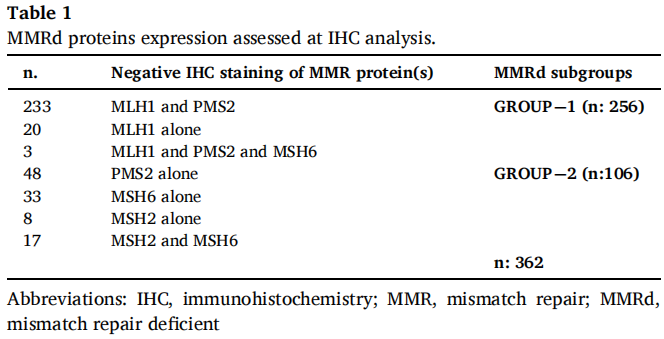
表1
表2显示了不同MMRd患者组的临床病理特征分布。MLH1-HyMet组患者年龄最大(p < 0.001),BMI最高(p = 0.003)。与MLH1-UnMet和non-MLH1相比,MLH1-HyMet显示出更大的肿瘤大小(p < 0.001),更深的肌层浸润(p < 0.001)和更高的实质性LVSI发生率(p = 0.038)。此外,与MLH1-UnMet组相比,3级肿瘤在MLH1-HyMet组和non-MLH1组中更常见,在MLH1-UnMet组中仅有5%的患者患有3级EC(p < 0.001)。重要的是,与其他MMRd亚型相比,在MLH1-HyMet组中,FIGO分期为IA期(p = 0.042)和2021ESGO-ESTRO-ESP分类为低危(p < 0.001)的肿瘤比例均较低。因此,辅助治疗在三个MMRd亚型中分布不同,只有27.3%的MLH1-HyMet患者未接受辅助治疗,相比之下,50.0%的MLH1-UnMet和37.7%的non-MLH1患者(p = 0.013)未接受辅助治疗。
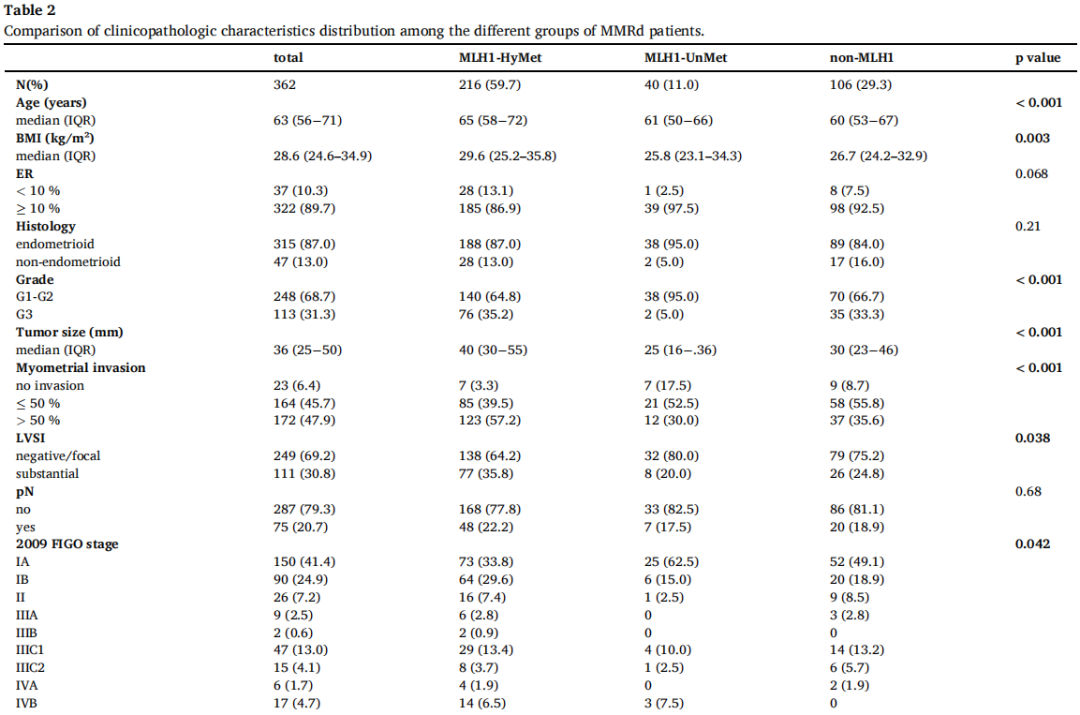
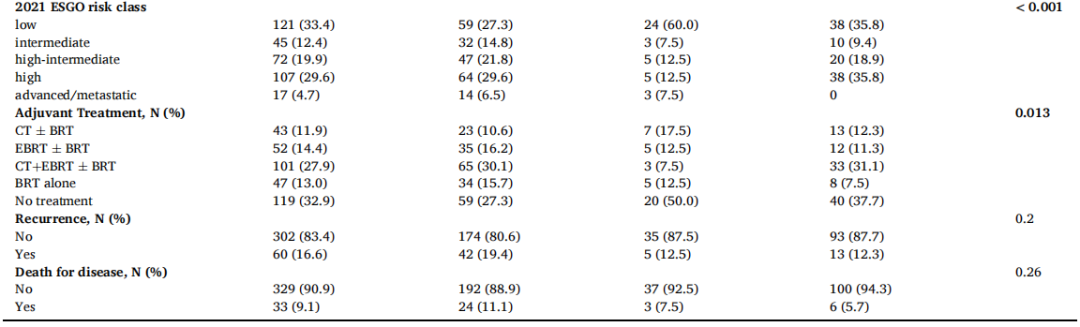
表2
在单因素Cox回归模型中,肿瘤组织学类型(子宫内膜样 vs 非子宫内膜样)、肿瘤分级(G1/G2级 vs G3级)、肿瘤大小、淋巴血管间隙浸润(LVSI,阴性/局灶性 vs 显著浸润)、2009FIGO分期(I-II期 vs III-IV期)以及2021ESGO-ESTRO-ESP风险等级(低风险 vs 中风险 vs 中高风险 vs 高风险 vs 晚期/转移性)均影响EFS(表3)。在将上述变量纳入多因素Cox回归模型后,发现仅肿瘤大小和淋巴血管间隙浸润在MMRd人群中与EFS独立相关(表3)。
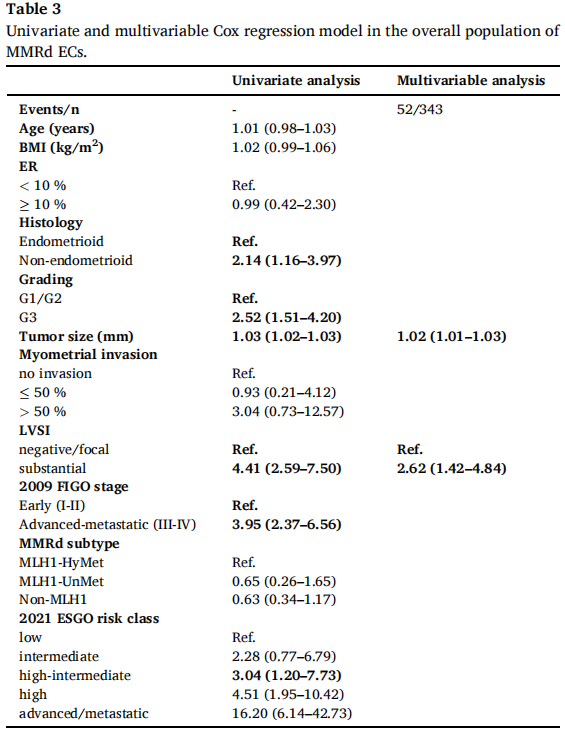
表3
在整体MMRd人群中,MLH1-HyMet组的5年EFS为77.3%(95%CI 70.4–84.2),MLH1-UnMet组为76.5%(95%CI 51.8–100),non-MLH1组为85.6%(95%CI 78.0–93.2);p = 0.26。
在早期亚组(2009年FIGO分期I-II期)的亚组分析中,MLH1-HyMet组的5年EFS为86.7%(95%CI 79.4–93.9),MLH1-UnMet组为79.8%(95%CI 54.3–100),non-MLH1组为87.8%(95%CI 79.4–96.2);p = 0.99。在晚期/转移性(2009年FIGO分期III-IV期)子宫内膜癌的亚组分析中,观察到了更为明显的差异,尽管差异无统计学意义(p = 0.18),其中MLH1-HyMet组的5年EFS为55.3%(95%CI 41.6–69.0),MLH1-UnMet组为75.0%(95%CI 45.0–100),non-MLH1组为78.2%(95%CI 60.9–95.4)。关于MMRd各亚型之间的生存差异以及EFS的Kaplan-Meier生存曲线的详细信息见图2(A、C、D)。
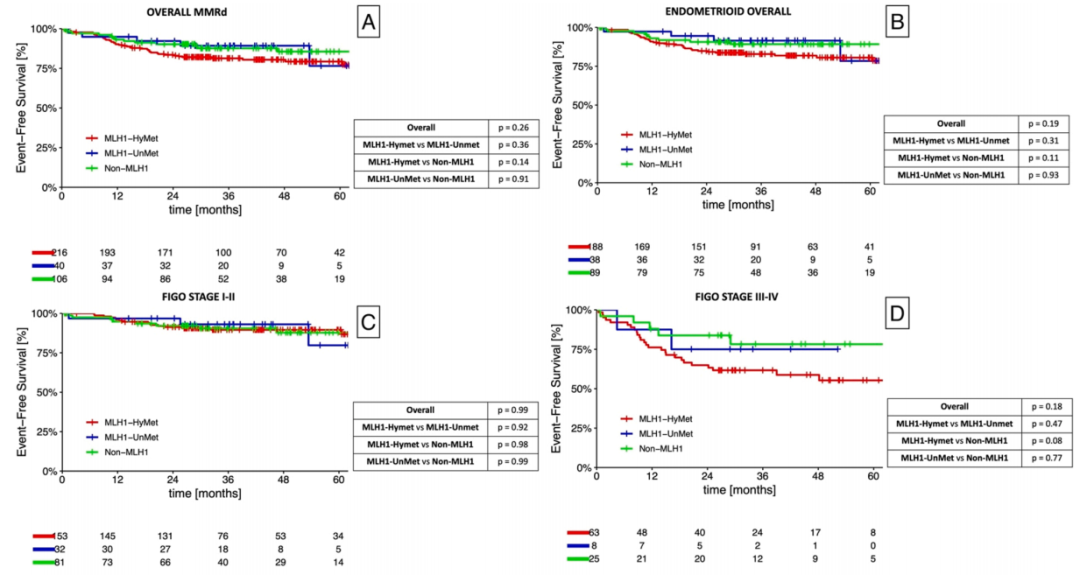
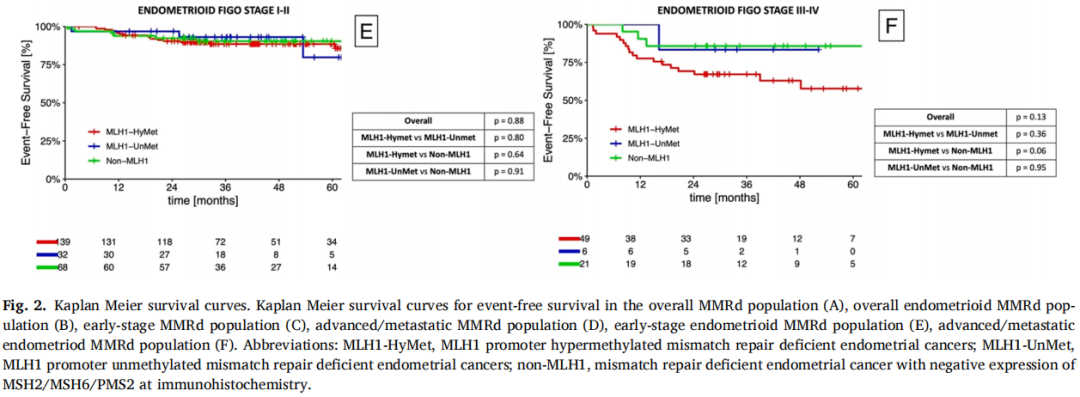
图2
子宫内膜样组织学类型:
对子宫内膜样组织学类型的病例(n = 315)进行了亚组分析。在I-II期子宫内膜样癌患者中,MLH1-HyMet组的5年EFS为85.7%(95%CI 78.1–93.3),MLH1-UnMet组为79.8%(95%CI 54.3–100),non-MLH1组为90.3%(95%CI 82.9–97.7);p = 0.88。在MMRd的III-IV期子宫内膜样癌患者中,MLH1-HyMet组的5年EFS为57.7%(95%CI 41.0–74.4),MLH1-UnMet组为83.3%(95%CI 53.5–100),non-MLH1组为85.7%(95%CI 70.8–100);p = 0.13(见图2,B、E、F)。对子宫内膜样MMRd亚组拟合了Cox回归模型。在多因素分析中,诊断时的年龄、肿瘤大小、是否存在淋巴血管间隙浸润以及2021年ESGO的晚期/转移性风险等级均是与EFS独立相关的变量。
非子宫内膜样组织学类型:
本研究人群包括13.0%(n = 47)的非子宫内膜样组织学类型的MMRd型EC患者。在这一亚组中,40.4%(n = 19)为去分化癌,36.2%(n = 17)为混合组织学类型,12.8%(n = 6)为浆液性癌,4.3%(n = 2)为透明细胞癌,2.1%(n = 1)为癌肉瘤,2.1%(n = 1)为未分化癌。关于不同的MMRd亚型,59.6%(n = 28)为MLH1-HyMet型,36.2%(n = 17)为non-MLH1型,而4.3%(n = 2)为MLH1-UnMet型。
值得注意的是,34.0%(n = 16)的非子宫内膜样MMRd病例也是多重分类病例,并且所有浆液性(n = 6)或混合性子宫内膜样-浆液性(n = 1)组织学类型的患者也都是p53异常(p53abn),属于多重分类病例。
多重分类的MMRd-p53abn病例:
在纳入分析的MMRd患者中,5.5%(n = 20)为多重分类病例,其中80%(n = 16)为非子宫内膜样癌。在这些病例中,25%(n = 5)为MLH1-HyMet型,10%(n = 2)为MLH1-UnMet型,65%(n = 13)为non-MLH1型。大多数多重分类病例接受了辅助治疗(85%,n = 17),有两名患者(10%)出现疾病复发(一名患者因临床状况不佳未接受辅助治疗,另一名患者拒绝化疗,仅接受了放疗)。
讨 论
主要研究结果总结:
本研究对文献中所描述的规模最大的MMRd EC人群之一进行了研究,通过IHC评估的蛋白表达模式和MLH1启动子甲基化分析,对MMRd EC患者进行了分类,观察到存在三种表达不同病理表型的MMRd EC亚组。与免疫组织化学检测MLH1阴性且MLH1启动子未甲基化(MLH1-UnMet)组以及免疫组织化学检测MLH1阳性(non-MLH1)组相比,免疫组织化学检测MLH1阴性且MLH1启动子高甲基化(MLH1-HyMet)亚组具有更高比例的病理侵袭性特征(肿瘤更大、肌层浸润超过50%、显著的LVSI),患者年龄更大、BMI更高,早期诊断以及根据2021 ESGO-ESTRO-ESP共识被归类为低风险的疾病比例更低。在多因素Cox回归分析中,在整体MMRd人群中,肿瘤大小和LVSI的存在与EFS独立相关。在对子宫内膜样MMRd患者的亚组分析中,多因素回归显示,诊断时的年龄、肿瘤大小、LVSI的存在以及晚期/转移性风险等级与EFS独立相关。在比较三种MMRd亚型时,即使在根据2009年FIGO分期(早期和晚期/转移性亚组分析)以及肿瘤组织学(子宫内膜样MMRd EC亚组分析)进行校正后,肿瘤学结局仍然相似。然而,可以观察到MLH1-HyMet组有预后较差的提示性趋势,尤其是在晚期/转移性病例中。本研究人群中,非子宫内膜样MMRd病例占13.0%,多重分类(MMRd-p53abn)的子宫内膜癌病例占5.5%,并且观察到约三分之一的非子宫内膜样子宫内膜癌也是多重分类病例,实际上,大多数多重分类病例(80%)为非子宫内膜样癌。此外,具有多重分类特征的患者中只有两名(10%)出现复发;然而,这些患者由于临床状况原因接受的辅助治疗并不理想。
与已发表文献的比较:
在本研究中,被分类为MLH1-HyMet亚型的患者比例(59.7%)与先前发表的数据一致,这些数据报道的高甲基化MMRd EC的比例在40%-80%。相应地,非子宫内膜样MMRd EC的比例(13.0%)和多重分类患者的比例(5.5%)与先前的研究相似。
关于生物学侵袭性方面,本研究结果支持了先前在较小样本量人群中的研究数据,这些数据表明,MLH1高甲基化的MMRd EC与疾病晚期、存在LVSI、肿瘤较大以及患者年龄较大相关。
其他研究报道称,高甲基化的MMRd EC在子宫内膜样MMRd肿瘤亚群中表现出更高的负面预后影响,尤其是在晚期(2009年FIGO分期III-IV期)临床病例中。在本研究人群中,尽管在III-IV期子宫内膜样癌病例中可以观察到MLH1-HyMet组有预后较差的提示性趋势,但MMRd亚组之间的肿瘤学结局差异并未达到统计学意义。这些结果在本研究的整体MMRd人群中也得到了证实,包括子宫内膜样和非子宫内膜样亚组。
尽管本研究与Post等人的研究在亚组分类方面存在差异(后者包括林奇综合征[LS]的胚系检测),但两项研究显示出相似的复发率和预后趋势。实际上,Post等人报道,LS患者的5年无复发生存率为91.7%,而高甲基化患者为78.6%,这与本研究人群的结果一致,本研究结果显示non-MLH1组的5年EFS为85.6%,而MLH1-HyMet组为77.3%。然而,与本研究发现相反,Post的分析中预后差异具有统计学意义。两项研究之间的这种不一致可能由多种因素解释。首先,Post的分析中对特定的LS患者群体的定义可能解释了该亚组生存率较高的原因,该亚组患者明显更年轻,因此更有可能对治疗有更好的耐受性,并且在诊断时多为IA期。其次,Post的分析中随访时间更长也可能解释了结局的显著差异。实际上,MMRd EC大多在疾病早期被诊断出来,有理由推测该组患者的复发可能在随访后期才会出现。因此,本研究MMRd人群的中位随访时间[42个月(四分位间距:30-59个月)]可能不足以检测到晚期疾病复发。
关于本分析中报道的少数多重分类(MMRd-p53abn)亚组,研究者不仅在频率方面观察到与已发表数据的相似性(本研究中为5.5%,Post等人的研究中为7.7%),而且研究者还证实,与其他MMRd亚型相比,高甲基化肿瘤中多重分类病例的比例更低。值得注意的是,研究者观察到,尽管多重分类患者中80%为非子宫内膜样组织学类型,但只有两名(10%)接受了不理想治疗的患者出现了复发。然而,多重分类是罕见的免疫组织化学特征,本研究中的患者数量(n = 20)不允许对生存率进行进一步分析。因此,尽管很难就结局得出结论,但本研究数据可能潜在地表明,经过适当治疗的MMRd-p53abn患者与MMRd患者相比,复发风险并不更高,这与文献中的先前数据一致。
在MMRd EC的特定情况下,越来越多的数据表明,ICIs在晚期/复发患者亚群中具有显著的预后益处。ICIs在MMRd EC中出色的客观缓解率(ORR)和改善的生存结局明显优于MMRp患者,且毒性特征可接受。随着对子宫内膜癌基因组学和分子特征的了解不断增加,我们能够为患者提供的特定靶向治疗范围以及治疗升级/降级的可能性也将扩大。此外,鉴于有证据表明,基于进一步的生物标志物对已确定的四种分子亚组进行再分类,可能会更准确地预测结局,并为辅助治疗的个性化管理提供机会——正如在无特定分子特征(NSMP)的子宫内膜癌中所证明的那样——越来越明显的是,将所有子宫内膜癌简单地分为四种分子类型可能过于简单,无法准确反映这种恶性肿瘤的异质性。在接受辅助盆腔放疗或化疗联合放疗的子宫内膜癌患者人群中,Loukovaara等人观察到,辅助治疗仅在NSMP肿瘤中与无病生存期(DFS)改善相关,而在整个MMRd队列中,辅助治疗对DFS没有影响,与未甲基化的MMRd亚组相比,MLH1启动子高甲基化的MMRd肿瘤的DFS更差。此外,尽管MMRd组已被证明是最适合接受ICIs治疗的亚组,但一些研究报道了不同MMRd EC亚型在治疗反应率和生存率方面的差异。在一项针对接受帕博利珠单抗治疗的复发MMRd EC的小型II期研究中,Bellone等人报道,林奇/林奇样患者的ORR为100%,而散发性(MLH1启动子高甲基化)患者仅为44%,3年无进展生存期(PFS)和总生存期(OS)分别为100% vs 30%和100% vs 43%。类似地,Toboni等人观察到,高甲基化的MMRd EC对帕博利珠单抗的反应更差,且使用ICIs的时间更短。相反,在对NRG GY018试验的亚组分析中,在接受帕博利珠单抗联合卡铂-紫杉醇治疗的MMRd患者人群中,MMR缺失的机制并不是PFS的显著预测因素。同样,对GARNET试验的事后分析表明,不同的MMR缺陷途径不影响对dostarlimab的反应,通过二聚体对缺失或MMR基因甲基化/突变状态的预后也没有差异。与此一致的是,RUBY试验也表明,无论MMR蛋白缺失的机制如何,dostarlimab和化疗的联合治疗在晚期MMRd/MSI的子宫内膜癌中都具有预后优势。尽管在不同MMRd亚型对ICIs的反应方面,研究之间仍然存在不一致,但一些临床前数据可能部分解释了MMRd EC组中的生物学异质性。林奇/林奇样肿瘤潜在反应优势的病理生理学是复杂且多因素的,很少有证据报道高甲基化肿瘤与林奇/林奇样肿瘤之间在肿瘤微环境和涉及的免疫活性细胞方面存在差异。实际上,Toboni等人也观察到,与MLH1突变的亚组相比,高甲基化亚组的肿瘤/肿瘤周围微环境更“免疫冷”(PD-L1阳性率更低、B细胞和T细胞以及单核细胞比例更少、T细胞炎症评分和干扰素γ评分更低)。这表明MMRd组中可能存在潜在的异质性,值得进一步探索。值得注意的是,本研究的晚期/转移性病例中没有患者接受一线ICIs治疗。基于少数相互矛盾的证据,这些证据支持在无启动子高甲基化的MMRd患者中改善结局和ORR,如果整个晚期/转移性MMRd组都接受了ICIs治疗,可能会观察到更明显的生存差异。
研究的优势和局限性:
应该认识到本研究存在一些局限性。回顾性研究的性质和相对较短的中位随访时间是主要的缺点。此外,尽管据研究者所知,本研究的MMRd人群是文献中描述的规模最大的人群之一,但正如预期的那样,一些MMRd亚型的样本量较小(例如,MLH1阴性未甲基化肿瘤、非子宫内膜样组织学类型和多重分类病例)。纳入所有FIGO分期的病例无疑增加了本研究人群的异质性。然而,对早期(2009年FIGO I-II期)和晚期/转移性疾病(2009年FIGO III-IV期)特定情况的亚组分析持续减少了这一研究弱点,同时也能够对整个MMRd人群进行更完整和现实的描述。此外,本研究未分析POLE突变状态;然而,最近发表的关于多重分类子宫内膜癌的数据报道,在整体子宫内膜癌人群中,POLE突变且MMRd的比例为0.5%。因此,由于这一比例不高,缺乏POLE测序不太可能成为本研究的偏倚因素。同样,未对未分化和去分化组织学类型的SWI/SNF蛋白状态进行分析可能会影响这些病例预后定义的准确性。然而,由于只有20例病例可能从该评估中受益,因此对生存分析的总体影响可能很小。此外,仅一小部分患者可获得用于评估MLH1-UnMet和non-MLH1亚组中林奇综合征的胚系数据,因此无法将其纳入分析。作为主要优势,据研究者所知,本研究是文献中分析MMRd EC人群规模最大的研究之一。此外,对极其罕见的MMRd实体(如多重分类病例和非子宫内膜样组织学类型的MMRd肿瘤)的详细描述,有助于增加目前文献中报道的有限知识和数据。另一个优势是本研究工作流程与先前的相关出版物一致。
对临床实践和未来研究的启示:
在分子驱动治疗的时代,子宫内膜癌患者的治疗选择迅速增加,而MMRd作为子宫内膜癌的第二大分子亚组,可能会受益于进一步整合分子生物标志物和/或亚组分类,以提高整体治疗反应,并减少潜在的临床和经济毒性。正在进行的试验,如RAINBO伞式试验、PORTEC-4a试验和EUGENIE试验——将很快解决关于MMRd EC和其他分子亚组中分子定制手术分期和辅助治疗可能性的重要未满足需求。虽然MMRd已被确定为最能从ICIs治疗中受益的亚组,但在不同研究中,关于接受ICIs治疗的患者根据特定MMRd亚型在反应率和生存率方面的差异,仍存在一些不一致之处。尽管如此,LEAP-001试验(NCT03884101)的可靠数据最近已经公布,结果显示,与标准化疗组相比,接受仑伐替尼联合帕博利珠单抗联合治疗的患者有近2年的预后益处。一旦假定MLH1高甲基化的子宫内膜癌具有更强的生物学侵袭性,并且在等待LEAP-001亚组分析结果(该结果将进一步阐明MLH1高甲基化的子宫内膜癌患者与MMRd和MMRp患者相比,对仑伐替尼-帕博利珠单抗联合治疗的反应情况)的同时,应该努力评估在高甲基化情况下联合使用多种靶向药物而非单一ICIs的预后益处,以提高对治疗的总体反应。
总之,在大量MMRd EC患者人群中,研究者已经证明,与其他MMRd亚组相比,MLH1高甲基化的MMRd EC与不利的临床病理特征相关。尽管有提示性趋势表明MLH1高甲基化的MMRd EC预后较差,但研究者并未证明三种MMRd亚组之间存在显著的预后差异。未来的研究需要进一步探索MMRd EC亚分类的预后价值,特别是与辅助治疗和免疫治疗反应相关的方面。这最终可能有助于通过在对免疫治疗敏感性较高的亚组中实施一线ICIs,并为那些显示出较高化疗耐药性和较差生存率的MMRd EC患者采用联合治疗方案,来实现更精准的治疗定制。
参考文献:
Capasso I, Perrone E, Duranti S, et al. Are all mismatch repair deficient endometrial cancers created equal? A large, retrospective, tertiary center experience. Eur J Cancer. 2025;220:115344. doi:10.1016/j.ejca.2025.115344

- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)