首页 > 医疗资讯/ 正文
2025年5月2日,中国科学技术大学王育才/蒋为团队在《Nature Biomedical Engineering》在线发表题为《Enhanced nanoparticle delivery across vascular basement membranes of tumours using nitric oxide》的研究论文。该研究聚焦于纳米药物递送效率的关键屏障—肿瘤血管基底膜(Basement Membrane, BM),提出利用一氧化氮(NO)精准空间催化降解的策略,通过特异性调控肿瘤相关内皮细胞,实现对基底膜屏障的高效突破,从而显著提升纳米药物在肿瘤组织内的递送效率。

尽管纳米药物在抗肿瘤治疗中展现出广泛前景,然而临床数据显示,最终抵达肿瘤基质及肿瘤细胞的药物比例仍不足1%。肿瘤血管结构异常复杂,长期被认为是限制药物递送效率的关键因素。传统“增强渗透与滞留”(EPR)效应理论虽提出,纳米药物可通过渗漏的血管进入肿瘤组织,但无法解释其跨血管递送效率普遍偏低的现象。
在前期研究中,该团队发现肿瘤血管外侧包被一层致密的基底膜,形成物理性机械屏障,阻碍了纳米药物的有效外渗,使得纳米药物会在肿瘤血管外形成“血池”样的结构(Nature Nanotechnology,2024, 19, 95–105)。因此,如何高效突破基底膜是实现的纳米药物高效递送的关键,但该过程面临三大挑战:其一,基底膜位于内皮外侧,难以直接作用,需实现药物的定向跨内皮传输;其二,基底膜呈高度交联的网状结构,机械强度高,对常规治疗手段具有抵抗性;其三,非特异性降解可能破坏血管稳定性并诱发肿瘤转移风险,因此亟需发展一种精准、安全、可调控的干预策略。
在血管新生过程中,基底膜的降解与重塑是驱动内皮细胞迁移与新生血管形成的关键环节,而一氧化氮(NO)正是调控该过程的重要信号分子。受此生理过程启发,本研究提出一种“时空可控”的酶促基底膜重塑策略,通过释放NO,精准控制金属基质蛋白酶(MMP)活性,在维持血管结构完整性的同时,实现基底膜屏障的高效突破。该策略将原本阻碍递送的“血池”转化为纳米颗粒外渗的“前哨阵地”,实现“主动递送”(图1)。该策略包括两步关键过程:第一,NO诱导血管内皮细胞间连接破坏,暴露其外侧基底膜,以促进纳米颗粒准确定位基底膜并聚集形成“血池”;第二,NO进一步激活血池周边内皮细胞内的MMP,短暂且可逆地精准降解基底膜,促进纳米颗粒实现“动态喷发式”血管外渗,增强其在肿瘤组织内的渗透。为实现NO肿瘤内精准可控释放,研究人员构建了近红外激光触发的NO纳米发生器(NanoNO),实现NO的时空可控释放。NanoNO与临床纳米药物联合应用后,在动物模型中显著提高了多种纳米药物在肿瘤中的富集与治疗效果。尤其重要的是,该策略通过激活内源性MMP,避免了外源性酶引发的不可控降解与转移风险,增强了基底膜调控的安全性与可控性。
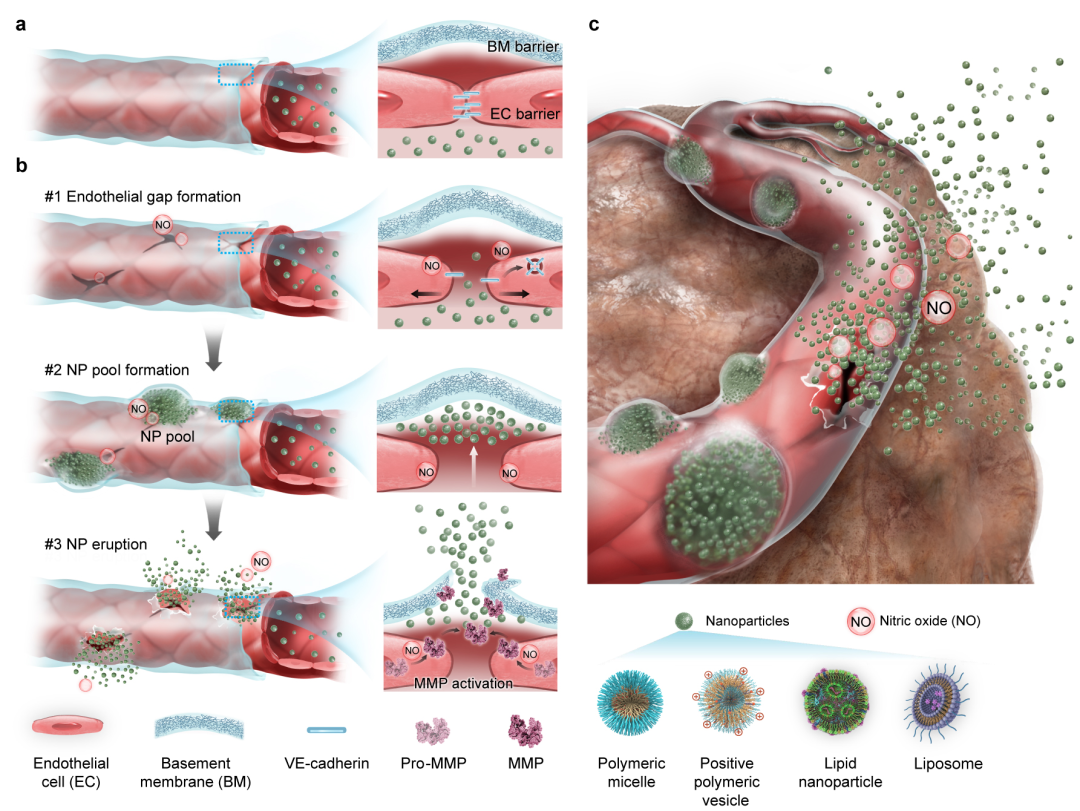
图1、NO诱导基底膜屏障的空间催化降解,以增强纳米颗粒进入肿瘤。
透射与扫描电镜观察发现,在小鼠4T1乳腺癌模型中,肿瘤血管基底膜呈多层致密、纤维状片层结构(图2)。进一步对小鼠、兔及人类肿瘤样本的系统性分析显示,基底膜覆盖率普遍超过95%,进一步验证基底膜是限制纳米颗粒进入肿瘤基质的关键屏障。为动态追踪纳米颗粒的跨血管过程,研究团队建立了小鼠耳部4T1肿瘤活体成像模型,并使用荧光标记的PEG-b-PLGA胶束作为模式纳米颗粒。在静脉注射纳米颗粒1分钟后,通过瘤内注射NO供体,在肿瘤血管上观察到纳米颗粒“血池”形成,随后出现“动态喷发式”外渗,即大量纳米颗粒进入肿瘤基质,且渗透范围与深度明显提升。值得注意的是,这个喷发过程是动态的,单个血池区域可在30分钟内发生多次喷发,且喷发频率与NO剂量呈正相关。该现象亦在胰腺癌、结肠癌等多种肿瘤模型中得到验证。NO可诱导多种类型的纳米颗粒(如脂质体、脂纳米颗粒LNP及阳离子聚合物)发生动态喷发式的外渗现象,而对微米颗粒及粒径较小的葡聚糖作用较弱,表明其与颗粒尺寸密切相关。
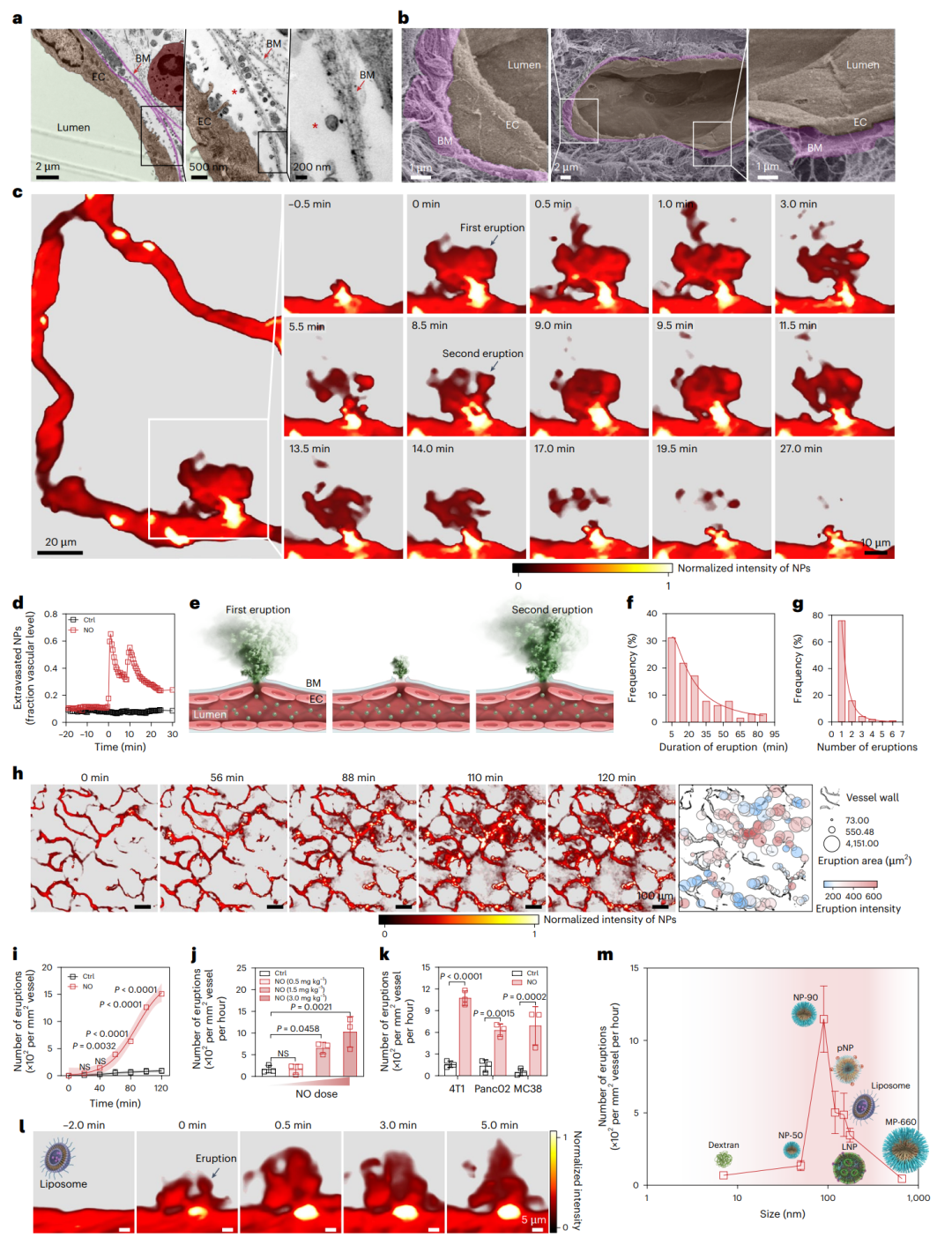
图2、NO诱导纳米颗粒在血管处发生“动态喷发式”外渗现象,促进肿瘤基质递送。
接下来,研究人员探究了NO突破基底膜屏障的机制(图3)。扫描电镜显示,NO诱导肿瘤血管内皮细胞间形成大量内皮间隙(平均尺寸约195 nm)。体外HUVEC模型表明,NO显著增大细胞间隙面积,减少细胞粘附连接。机制研究表明,NO通过诱导VE-cadherin酪氨酸658位点磷酸化,加速VE-cadherin降解,同时引发肌动蛋白骨架重构,从而增强内皮细胞间隙开放。在体内实验中,NO同样促使VE-cadherin表达下降及磷酸化水平上升,进而打开内皮屏障,暴露出原本被隐匿的基底膜结构。
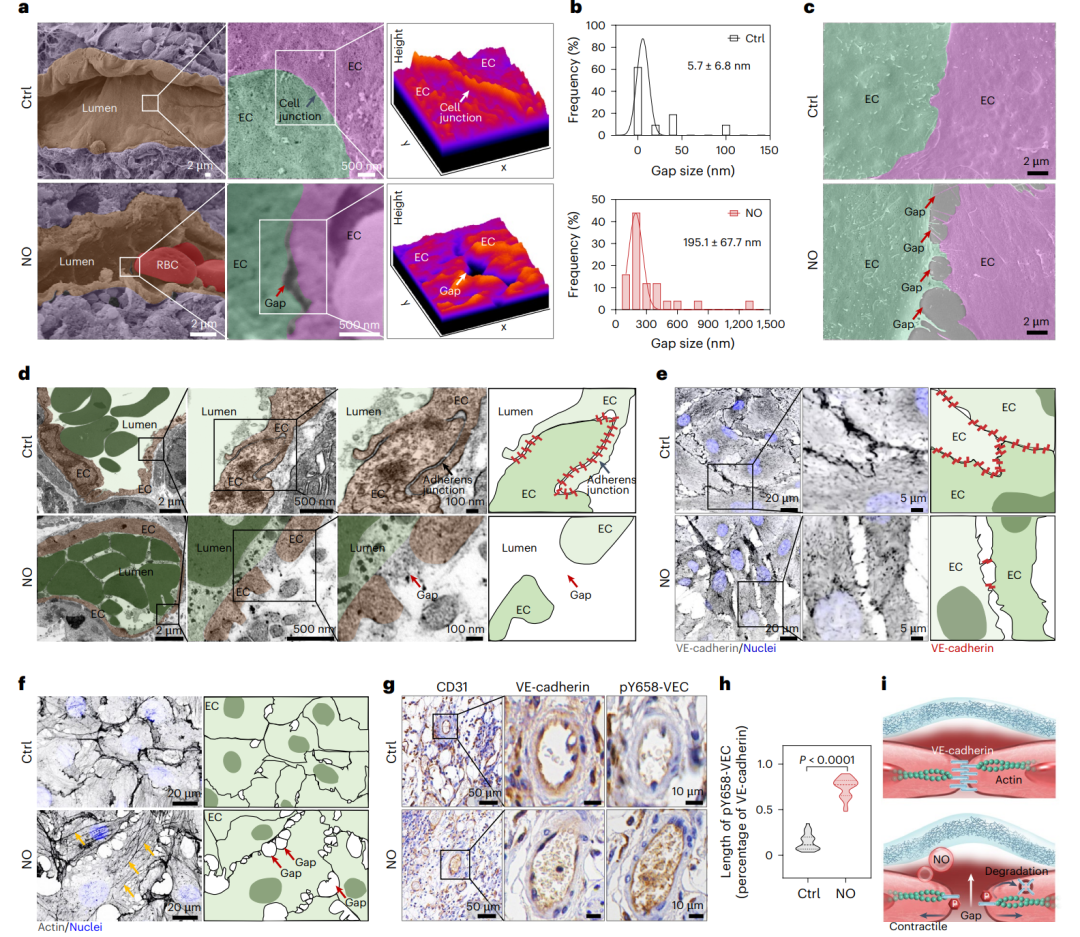
图3、NO促进内皮间隙的打开,暴露隐藏在其外侧的基底膜结构。
使用Tie2-cre:Ai9转基因小鼠进行活体显微成像,发现纳米颗粒可通过NO诱导形成的内皮间隙进入内皮下空间,并在基底膜与内皮之间形成高荧光信号聚集的“血池”(图4)。延时成像显示,血池在10分钟内形成并达到峰值,其密度高达每平方毫米血管面积2000个,呈明显NO剂量依赖性。这一现象在多种肿瘤模型均观察到,表明NO可诱导内皮细胞间隙打开,促进纳米颗粒精准空间定位于基底膜区域。

图4、NO促进纳米颗粒形成血池,实现基底膜的精确空间定位。
在明确NO作用下纳米颗粒定位在基底膜后,研究进一步阐明其促进纳米颗粒跨越基底膜的分子机制(图5)。活体成像结果显示,NO可诱导基底膜产生直径约1–5 μm的动态“孔洞”结构。免疫组化、明胶酶谱分析及免疫荧光染色结果表明,NO可激活内皮细胞内的MMP,从而介导基底膜的降解过程。进一步观察发现,活化的MMP的空间分布与纳米颗粒的喷发式外渗现象高度时空共定位。结合分子机制研究与MMP抑制剂干预实验证实,NO通过激活内源性MMP,诱导基底膜发生瞬时可逆性降解,促使纳米颗粒从血管腔向肿瘤间质呈喷发式释放,从而为高效肿瘤递送提供了新的策略。
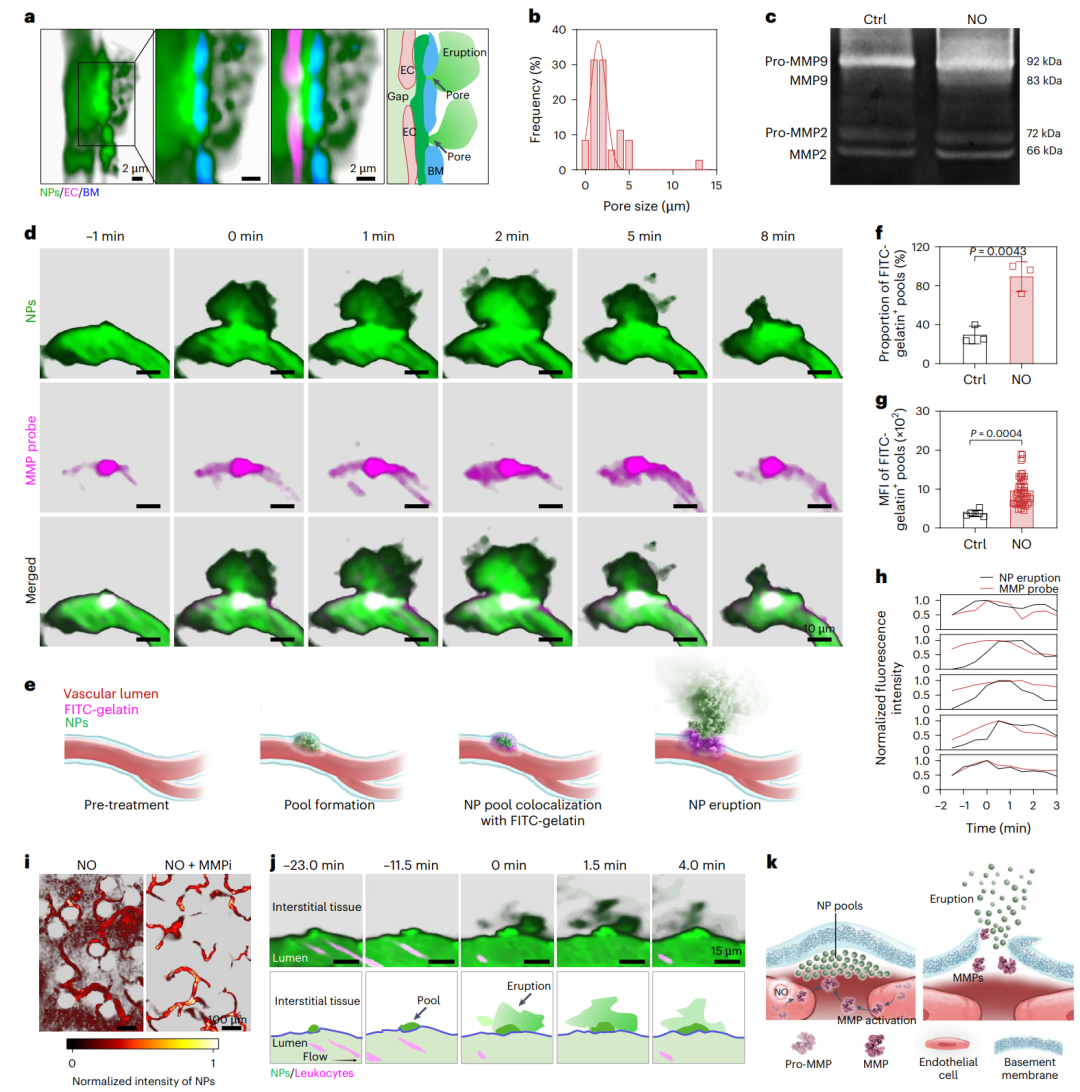
图5、纳米颗粒依赖于活化的MMP突破基底膜屏障并诱导血池喷发。
尽管NO具备良好的基底膜屏障调控能力,其在肿瘤靶向应用中仍面临释放速率控制、系统副作用及组织特异性递送等挑战。作为概念验证,研究团队开发了NanoNO系统,通过近红外光触发按需释放NO,以提升递送效率并增强靶向性(图6)。NanoNO以上转换纳米粒子(UCNP)为核心,外层修饰聚乙二醇并锚定N-亚硝胺类NO供体(NOD)。在980 nm激光照射下,UCNP发射的UV-Vis光激活NOD,实现NO的精准释放。
活体成像显示,NanoNO在4T1肿瘤血管中诱导大量“血池”形成并随着时间发生动态喷发,促进纳米颗粒向肿瘤深层渗透。该效应归因于近红外光的组织穿透力及NO释放的局部调控能力。进一步研究显示,MMP在此过程中发挥关键作用:NanoNO与MMP抑制剂联用后,虽仍可形成血池,却明显抑制纳米颗粒外渗。值得注意的是,NanoNO诱导的血管通透性增强具有良好可逆性,近红外照射后血管屏障在24小时内逐步恢复,避免了永久性结构破坏,从而在保障安全性的同时,提供一个短暂但有效的“递送窗口”。
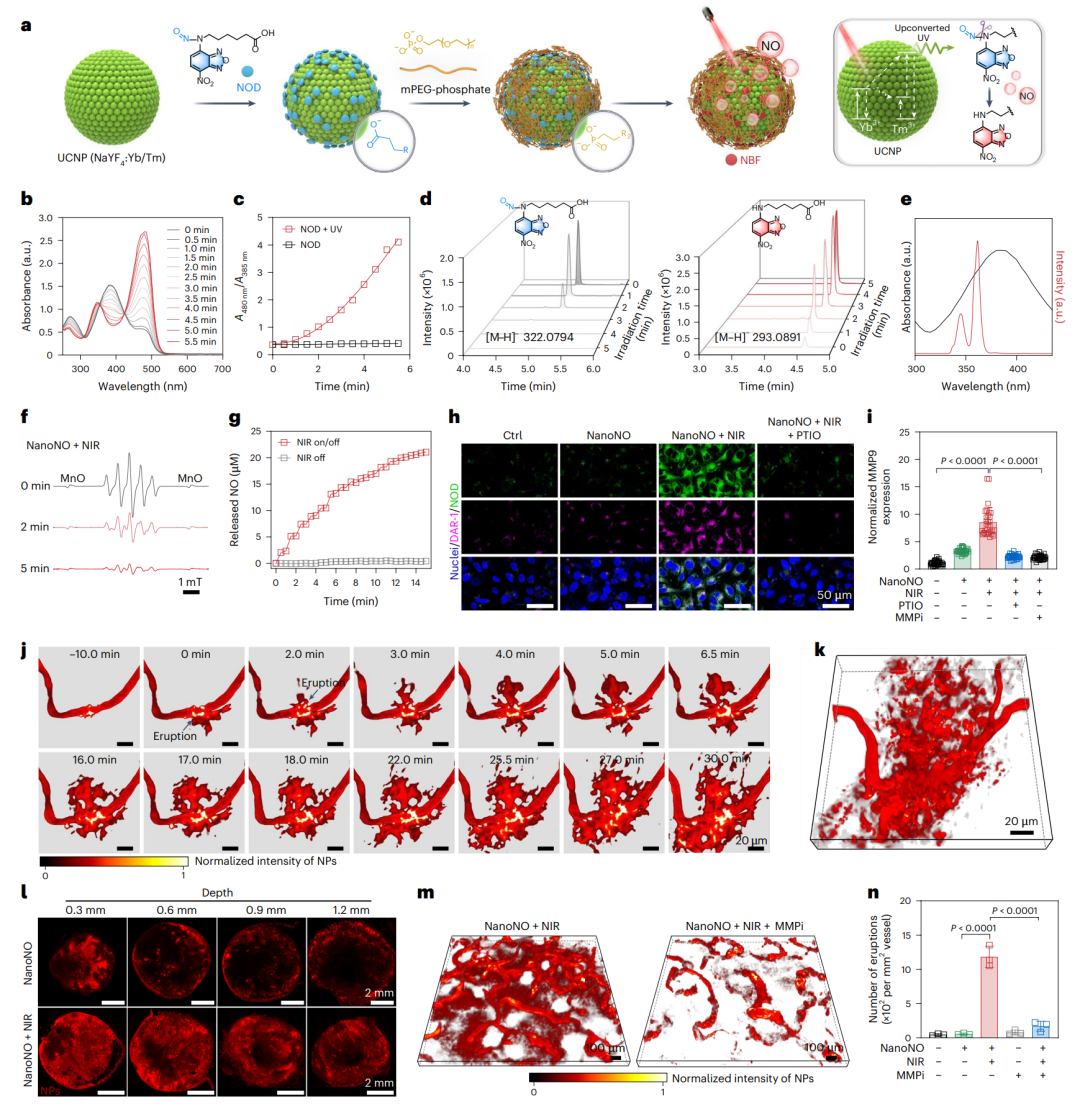
图6、NanoNO实现可控释放NO,突破肿瘤血管基底膜屏障,诱导纳米颗粒“动态喷发式”外渗行为。
体内治疗实验结果显示,NanoNO联合近红外照射可显著提升多种纳米颗粒(包括聚合物纳米颗粒、脂质体、金纳米颗粒)在原位及异位4T1肿瘤中的富集效率。该策略同样显著增强了临床纳米药物的递送效果,例如脂质体阿霉素(Lipo DOX)与mRNA-LNP的递送效率分别提升约3-4倍。其中,联合NanoNO的Lipo DOX治疗几乎完全抑制肿瘤生长,抑瘤率达96%;联合PTEN mRNA也可实现约80%的抑瘤效果。在兔VX2肿瘤模型中,NanoNO联合DOX聚合物胶束治疗的抑瘤率达94%,进一步验证了该策略在不同动物物种与纳米平台间的广泛适用性。毒理学评估显示,NanoNO具有良好的生物相容性,短期与长期使用均未观察到明显毒副作用或促肿瘤转移风险。
本研究在纳米药物领域取得了多方面的进展。首先,本工作强调了非内皮性屏障,尤其是基底膜在药物递送过程中的关键屏障作用。通过利用NO这一临床可及的干预手段实现对基底膜结构的可控调节,显著增强了多种已获批纳米药物的治疗效果,为纳米药物的临床转化提供了新契机。其次,研究系统揭示了NO与肿瘤血管间的相互作用机制,发现NO可诱导纳米颗粒在血管内形成动态喷发式跨血管转运行为,从而实现高效肿瘤递送。该策略具有良好的通用性,有望拓展应用于蛋白质药物、抗体疗法、疫苗及工程化细胞治疗等多种治疗体系。本研究构建的递送优化体系不仅适用于肿瘤治疗,也为多种存在基底膜屏障的疾病实现精准递送提供了具有广泛适用性的通用平台。
原文链接:
https://www.nature.com/articles/s41551-025-01385-w
猜你喜欢
- 推荐3日排毒减肥餐单清除毒素让你更快瘦身
- World J Clin Cases:背侧入路治疗孤立掌侧骨折脱位:第二掌骨基部1例报告
- 你知道导致乳腺癌的因素有哪些吗?
- 夏季要注意几种肠胃疾病的养生方法
- 手撕鸡肉的做法-家常味拌菜谱
- J Clin Oncol:反种族主义干预对肺癌手术的种族差异的影响
- 花生到底是起到升血脂还是降血脂的作用
- Eur Urol Focus:鹿特丹前列腺癌风险计算工具的外部验证和与Stockholm3在前列腺癌诊断中的比较
- Mediators Inflamm:肝豆扶木汤通过PI3K/Akt/mTOR抑制肝自噬减轻肝豆状核变性肝损伤
- 全面评估北京当前流行株BF.7的病毒学特征,疫苗及单抗防治效果
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)