首页 > 医疗资讯/ 正文
导读
肝脏是人体最大的代谢和解毒器官,也是一个强大的“免疫堡垒”。肝脏中驻扎着大量免疫细胞,其中巨噬细胞(Macrophages)堪称“第一道防线”。它们不仅负责清除病原体和死亡细胞,还在肝脏损伤修复中扮演关键角色。近期,eGastroenterology发表来自美国国立卫生研究院高斌教授、冯德春博士及团队的原创研究“Characterisation of macrophages in healthy and diseased livers in mice: identification of necrotic lesion-associated macrophages”,本研究通过多重免疫荧光染色和单细胞RNA测序技术,首次系统揭示了小鼠肝脏中两类巨噬细胞——库普弗细胞(KCs)和单核来源巨噬细胞(MoMFs)在健康与疾病状态下的动态变化,加深我们对肝脏巨噬细胞的认知。

第一部分:健康肝脏中的巨噬细胞——稳定的“常驻军“
01 巨噬细胞的“主力军”:库普弗细胞
(1)数量优势:在健康小鼠肝脏中,KCs占所有免疫细胞的80%以上,是肝脏的“常驻守卫”(见图1)。它们通过吞噬细菌、清除衰老红细胞和死亡肝细胞,维持肝脏微环境的稳定。
(2)区域分布:肝脏分为三个功能区域,包括Zone 1靠近门静脉(封面图绿色区域),Zone 3靠近中央静脉(蓝色区域),Zone 2介于二者之间(白色区域)。研究发现,KCs在Zone 1和Zone 2分布更密集,且Zone 1的KCs体积更大。这种分布可能与肠道微生物的持续刺激有关,由于Zone 1是首先接收来自肠道的门静脉血的区域,因此该区域可能需要更强的免疫防御功能,以应对潜在的微生物和毒素入侵。
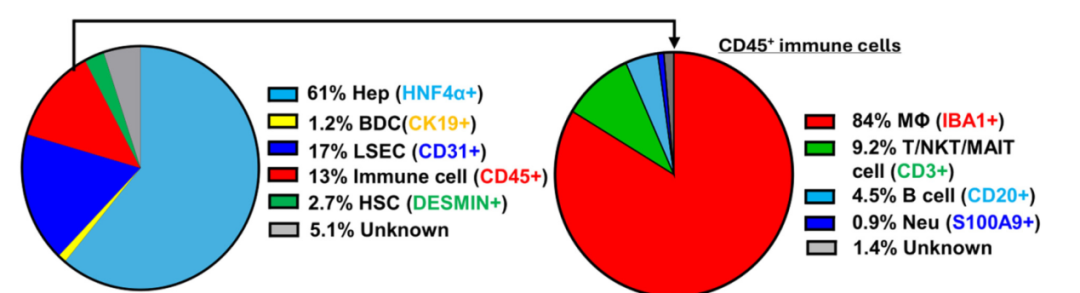
图1:该图描绘了健康小鼠肝脏的细胞比例,免疫细胞占比约13%,而且所有的免疫细胞中,KCs的占比达到84%
来源: 原文图1C
02 功能特性:高效吞噬与免疫监视
(1)吞噬能力:通过注射荧光标记的细菌颗粒实验,发现Zone 1的KCs吞噬活性显著高于其他区域。这种区域性功能分化,确保了肝脏对来自肠道的病原体快速响应。
(2)低增殖与凋亡:健康状态下,KCs和少量MoMFs的增殖与凋亡率极低(仅1%-2%),表明其稳态维持主要依赖自我更新而非外部补充。
第二部分:病态肝脏中的巨噬细胞——动态的“救援队”
01 肝损伤中的“新兵”:单核细胞来源的巨噬细胞
(1)快速动员:在急性肝损伤(如药物性肝坏死)或慢性肝病(如脂肪性肝炎)中,循环血中的单核细胞会迅速迁移至肝脏,分化为MoMFs(见图2)。例如,在刀豆球蛋白A(ConA)诱导的急性肝损伤模型中,坏死区域超过95%的巨噬细胞是MoMFs。
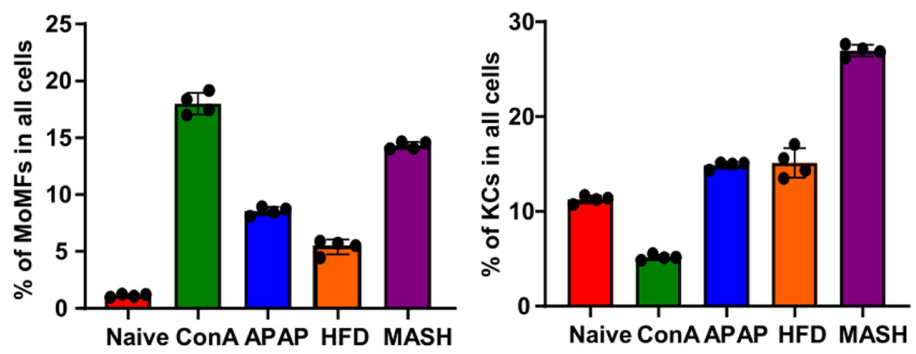
图2:该图展示了不同状态下MoMFs(左侧)和KCs(右侧)在肝脏中的占比
来源: 原文图3B
(2)功能分化:通过单细胞RNA测序,MoMFs被进一步分为多个亚群:
-
C1q⁺MoMFs:高表达Trem2、Spp1等基因,负责清除坏死细胞碎片。
-
Cd11c⁺MoMFs:分泌内皮素转化酶(ECE1),激活肝星状细胞收缩,促进坏死组织修复。
-
S100a8⁺MoMFs:位于坏死核心区,表达MMP9等蛋白,参与组织重塑。
02 巨噬细胞的“双重使命”:修复与炎症调控
(1)增殖能力:在受损肝脏中,MoMFs的增殖率(约12%)显著高于KCs(约6%),可确保有足够的“救援兵力”。
(2)区域特异性分布:在药物性肝损伤(APAP模型)中,坏死区域内的巨噬细胞有60%为MoMFs,而ConA模型中这一比例超过95%。这种差异反映了不同损伤机制下巨噬细胞募集的动态变化。
第三部分:健康vs疾病——巨噬细胞的“身份切换”
01 表型标记的差异
(1)健康肝脏:KCs通过IBA1⁺/CLEC4F⁺双阳性标记明确区分,而MoMFs则极少存在。
(2)病态肝脏:MoMFs呈现为IBA1⁺/CLEC4F⁻表型,并可根据CD86(促炎)、CD206(抗炎)等标志物进一步细分。慢性肝病中,部分MoMFs甚至能够转化成更接近KCs的表型(表达CLEC4F),这一现象提示了其表型的可塑性。
02 功能重编程
(1)吞噬能力:KCs在疾病中仍保持较高吞噬活性,而MoMFs则表现出相对较低的吞噬能力,转而通过分泌细胞因子(如IL-6、TNF-α)和蛋白酶(如MMP9)来调控组织修复过程。
(2)基因表达谱:scRNA-seq分析显示,MoMFs在损伤后高表达炎症相关基因(如Ccr2、Lyz),而KCs则高表达维持肝脏稳态相关基因(如C1q)。
03 空间定位的“战略意义”
(1)坏死边缘区:Trem2high C1q⁺MoMFs和Cd11c⁺MoMFs聚集于此,形成“修复屏障”。
(2)坏死核心区:S100a8⁺MoMFs主导,通过降解细胞外基质促进组织重建。(见图3)
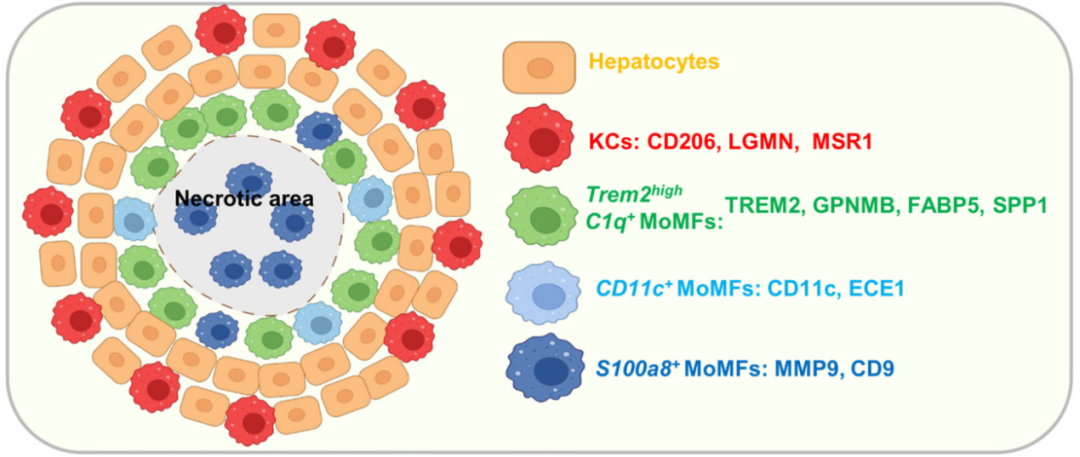
图3:该图清晰绘制了不同类型巨噬细胞在肝脏坏死区域中的空间分布
来源:原文图8C
第四部分:研究的突破与未来展望
01 技术突破:从“单细胞”到“空间定位”
(1)多重免疫荧光+AI分析:通过全片扫描和机器学习(如Ilastik、CellProfiler),首次实现肝脏巨噬细胞的数量、大小、增殖与凋亡的同步量化。
(2)空间转录组学:结合肝区标记(如GS、ECAD),揭示巨噬细胞功能与位置的精确关联。
02 临床启示:肝病治疗的新靶点
(1)靶向MoMFs亚群:例如,增强C1q⁺MoMFs的吞噬能力或抑制Cd11c⁺MoMFs的纤维化信号,可能成为治疗肝坏死或肝纤维化的新策略。
(2)慢性肝病的干预:在代谢相关性脂肪性肝炎中,通过抑制巨噬细胞向促炎表型转化,或可延缓疾病进展。
结语:巨噬细胞——肝脏健康的“多面手”
本研究不仅系统解释了肝脏巨噬细胞的动态图谱,更揭示了它们在微环境中的“自适应”调控能力。从健康状态的“静默守卫”到疾病状态的“活跃修复者”,巨噬细胞通过表型和功能上的灵活切换,维系着肝脏的平衡与再生。未来,针对巨噬细胞亚群的精准调控,或将为肝病治疗开启全新篇章。
引证本文
Dechun Feng, Yukun Guan, Yang Wang, Luca Maccioni, Bryan Mackowiak, Bin Gao - Characterisation of macrophages in healthy and diseased livers in mice: identification of necrotic lesion-associated macrophages: eGastroenterology 2025;3:e100189.
https://doi.org/10.1136/egastro-2025-100189
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)