首页 > 医疗资讯/ 正文
近期,美国学者Guardiola等在最新一期Clin Gastroenterol Hepatol杂志发表述评论文“结直肠冷圈套切除术:何时选择,何时避免,如何操作”。作者基于当前进展,就冷圈套器切除术在结直肠息肉治疗的适应症以及操作技巧进行了全面概述,本文翻译如下,以期对结肠镜医师有所帮助。
冷圈套切除术已经彻底改变了常规筛查、监测和诊断结肠镜检查中发现的绝大多数病变的切除实践。冷圈套器可有效切除所有≤10mm的结直肠病变和任何大小的无蒂锯齿状病变(SSLs)[1-5]。与电切除术比较,冷圈套切除术的一个关键优势是极大降低了延迟出血的风险,这一优势在使用抗血栓药物的患者和未使用血栓药物的患者随机试验中已得到证实[6-9]。冷圈套切除术的主要缺点是切除≥20mm侧向发育性病变(组织学为常规腺瘤)时复发率较高[10],并且在一些大的结直肠病变、纤维化病变和具有粗蒂较大病变,技术上不可行。在这篇文章中,我们首先回顾冷圈套器何时是首选切除方法,其次,我们讨论了可以考虑冷圈套切除术的病变,根据结肠镜检查者的首选方法、临床情况包括患者因素,例如耐受并发症的能力、患者返回进行随访的可能性,以及在部分情况下患者的偏好。第三,我们推荐不适合冷切除的情况(即应采用电切除术)。最后,我们详细描述了不同病变类型冷圈套器的最佳技术性能。
当冷圈套是首选的切除技术时。
表1列出了冷圈套器因其完全切除率高(达98%)和并发症率低(如延迟出血或穿孔(<1%)而成为首选切除技术的病变和情况,可以考虑冷圈套器但部分医生会使用电切除术的情况,以及首选电切除术的病变[1,9,11–13]。

一般来说,冷圈套器更适合病变较平坦且内镜下无或极低可察觉癌症风险(黏膜下浸润),当黏膜较薄且黏膜下纤维化较少时,冷圈套术更可行。考虑到这些病变的特征,其中冷圈套切除是最合适和可行的。很明显,当内镜怀疑癌症、体积大(通常>10mm,含Is成分)的无蒂或有蒂病变,以及有明显黏膜下纤维化时,冷圈套显然不太合适或为禁忌。
冷圈套适用于所有大小≤10mm的结直肠病变,无论其形状如何,包括≤10mm的有蒂病变[1]。对于有蒂病变,即刻出血(本文稍后讨论)可以很容易地控制,延迟出血罕见[14-15]。有趣的是,冷圈套器可用于直径11-15mm、蒂较细的有蒂病变,尽管这种做法需要进一步研究。当圈套技术上有困难时,冷活检钳除对1-3mm大小的病变有效[16]。但是,由于许多患者具有1-3mm和4-10mm的病变,因此,对所有10mm大小的病变进行冷圈套术可以降低成本、避免塑料浪费和碳排放[17]。观察性研究表明冷内镜黏膜切除术(EMR)和不注射的分片冷圈套切除术对包括≥20mm大小在内的息肉有效,在息肉切除术后立即进行活检残留息肉组织的比率为0.2%[2-3]。一些专家主张当SSL有内镜下异型增生证据时行热圈套切除术,但没有明确的证据表明在这种情况下需要电切除术[11]。总的来说,与相似大小的常规腺瘤比较,SSL的黏膜下纤维化最少,这有利于使用冷圈套器切除术。
可以考虑冷圈套切除术的病变
冷圈套切除术治疗11-19mm大小的常规腺瘤其有效性证据有限且混杂。在专家看来,冷圈套器分片切除加或不加黏膜下注射似乎对这种大小范围的病变有效,尽管一些证据表明冷EMR更优越[18-19]。
对于≥20mm的颗粒状侧向发育性病变(G-LSLs),尤其是均一型病变,冷EMR或许还有无黏膜下注射的冷圈套器分片切除可能是一种合适的方法。对于长径≥20mm无蒂常规腺瘤,冷圈套切除术可降低延迟出血的风险,但其代价是首次随访时复发的风险增加,且该风险随病变尺寸增大而增加[10]。然而,复发通常很小,并且可以使用各种内镜方法轻松治疗[20-21]。一些接受了EMR的患者并未回来进行随访[20]。表2列出了可能有利于≥20mm的无蒂常规腺瘤冷EMR的因素,例如是否愿意坚持监测结肠镜检查。由于冷切除术后的EMR缺损面不需要用止血夹闭合或缝合以防止延迟出血,因此,基于闭合设备的高成本,冷切除可能具有成本效益比[22]。无论病变大小或形状如何,冷切除术后很少需要或不适宜进行夹闭,尽管一些医生仍然担心冷切除术后的延迟出血。教育干预措施可以减少一些医生对夹子的不当使用[23]。

与G-LSL相比,非颗粒状侧向发育性病变(NG-LSL)发生黏膜下浸润性癌症和黏膜下纤维化的风险增加。然而,扁平隆起型NG-LSL具有相对较低的黏膜下浸润风险(4.2%),可能适合冷EMR(补充表1)。
G-LSL,颗粒状侧向发育病变;LSL,侧向发育病变;NG-LSL,非颗粒状侧向发育病变;SSL,无蒂锯齿状病变。
不应使用冷圈套切除术的病变(即需要电切除术)
冷圈套切除术不能像电圈套切除术那样深入切割黏膜下层[24-25]。因此,当根据内镜下病变评估怀疑黏膜下浸润时,不应使用冷圈套切除术。从表面凹陷和血管模式的角度来看,冷圈套切除术不适用于JNET(日本NBI专家小组)2b、NICE(窄带成像国际结肠直肠内窥镜)3或Kudo 5型[26-28]。在NICE 3或Kudo 5的情况下,外科手术切除可能是合适的,但是,当涉及的表面积较小,可以考虑内镜切除。从形态学的角度来讲,NG-LSL伴有假凹陷、大的无蒂病变,或侧向发育病变中有一个大的结节时,首选电切除术(补充图1),这些形态与黏膜下浸润风险增加相关(7.1%-15.1%)。这种病变应考虑整块切除,特别是如果位于直肠。补充表1确定可考虑进行冷切除的病变以及黏膜下侵犯的相关风险[29-31]。
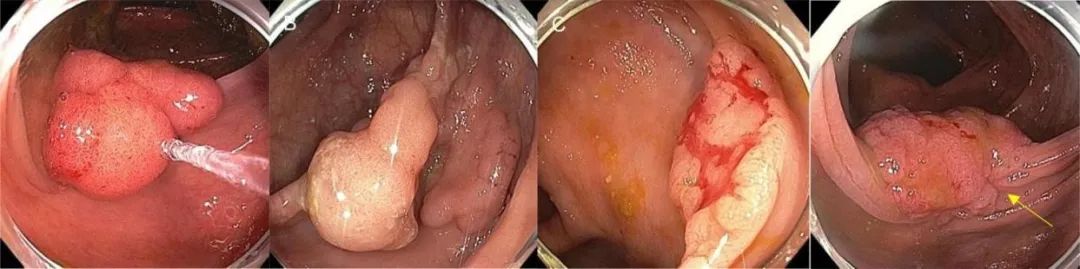
补充图1.首选电切除术的病灶,应避免使用冷切除术。(A) Paris Is病灶:“体积肥大”的病变性质致使冷切除变得困难。(B)Paris IIa病灶,并具有明显的Is成分。(C)具有中央凹陷的非颗粒性病灶:这是Paris IIa+IIc。任何有IIc成分的病变均应使用电切除术.(D)一个有明显的纤维化区域的较大息肉,纤维化来自既往的切除(黄色箭头),该区域致使冷切除变得困难。
对于许多Paris Is病变和其他具有大结节的病变,有必要行电切除术,这或是因为癌症风险增加,或是因为使用10mm的圈套器横切全部或部分病变不可行。因此,需要更大尺寸的圈套器来将圈套器定位在无蒂或结节部分上方和周围。此外,当存在广泛的黏膜下纤维化时,许多内镜医师更愿意采用电切除术,例如既往已部分切除的病变。
那些选用任一技术切除大息肉的医师应该积累一系列切除经验,他们应擅长光学诊断,以识别可能的黏膜下浸润区域,从而排除冷切除。他们必须在切除过程中表现出耐心,因为这可能是乏味的,尤其是对切缘和残余癌前组织的缺损基底部细致检查,并在内镜检查实践中提供足够的时间来进行高质量的切除。如果个人不确定最佳技术,如果有任何黏膜下浸润风险,或者如果他们不确定自己是否有能力进行完全切除,他们应该考虑转诊给内镜专家进行切除。
如何进行冷圈套切除术
冷圈套器切除术通常使用专用的冷圈套器进行,后者具有比常规圈套器更细、更硬的金属丝,并且通常允许更快的横切、更少的停滞,但术中即刻出血更常见。专用冷圈套器与常规冷圈套器的直接比较表明,两者在人体内具有同等功效[31-32]。DOPyS(息肉切除技能的直接观察)工具被开发用于评估内镜切除的能力[33]。DOPyS的缩写形式称为冷圈套息肉切除评估工具,专门用于评估冷圈套切除,最易应用于≤10mm病变的冷圈套切除[34]。
高质量冷圈套器切除术的关键要素是将病变旋转到内镜视野的5点或6点位置,保持与病变既不太近也不太远的最佳工作距离,以及准确放置圈套器。
几乎所有的内镜医师有时在没有旋转到5或6点钟位置的情况下切除可见的小息肉。当息肉面对结肠镜头端时,这种操作是最容易和最可行的(图1A–C)。如果切线位接近息肉(补充图2A),通过定位在5点或6点钟位置几乎总是有利于切除(补充图2B和C)。最佳切除的冷圈套器样本通常具有“煎蛋”外观,由切除的息肉(“蛋黄”)和周围平坦的正常黏膜(“蛋清”)形成(图2D)。最佳定位可能需要旋转结肠镜镜身(补充图3)。通常,旋转方向(顺时针或逆时针)应朝着需要最小旋转幅度以将病变调整至5点钟位置的方向。一个常见的错误是内镜头端要么移动到病变近端,要么在旋转过程中落在病变远端,这种错误是由于在旋转过程中看不到目标病变造成的,这可以通过“褶皱跟踪”来避免,褶皱追踪包括识别与息肉处于相同纵向水平的管腔中的褶皱或其他结构,并且在旋转过程中可以保持可见(补充图3)。褶皱追踪将始终使息肉在旋转完成时处于内镜视野中。
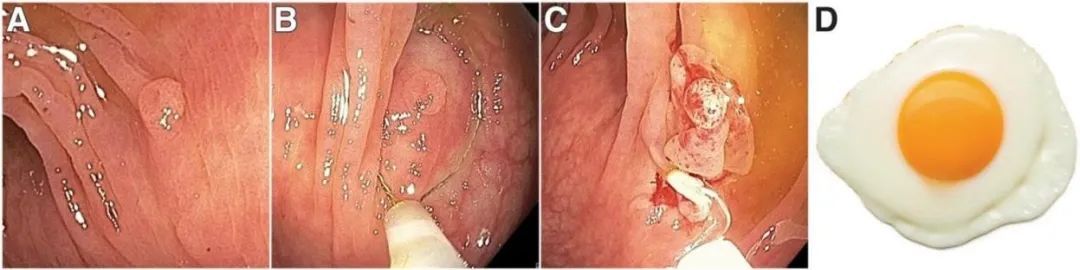
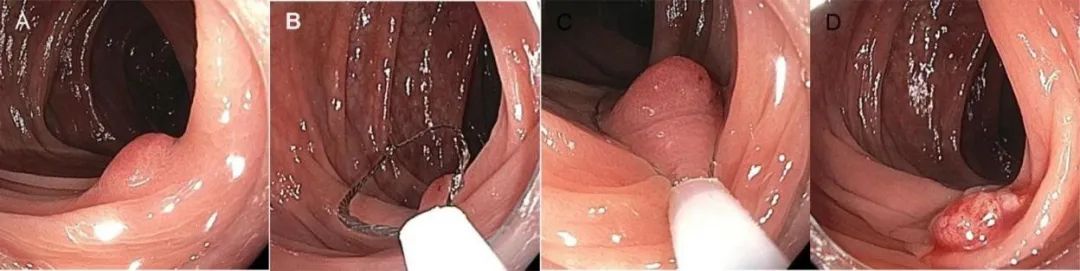
图1.冷圈套切除≤10mm息肉.(A)正面发现3mm管状腺瘤.(B)准确放置圈套器,并包括息肉周边正常黏膜组织. (C)切除的息肉呈“煎鸡蛋”外观.(D)煎蛋(图片由Oleksii Polishchuk拍摄)。
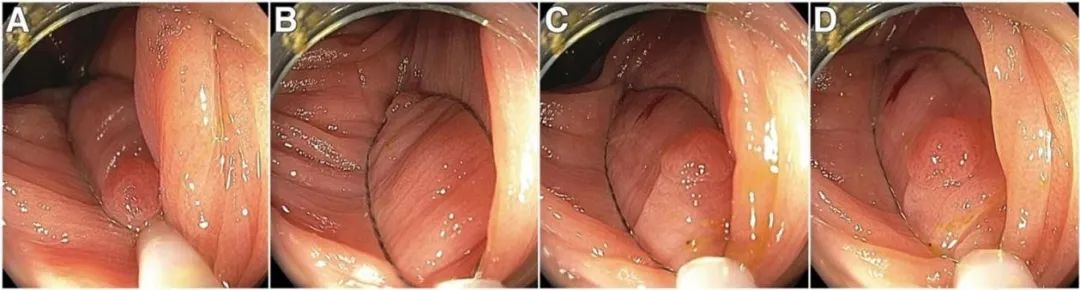
图2.圈套器及镜头的最佳定位是冷圈套器切除术成功的关键:圈套器位置.(A)圈套器外鞘管头端不要靠近病变,这是由于圈套器在闭合过程中,外鞘管头端可能会滑向病灶,从而致使无法完整切除周边黏膜组织,此外,圈套器也没有完全打开.(B)离结肠镜最远的圈套器边缘太靠近病灶. (C)圈套器的边缘太靠近病灶的侧边缘. (D)圈套器完全打开并准确定位,以获取周边正常黏膜组织。
补充图2.冷圈套切除≤10mm息肉:切除方向 (A)切线位发现一个6mm管状腺瘤.(B)圈套器在息肉上方打开。(C)圈套器下压并套取息肉周边正常粘膜组织.(D)切除的息肉。
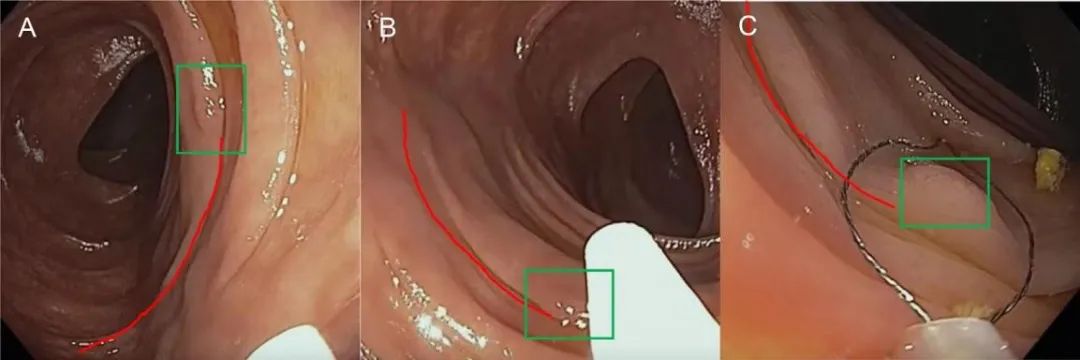
补充图3.圈套器和镜头的最佳定位是冷圈套器切除术成功的关键:皱襞追踪 (A)在褶皱(红线)的1点钟位置识别出一个微小息肉(绿框)。(B)聚焦在褶皱上,旋转内镜使息肉处于最佳位置. (C)息肉现在位于5点-6点钟之间,圈套器套取息肉及周边正常黏膜组织。
有效冷切除最关键的方面是,圈套器的位置应能抓住病变整个边缘周围的正常黏膜组织(图2),并且闭合的圈套器在圆周上没有一点真正接触到病变的边缘。一般来说,对于息肉≤10mm,“足够”可以认为是周边正常黏膜组织≥2mm,而对于需要分片切除的较大病变,“足够”通常是≥5mm[1,35]。5点或6点钟位置和最佳工作距离有助于这种放置。一般来说,应在结肠镜头端已经处于最佳工作距离的情况下,在息肉上方直接打开圈套器,这样圈套器就可以立即转向到准确的位置(补充图4)。如果结肠镜头端太靠近病变,就不能完全观察到病变,结肠镜必须回撤以允许准确放置圈套器和完全观察。如果结肠镜头端离病变太远,准确圈套放置变得更加困难。此外,结肠镜头端离病变越远,就越难以在圈套器头端施加足够的力来防止圈套器鞘管头端在圈套器闭合期间滑向病变。这是由于圈套器鞘管比结肠镜灵活得多,因此当圈套器向前推动并且结肠镜头端离病变太远时,圈套器会变形和弯曲。在每一次切除过程中,圈套器闭合前和闭合过程中应评估圈套器的准确位置(图1和图2;补充图2-4)。对于微小息肉,在转向或推动圈套器头端贴近结肠壁之前部分闭合圈套器,可以防止圈套不必要的套取大量正常黏膜组织。准确的结果还受到施加在圈套器头端的压力大小和圈套器闭合前结肠腔内充气量的影响。圈套器头端压力不足,或过度充气结肠壁过紧,可能导致圈套器和管鞘滑向息肉,无法抓住足够的周边正常黏膜组织。此外,抓取过多的正常黏膜组织,或结肠腔过度收缩,均会增加套取的粘膜下层的量,并导致圈套器在切除过程中被卡住或“停滞”。通过抓住息肉周围适量的正常黏膜组织并优化肠腔充气量,可以最大限度地减少圈套圈停顿。实现最小有周边正常黏膜组织边缘已被提出作为质量指标。然而,在实践中,由于处理过程中的破碎等问题,病理学家很难对此进行评估[36]。对于一些微小息肉,由于切片技术问题,腺瘤组织可能完全被遗漏[37]。
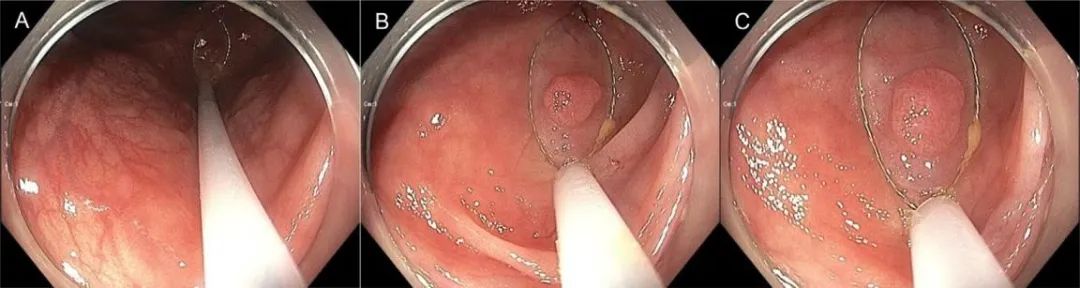
补充图4.圈套器和镜头的最佳定位是冷圈套器切除术成功的关键:镜头位置 (A)结肠镜头端离病灶太远,在这种距离上,圈套器外鞘管可能无法施加足够的锚定力量. (B)结肠镜头端较为靠近病灶,大概处于有效距离的上限. ( C)结肠镜距病变最佳的距离,圈套器头端外鞘管锚定的力量易于调整优化,更容易验证准确的圈套器放置。
如果发生圈套圈停顿,可以将圈套的组织拉至结肠镜头端,强力切割圈套的组织。必须避免过度用力。如果组织抵抗强力切割,最好是重新打开圈套器,将圈套的组织分片切除。圈套器停顿几乎总是会产生黏膜下组织形成的白色条索
。对这些条索活检很少发现残留息肉组织[38-39]。
黏膜下注射通常在电切除之前进行,提供缓冲保护下面的肌层免受损伤。考虑到冷圈套器并发症低,冷圈套器前黏膜下注射的潜在好处可能是勾画出病变的边界,并确保足够的深度,以保证完全切除,从而降低复发的风险。有多种黏膜下注射剂可供选择,从盐水与亚甲蓝的组合,到粘度增加的专有溶液,后者在切除过程中比盐水更有效[40]。冷切除具有更高的即刻出血风险,这已被确定为EMR术后复发的风险因素[41]。可以在注射液中加入肾上腺素以减少出血,但这会增加术后腹痛的发生率[42]。行黏膜下注射时,先将注射针头抵住病变,开始注射,然后将针头插入组织,以便液体进入黏膜下空间。或者,尽可能采用切线位的方法,将针头插入少许,然后抬起针头朝向肠腔内,随后在不同深度进行小剂量试验注射,直到黏膜下组织隆起。随着黏膜下空间的扩张,针头应朝向肠腔偏移。在初次注射后,随后的针头插入应该进入初次注射产生的黏膜下水垫[43]。关于注射是否能增加分片冷切除效果的数据有限。根据病理学标本的垂直边缘测量,注射可能会增加切除深度[44]。在该项研究中,考虑到在黏膜肌层完全切除方面冷EMR优于冷圈套器切除术,因此在切除大息肉时,有必要黏膜下注射以减少复发[44]。当切除6-15mm息肉时,无注射的冷圈套器分片切除术与冷EMR比较,结局(包括完全切除)无差异。但是,未有监测数据报道[18]。一项回顾性研究表明,水下冷EMR是有效的,并可为黏膜下注射的常规冷EMR提供替代方案。这项技术可以减少黏膜下注射对环境的影响或缩短手术时间。一个可能的限制是术中出血比传统冷EMR更模糊视野。需要进行前瞻性随机研究[45]。
特殊情况和冷圈套切除术
切除11-19mm病变
冷圈套需要使用直径通常限制在大约10mm的圈套器(可以使用更大的专用冷圈套,但是效率和安全性数据有限);因此,当切除11-19mm病变时,通常需要分片切除。黏膜下注射可能是有益的,但进一步的随机试验是必要的[18,46]。我们倾向于初始圈套器定位,以获取病变一侧的宽的黏膜边缘,并切除病变的一部分(图3;补充图5)。对于第二次切除,放置圈套器切除病变边缘以及第一次切除造成的黏膜下缺损。如果使用有对比性质的黏膜下注射,病变边缘和黏膜下层很容易识别(补充图6和7)。根据需要再次重复该过程,以宽黏膜边缘切除整个病变。除了评估切缘,还应密切评估缺损,以确保切除深度已达到所有区域的黏膜下层。保持完整的残留黏膜肌层(将黏膜与黏膜下层分开的肌层)表现为白色组织薄片(图4)。切除深度不足也可能是渗血的信号,这是因为切除黏膜比切除黏膜下层更容易出血。当确定后,有或无可见息肉组织的残留黏膜肌层应使用冷圈套器再次切除。如果存在纤维化,可能需要冷撕脱来移除该组织(图4B-D)。
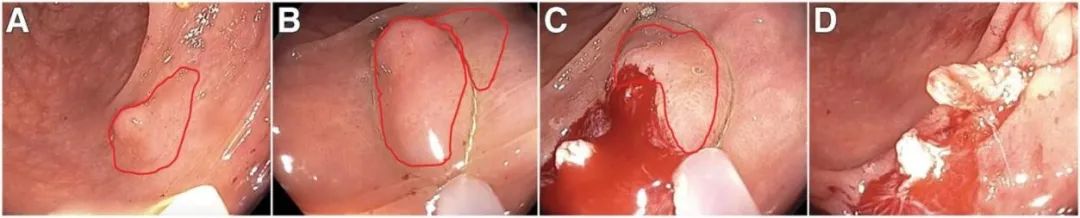
图3.冷圈套器切除>10mm息肉:无黏膜下注射的腺瘤切除 (A)14mm管状腺瘤,息肉组织用红线标出。(B,C)圈套器不要试图整体圈套组织并切除,而是应分成两块分片切除,从而具有足够的周边正常粘膜组织,注意图B和C中圈套器向下的压力朝向结肠壁,推动息肉进入圈套器,有助于确保足够深的横切面(即切面至粘膜下层)。(D)完全切除后的缺损面。
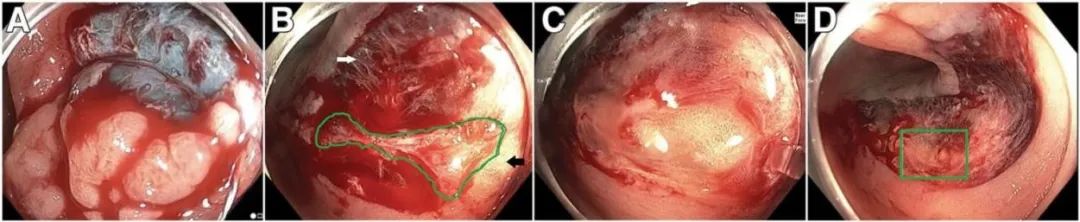
图4.足够的切除深度是冷圈套切除术成功的关键 (A)利用可对比的黏膜下注射液,组织切除并显示蓝色黏膜下层,粘膜下层纵横交错的白色纤维暴露在外,注意圈套器切除应重叠部分黏膜下缺损,下压圈套器使另一部分要切除的息肉进入圈套器进行切除,这种息肉进入圈套器的切除模式有助于确保下一次切除足够深(即切至黏膜下层). (B)在初次切除后,有一个完整的黏膜肌层覆盖在相对的纤维区域上,完整的黏膜肌在绿线内。黑色箭头指向黏膜下脂肪,白色箭头指向黏膜下纤维 (C)在冷撕脱去除黏膜肌后,可见黏膜下脂肪,表明切除平面已经降低至适当的平面。(D)冷圈套切除和冷撕脱后的整个缺损面,绿色矩形突出显示图B中完整的粘膜肌区域。
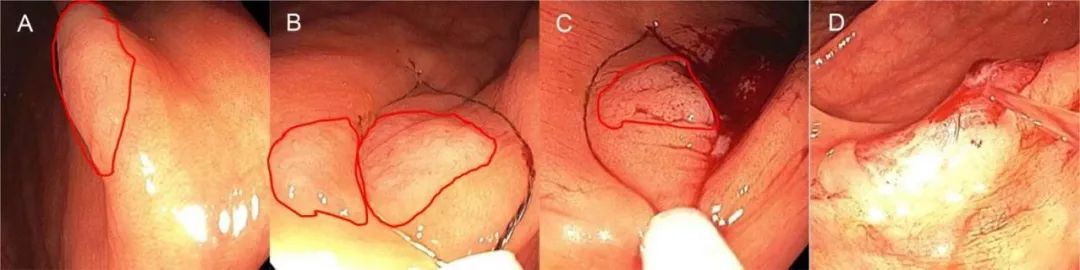
补充图5.冷圈套切除术>10mm息肉:无蒂锯齿状病变无黏膜下注射切除 (A)发现12mm的无蒂锯齿状病变,然后旋转至最佳位置 (B)初始圈套切除包括宽的周边正常黏膜边缘,以减少潜在的残留息肉,而不是整体圈套以实现整块切除 (C)以两个重叠部分分片切除病变,确保切除足够的周边正常黏膜边缘。(D)利用水流冲洗扩大切除术后缺损面,以评估是否完全切除。
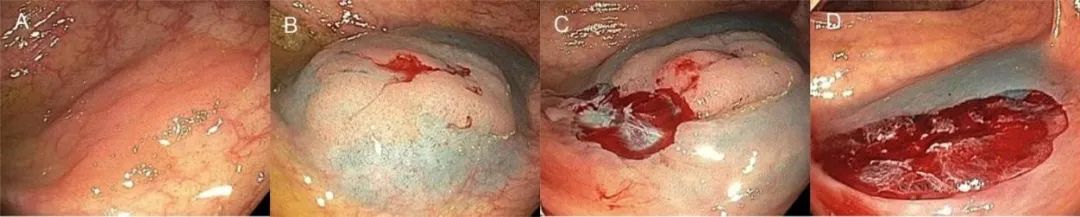
补充图6.冷圈套切除>10mm息肉:腺瘤有黏膜下注射的切除 (A)发现18mm管状腺瘤。(B)黏膜下注射后的息肉 (C)初始重点是圈套包括有正常黏膜边缘的息肉部分,并暴露黏膜下纤维 (D)完全切除后的缺损面。
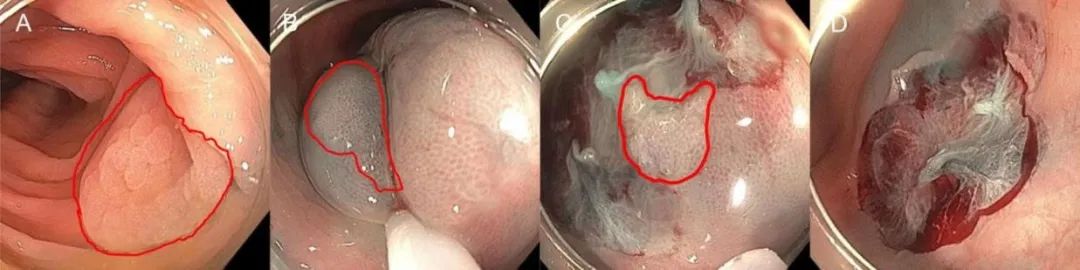
补充图7.冷圈套切除>10mm息肉:无蒂锯齿状病变有黏膜下注射的切除 (A)远端边缘发现一20mm无蒂锯齿状病变,息肉用红色标出 (B)病变黏膜下注射并行初始切除,施加压力并使息肉进入圈套器,并包括正常黏膜边缘 (C)对边缘进行仔细检查,发现拟被切除的锯齿状腺体 (D)可见有黏膜下纤维和兰色标记的完整缺损面。
在我们的实践中,对这种大小的息肉,尽管进行了分片切除,由于对切缘密切关注和重叠切除,因此,我们并未缩短监测间隔时间。由于在此大小范围内且具有任何癌前组织学的病变,均定义为进展期癌前病变,尽管进行了分片切除,我们仍建议3年时进行结肠镜随访。事实上,美国结肠直肠癌多学科特别工作组目前的建议是,分片切除≥20mm病变在6个月时监测[47]。
大的SSL切除
可使用冷EMR或不注射的冷分片切除≥20mmSSLs。具有黏膜下注射的冷EMR可提供病变边缘的极佳描绘(补充图7)。从定义上看冷EMR切除是分片的,切除可以从病变的口侧或肛侧或任一侧边缘开始。病变边缘应广泛切除,然后重复准确放置圈套器,系统覆盖病变边缘和扩张的黏膜下缺损。随着每次圈套器切除,圈套器应该足够有力地推入被注射的残留息肉中,迫使息肉组织向上套入圈套器当中(补充图7B)。每次圈套器闭合时切除的组织量应尽量均衡,以确保病变逐步切除,同时尽可能避免圈套器停滞。切除完成后,仔细检查整个边缘,以确保边缘处没有残留的锯齿腺体(补充图7C)。检查缺损的底部,以确保所有可见纤维都在黏膜下(补充图7D)。如果有任何完整的粘膜肌层,可以用冷圈套器再次切除该区域,以确保足够的深度。
切除冷切除术后复发
尽管存在黏膜下纤维组织增生,但可通过冷圈套切除术切除小的复发(≤10mm),尤其是在切除SSL术后复发。冷圈套切除微小病变应遵循基本规则,特别是预期周边有正常黏膜间隙时。尽管最初切除部位黏膜下存在疤痕组织,可以通过肠腔的进一步收缩,以便圈套器能抓住复发病变周边的正常黏膜组织。由于黏膜下存在疤痕组织,当冷圈套器切除复发病变时,更可能需要将病变拉到结肠镜头端并强力切割。
尽管有这些考虑,但复发通常用电切除术。直接位于疤痕上的非常平坦的复发病变,冷圈套经常会从疤痕组织上弹开,在这种情况下热切除非常有效。较大的复发,特别是体积较大者,我们首选热圈套切除术。如果复发部位于EMR疤痕上,这种圈套通常不用黏膜下注射[20,48]。电切除复发后,止血夹闭合黏膜下缺损可能有利。没有证据表明夹子闭合在这种情况下是否有帮助,但其基本原理是结肠壁层次可能由于最初切除的疤痕组织而被融合,这种疤痕可能会增加固有肌层热损伤的风险,并且在没有黏膜下注射的情况下,对肌层的损伤更难以评估。冷活检撕脱并辅助圈套器头端柔和电凝是处理复发和纤维化的替代方法,冷活检撕机械移除组织,然后用圈套器尖端对撕脱区域进行热处理。目前尚缺乏处理复发的各种方法直接比较的资料[20-21]。
冷圈套器的并发症
穿孔:
冷圈套切除术相关穿孔极为少见,一些研究报道穿孔率为0%[49]。冷圈套器穿孔的可能原因包括抓取太多黏膜组织、结肠充气不充分、“牵拉动作”。穿孔应按照其它文献描述的方法处理[50-52]。
预防即刻出血:
冷切除的另一个好处是显著减少了术后迟发出血。然而,不同程度的即刻出血是常见的,偶尔是快速的,甚至动脉出血[53]。在切除前收紧挤压组织几秒钟并减慢切除速度,可减少即刻出血。
活动性即刻出血的治疗:
对轻微渗血最简单的方法是不去管它,继续检查或切除。如果不确定渗血是否会停止,内镜医生可在1分钟后回到切除部位检查该部位。如果出现快速出血,可选择的处理方法包括用水泵将水压入黏膜下层以形成填塞,用结肠镜头端积极压迫缺损面,用圈套器抓住出血点周围的黏膜下组织,并用圈套器收紧挤压10-20秒,只在极少数情况下需要止血夹,通常仅需1枚止血夹夹在出血点可止血并防止进一步出血。
冷圈套切除术:我们将何去何从?
冷圈套切除术已确立为所有≤10mm结直肠息肉的主要切除方法。进一步的研究领域包括了解大小为11-19mm的腺瘤冷圈套切除术的有效性,并确定>10mm有蒂息肉使用冷圈套切除术的大小限制。近期欧洲指南提倡电切除10-19mm腺瘤性息肉[11]。黏膜下注射已被证明对于<10mm息肉并非必要[46]。但是它在腺瘤性息肉和>10mm的SSLs的冷切除术中应用是另一个未回答的问题。需要进行额外的研究来制定有效的冷切除培训计划,并定义大病变冷切除的质量评估。
有2项随机试验比较了冷EMR和热EMR治疗大小超过15mm的结肠息肉的效果,冷EMR的穿孔率和延迟出血率分别为0%和1.0-1.1%,而热EMR分别为1.1–3.9%和4.4–7.8%,冷EMR的技术成功率为92.2%-98.9%,而热EMR的技术成功率为97.5%-100%。冷EMR残留或复发息肉的发生率为18.4%-23.7%,而热EMR为1.1%-13.8%[35,54]。冷圈套切除术大的无蒂腺瘤复发率仍然较高-我们必须了解复发的原因以及如何预防。现在正在研究切缘热消融术,以了解在热切除术中减少复发的益处是否可以扩展到冷切除术当中。
正如这篇综述所强调的,冷圈套切除术的不良事件(包括迟发性出血)发生率极低,因此,目前的缺损闭合的标准(即电切除、位于脾曲以上近端结肠和≥20mm可能影响冷EMR切除决策)[55]。一旦病变达到40-50mm,闭合从技术层面而言将具有挑战性。因此,对于≥80mm且位于脾曲以上近端结肠的均一型G-LSL,冷EMR是一个需要考虑的因素,这是因为如果使用电切除,缺损面将太大而难以机械闭合。如果用夹子闭合在技术上有挑战性,缝合闭合有可能可行,但是一些病变太大,以至于用任何内镜工具闭合缺损都有挑战性。G-LSL是结肠中最大的侧向发育性病变,并且由于其发展为结肠直肠癌的倾向较低,通常会生长多年,直径非常宽。癌症的低风险和难以闭合的极大尺寸使得冷EMR具有吸引力,尽管冷圈套器的复发风险较高,而这通常可以通过常规内镜方法处理(补充图8和9)[20,21,54]。应该注意的是,冷圈套与像热圈套一样会产生疤痕,因此,如果病变是结肠环周或接近环周,冷或热切除后可能会形成狭窄,而这种狭窄的情况下复发可能更难以处理[56]。如果大小和形状表明术后缺损难以闭合或无法闭合,则应研究冷切除在G-LSL中的潜在应用。
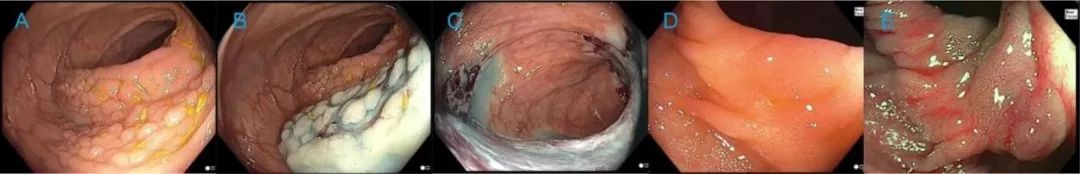
补充图8.冷内镜黏膜切除颗粒状侧向发育性病变,其大小会造成闭合困难: 初步治愈性切除 (A)150mm颗粒状侧向发育性病变,范围延伸多个皱襞,约占结肠环周50% (B)行黏膜下注射。(C)完全切除术后缺损面,可见粘膜下纤维,病理为管状腺瘤。(D)初次治疗术后6个月白光下疤痕 (E)初次治疗术后6个月NBI下疤痕。瘢痕活检结果为正常黏膜。
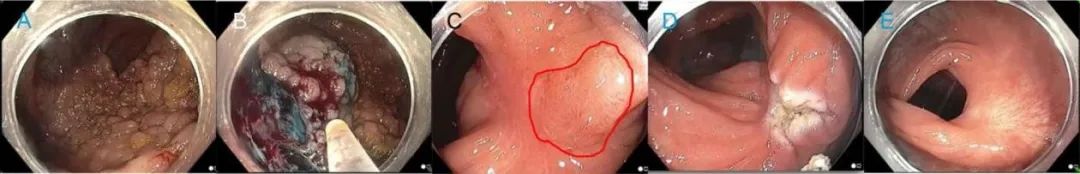
补充图9.冷内镜黏膜切除颗粒状侧向发育性病变,其大小会造成闭合困难: 处理复发 (A)冷内镜黏膜切除140mm颗粒状侧向发育性病变,病灶位于肝曲与升结肠并延伸多个皱襞 (B)息肉切除,病理为管状绒毛腺瘤。(C)初次治疗术后六个月,注意到有狭窄,并发现复发(用红色标出) (D)电凝切除复发病灶. (E)初次治疗术后12个月,发现疤痕,无腺瘤残留。
结论:
冷圈套切除术目前是各种结直肠病变的首选方法。由于延迟并发症的降低,在有或无黏膜下注射情况下其使用正扩展到更大的病变。冷圈套切除术不适用于有任何黏膜下浸润性风险的病变,对于体积大或有黏膜下纤维化的病变也不适合。强调正确的方法是有效应用冷圈套切除的关键。
文献来源
Guardiola JJ, Anderson JC, Kaltenbach T, et al. Cold Snare Rep in the Colorectum: When to Choose it, When to Avoid it, and How to Do it. Clin Gastroenterol Hepatol. 2025;23(4):507-515.e6. doi:10.1016/j.cgh.2024.08.030
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)