首页 > 医疗资讯/ 正文
肿瘤微环境主要将肿瘤相关巨噬细胞(TAMs)极化为M2样表型,从而抑制抗肿瘤免疫反应。这一过程实质上受代谢重编程的影响;然而,通过代谢重塑对TAM进行再教育以增强其抗肿瘤能力仍然是一个挑战。
2025年4月9日,华中科技大学唐科、黄波共同通讯在Science Translational Medicine在线发表题为“Succinate-loaded tumor cell–derived microparticles reprogram tumor-associated macrophage metabolism”的研究论文,该研究表明负载琥珀酸的肿瘤衍生微粒(SMPs)可以重塑TAMs的代谢状态。
SMPs通过蛋白琥珀酰化依赖的方式增强糖酵解和减弱三羧酸(TCA)循环,促进巨噬细胞经典的M1样极化。从机理上讲,琥珀酸通过SMPs被递送到线粒体和细胞核中,导致乳酸脱氢酶A (Ldha)启动子区域内异柠檬酸脱氢酶2 (IDH2)和组蛋白H3K122的琥珀酰化。该发现提供了一种使用细胞膜衍生的载有内源性代谢物的微粒进行TAM极化的独特方法,这种平台可以更广泛地用于基于翻译后修饰的肿瘤免疫治疗。

巨噬细胞是抗肿瘤免疫反应的重要组成部分,尤其是在肿瘤发展的早期阶段。然而,肿瘤浸润性巨噬细胞很容易被培养成肿瘤促进型,称为肿瘤相关巨噬细胞(TAMs),它与经典的M2极化亚群相似,表现出抗肿瘤功能的丧失,并抑制肿瘤进展的T细胞活化。肿瘤微环境中导致TAM极化的许多因素已经得到阐明,包括缺氧、白细胞介素-4 (IL-4)、血管内皮生长因子(VEGF)、乳酸盐、犬尿氨酸等,所有这些因素都在基于巨噬细胞的肿瘤免疫治疗策略中设置了障碍。
代谢重组是肿瘤微环境中巨噬细胞极化的主要驱动力。例如,代谢模式的改变可能会深刻影响腺苷5′-三磷酸(ATP)的产生,也可能会影响巨噬细胞中各种生物过程所需的糖或脂质相关中间体的浓度。此外,小分子代谢物通常与蛋白质或核酸结合,并调节酶活性或表观遗传修饰。糖酵解是M1极化的巨噬细胞产生NADH(还原型烟酰胺腺嘌呤二核苷酸(NAD))的主要途径,与M2型的三羧酸(TCA)循环形成对比。除了提供能量,来自肿瘤细胞或巨噬细胞的糖酵解来源的乳酸盐与促进M2型极化有关。类似地,TCA衍生的琥珀酸在脂多糖(LPS)激活的巨噬细胞中积累,可以影响巨噬细胞的极化。这种效应依赖于活性氧的产生和缺氧诱导因子-1α(HIF-1α)的稳定。最近,已经证明肿瘤细胞分泌的细胞外琥珀酸盐与琥珀酸盐受体1 (SUCNR1)结合,并通过磷酸肌醇3-激酶(PI3K)-AKT信号传导促进M2巨噬细胞极化。这些发现表明,细胞外和细胞内的代谢中间产物的位置可能导致明显不同的结果。
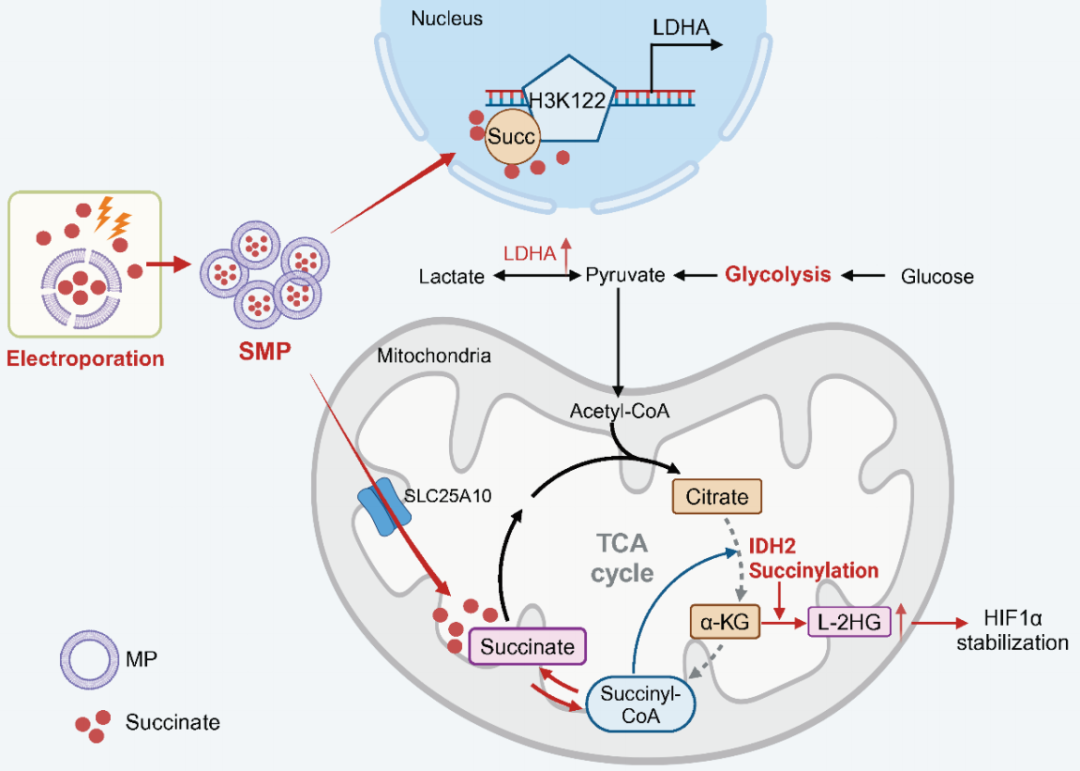
SMPs重塑TAMs抗肿瘤活性(图源自Science Translational Medicine)
这些观察表明,TAMs的代谢重编程可能有利于肿瘤治疗。然而,许多小的化学化合物或功能抗体已经在临床试验中进行了测试,但没有达到预期。因此,应开发替代疗法,尤其是那些针对TAMs代谢调节的疗法。由于琥珀酸对巨噬细胞的影响,解决方案可能是将琥珀酸直接递送到巨噬细胞的细胞内空间中,以避免SUCNR1结合。但细胞膜作为亲水性化合物,阻止了琥珀酸的穿越。
在这里,研究人员改造了MPs,使其携带高浓度的琥珀酸盐,这种琥珀酸盐在体内和体外都将TAMs极化为M1样类型,从而降低了小鼠的肿瘤负荷。负载琥珀酸的SMPs通过促进线粒体异柠檬酸脱氢酶 2(IDH2)的琥珀酰化并抑制其活性和TCA通量来逆转TAM极化。SMPs还诱导组蛋白H3K122 (H3K122succ)在乳酸脱氢酶A (Ldha)启动子区域的琥珀酰化,导致糖酵解和M1极化增强。总的来说,这些数据表明SMPs可以使TAMs复极为M1样表型,从而增强抗肿瘤免疫。
参考信息:
https://www.science.org/doi/10.1126/scitranslmed.adr4458#tab-contributors
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)