首页 > 医疗资讯/ 正文
-01-
导读
GPCR(G Protein-Coupled Receptor),即G蛋白偶联受体,是哺乳动物基因组中最大的膜蛋白家族,广泛分布于中枢神经系统、免疫系统、心血管、视网膜等器官和组织,参与机体的发育和正常的功能行使。而如果与其相关的细胞内通路调节发生异常,或者外源病原物以之为受体攻击机体细胞,则会导致一系列疾病的发生。因此,GPCR被视为重要的药物开发靶点,GPCR的药物研发具有非常重要的价值。
-02-
GPCR简介
G蛋白偶联受体(GPCR)是真核生物中最大的膜蛋白家族,具有七次跨膜α螺旋结构。其N端和三个胞外环参与配体结合,而C端和胞内环(尤其是第三个环)介导下游信号传导。GPCR通过两种主要途径传递信号:一是依赖G蛋白(如Gs、Gi/o、Gq/11等),激活后产生第二信使(如cAMP、Ca²⁺);二是非依赖途径(如β-arrestin介导的Src/激酶活化)。
针对GPCR超家族的成员,有多种不同的分类方法,比较流行的有两种:一是A-F分类系统,面向所有生物体内的GPCR蛋白;另一种是根据序列相似性和功能相似性,将GPCR分为Glutamate, Rhodopsin, Adhesion, Frizzled/Taste2, Secretin等5类(缩写为GRAFS),绝大部分人源GPCR可被归类其中。
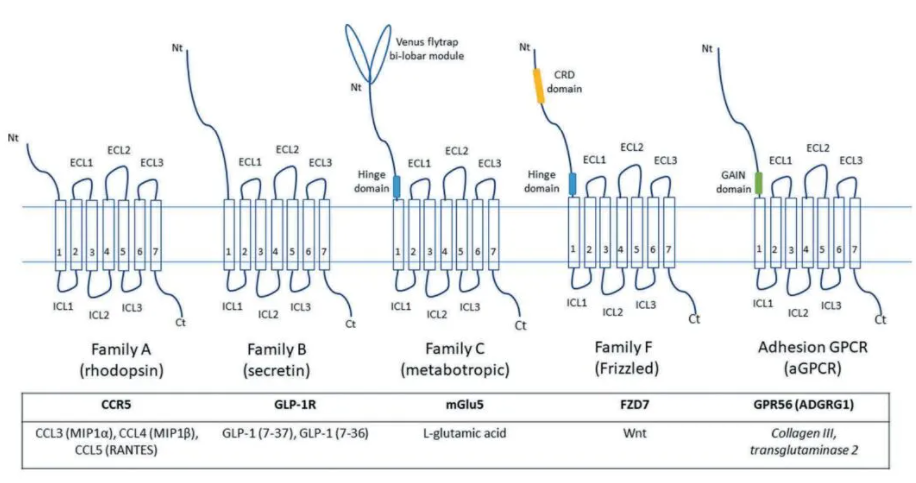
Rhodopsin家族(Class A):最大类别,N端较短,配体直接结合跨膜区或通过胞外环间接作用,包括胺类(如多巴胺、组胺受体)、多肽类(如内皮素受体)等。该家族可被进一步分为α、β、γ和δ亚类。α亚类的成员包含多种重要的胺类和小分子化合物的受体,包括组胺受体、多巴胺受体、大麻素受体等。β亚类包含多种多肽受体,如内皮素受体、催产素受体等。γ亚类中较受关注的一类受体是趋化因子受体家族,其他的成员包括一些趋化素受体、神经肽受体等。δ亚类包括一些糖蛋白受体和嗅觉相关的受体等。总体来讲,Rhodopsin受体家族成员比较复杂,很难基于结构、功能、表达分布等单一特点进行分类。
Secretin家族(Class B1):胞外区域较大,成员为多肽激素受体(如分泌素受体)。
Adhesion家族(Class B2):结构与Class B1类似,但多数成员的天然配体尚未明确。
Glutamate家族(Class C):具有较大的N端二聚体结构,成员包括代谢型谷氨酸受体、GABA受体、钙敏感受体及味觉受体(如甜/鲜味受体TAS1R)。
Frizzled/Taste2家族(Class F):分为两个亚类,Frizzled/Smoothened:结合Wnt蛋白或通过Hedgehog通路传递信号;Taste2:苦味受体及一些孤儿受体。
GPCR激活后通过构象变化(如磷酸化)招募β-arrestin,调控受体内吞或信号终止。此外,GPCR的亚细胞定位(如核膜)可影响其信号特异性。药物开发中,约370个GPCR为潜在靶点,现有药物以调节G蛋白或β-arrestin通路为主。
-03-
GPCR的信号通路
G蛋白偶联受体(GPCR)是人体最大的跨膜受体家族,通过感知光、激素、神经递质等信号,调控约80%的生理过程。其信号传递具有高度动态性和复杂性,核心路径可分为G蛋白依赖性通路和β-arrestin依赖性通路,同时受多种调控机制影响。
G蛋白依赖性通路
GPCR通过与G蛋白相互作用来传递信号。G蛋白是由三个亚基组成的异源三聚体:Gα、Gβ和Gγ。当GPCR被配体激活时,会发生构象变化,促使G蛋白α亚基的GDP被GTP取代,进而激活与其偶联的G蛋白。
Gs型:激活腺苷酸环化酶(AC),升高cAMP水平,激活PKA(如肾上腺素受体调控代谢)。
Gi/o型:抑制AC,降低cAMP水平(如阿片受体介导镇痛)。
Gq/11型:激活磷脂酶Cβ(PLCβ),水解PIP₂生成IP₃和DAG,分别触发钙离子释放和PKC活化(如血管紧张素受体调控血压)。
G12/13型:激活RhoGEF,调控细胞骨架重塑(如趋化因子受体驱动细胞迁移)。
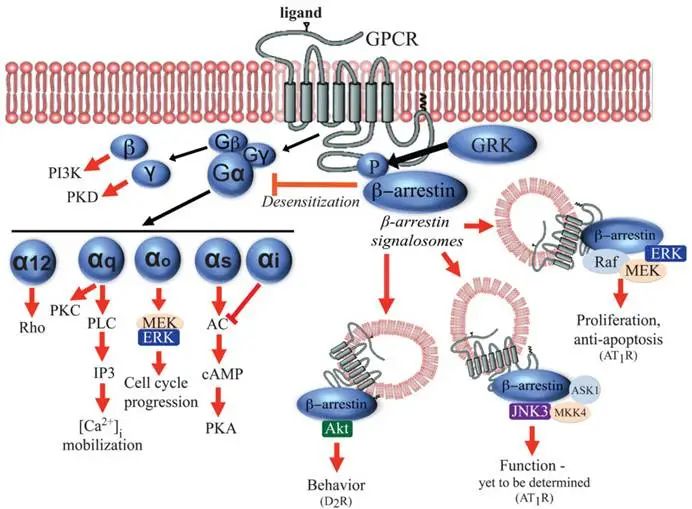
β-arrestin依赖性通路
β-arrestin是GPCR信号通路中的重要调节因子,GPCR被G蛋白偶联受体激酶(GRK)磷酸化后,招募β-arrestin结合,介导受体内吞和脱敏,终止G蛋白信号。此外,还激活非经典通路如ERK、JNK激酶级联反应(如CXCR4受体促进肿瘤转移)以及与AP2等衔接蛋白结合,调控膜运输和信号复合物组装。
-04-
GPCR与疾病的关系
GPCR家族在人体内分布广泛,功能复杂,因此与多种疾病的发生和进展过程有所关联,或在其中扮演重要的角色。根据截止到目前的较为清楚的研究,GPCR涉及到的疾病主要分为3大类:癌症、炎症和心血管/代谢疾病。
GPCR与癌症
研究表明,GPCR家族的多种成员参与了各类癌症的发生和进展。激素受体类的GPCR参与了某些激素依赖的癌症。有些蛋白酶激活受体如PAR1,在MMP-1的催化下活化并激活下游信号通路,促进癌细胞的侵袭和恶化。有些趋化因子受体,如CXCR2、CXCR4,在骨髓瘤、淋巴瘤细胞中高表达,也可能高表达在如胰腺癌等实体瘤细胞上,参与细胞的迁移、血管生成等。
GPCR与炎症
趋化因子受体家族主要表达在免疫系统各类细胞上,炎症反应就是由免疫细胞上的趋化因子受体受趋化因子激活后介导免疫细胞发挥宿主免疫功能而产生的一类病理现象。如CXCR1、CXCR2主要表达于中性粒细胞上,当机体某处发生感染或出现损伤时,中性粒细胞会在相应趋化因子(CXCL1、CXCL2、CXCL8)的趋化下向病灶迁移,到达病灶后释放炎症因子,从而产生局部的炎症反应。
GPCR与心血管/代谢疾病
与心血管疾病相关的GPCR成员主要分布于ClassA家族的α亚类,如血管紧张素系统(RAAS)中的AT1R、AT2R以及Mas-R。AT1R受体激活引起血管收缩,细胞增殖迁移、炎症纤维化、心肌再塑和肥厚、钠水潴留和ROS生成等等;而Mas受体激活主导血管舒张、抑制细胞增殖迁移、抗炎症纤维化、抗凝、促EDRF、NO生成、抑制心肌肥厚和生长等等,两者具有相互拮抗的作用,共同维持人体的自稳态。
与代谢疾病相关的GPCR成员主要是分布于ClassA家族中的脂肪酸受体,比如GPR120、GPR41和GPR43等,以及ClassB家族中的Secretin受体家族,包括GLP-1R和GCGR等。胰高血糖素样肽1(GLP-1)通过激活GLP-1R,提高胰岛β细胞的胰岛素分泌水平,从而控制血糖;胰高血糖素(GCG)通过与其受体GCGR结合而被激活,增强肝糖原降解,并调节葡萄糖的从头合成途径,抵抗胰岛素的降血糖作用,从而升高血糖。
除了这3类疾病主要的疾病之外,还有其他疾病被证明与GPCR相关,如:CCR5参与HIV向T细胞的入侵,是治疗艾滋病的一个重要靶点;如降钙素相关基因肽受体CGRPR和其配体CGRP表达于三叉神经元区域,两者的相互作用所激活的下游信号通路被证明与偏头痛相关。
-05-
GPCR药物开发现状
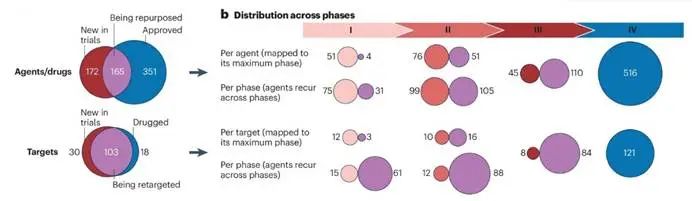
目前在北美(美国和加拿大)、欧洲、亚洲(日本、韩国和印度)和澳大利亚的市场上共有516种针对GPCR的不同药物在销售。这些GPCR靶向药物占所有批准药物的约36%。在过去的5年里(自2019年以来),有37种针对GPCR的药物获得了新的批准,其中包括7种首次批准的受体:GIPR、GPRC5D、C5A1、神经激肽-3(NK3)和黑皮质素受体3、4和5(MC3/4/5)。最近批准的是KarXT(Cobenfy),这是一种由M1/M4毒蕈碱乙酰胆碱受体选择性激动剂xanomeline和外周毒蕈碱拮抗剂曲司皮铵联合使用的药物,是精神分裂症的治疗药物。
目前共有337种靶向GPCR的药物正在临床试验中,其中172种是新药,165种是正在重新利用的药物。在新的药物中,有51、76和45种分别进入了I、II和III期临床。因此,预计未来几年将有相当多的GPCR药物获得批准。
2023年前50大畅销药物中有5种GPCR靶向产品。其中,产品Entresto(sacubitril/缬沙坦)应用于心力衰竭和高血压。其他四种产品分布在代谢疾病领域的适应症:包括2型糖尿病(semaglutide、dulaglutide和tirzepatide)和肥胖症(semagluide)。tirzepatide也于2023年11月被批准用于治疗肥胖症。
目前只有两种批准的GPCR靶向单克隆抗体,分别是靶向CCR4和CGRP1型受体的mogamulizumab和erenumab。另一种单克隆抗体正处于临床开发的后期阶段,即针对CCR5的leronlimab(或PRO140),现已达到预注册。目前还有多个GPCR的单克隆抗体处于临床1期或2期的开发阶段。值得注意的是,所有这些靶点都有大的肽配体。
-06-
GPCR药物的未来发展趋势
GPCR药物开发近年来呈现多维度创新趋势,但仍面临结构生物学限制和选择性挑战。以下是核心进展与方向:
结构生物学驱动药物发现
过去5年上市的GPCR药物均基于已解析的受体结构开发,凸显结构信息的关键作用。随着X射线晶体学和冷冻电镜技术进步,变构位点的发现为药物设计开辟新路径,例如靶向受体-脂膜界面变构位点的小分子可克服传统正构药物选择性不足的问题。目前已有18种GPCR与变构分子的共晶结构被解析,为精准设计提供模板。
从正构位点到变构调控的范式转变
约95%已上市GPCR药物靶向正构位点,但该区域在同类受体中高度保守,导致药物交叉激活引发毒副作用。变构调节剂通过结合受体跨膜区或脂膜界面等非保守区域,实现亚型特异性调控。例如,钙感知受体(CaSR)变构调节剂cinacalcet通过“天花板效应”限制药效峰值,显著提高安全性。此外,变构位点不与内源配体竞争,可保留天然信号时空特性,适用于需精细调节的疾病(如神经系统疾病)。
GPCR抗体的崛起
抗体药物凭借长半衰期、高选择性和外周分布特性,成为小分子的重要补充。例如,针对外周表达的GPCR开发抗体可规避血脑屏障,减少中枢副作用。目前已有2款GPCR抗体药物上市,临床阶段项目数量显著增加。
靶向受体复合物的新维度
GPCR常与受体相关蛋白形成功能复合物,其信号特性与单体受体不同。例如,多巴胺D2受体与腺苷A2A受体异源二聚化可改变配体响应,为帕金森病治疗提供新靶点。此类复合物的组织特异性表达(如特定细胞类型中GPCR与辅助蛋白的共定位)使药物可精准调节病理信号通路,减少脱靶效应。
此外,开发偏向性配体以调控特定信号通路、利用AI预测变构位点结合模式、探索孤儿GPCR的变构成药潜力。这些突破将推动GPCR药物向更高选择性和更低毒性的方向发展。
-07-
结语
GPCR药物开发的历史,是一部人类解码生命信号、攻克疾病的壮丽史诗。从阿司匹林抗炎止痛的偶然发现,到GLP-1受体激动剂改写糖尿病治疗格局,再到靶向CGRP受体单抗开创偏头痛预防新时代,GPCR药物始终站在医学革命的前沿。
目前,针对GPCR的治疗性药物的研发管线和临床试验正在不断扩大。近年来,随着我们对GPCR生物学方面的不断深入研究,可以预见,GPCR作为生命科学的“百年常青树”,将持续解锁细胞信号调控的终极密码。当科学与技术跨越学科的藩篱,人类终将实现从“调控疾病”到“重塑健康”的终极梦想。
参考文献:
1. A review of antibody-based therapeutics targeting G protein-coupled receptors: an update. Catherine J Hutchings. Expert Opin Biol Ther. 2020 Aug;20(8):925-935.
2. Targeting receptor complexes: a new dimension in drug discovery.Nat Rev Drug Discov. 2020 Nov 11.
3. New Binding Sites, New Opportunities for GPCR DrugDiscovery. Trends Biochem Sci. 2019 Apr;44(4):312-330.
4. GPCR drug discovery: new agents, targets and indications. Nat Rev Drug Discov.2025 Mar 3.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)