首页 > 医疗资讯/ 正文
[摘要] 背景与目的:甲状腺功能异常在乳腺癌术后放疗患者的长期随访中较为常见。本研究旨在结合血清学甲状腺功能指标的检查结果,比较乳腺癌术后患者在放疗前后甲状腺转录因子-1(thyroid transcription factor-1,TTF-1)和配对盒转录因子8(paired box 8,PAX-8)血清水平的变化,分析两种甲状腺转录因子血清水平的变化与乳腺癌术后放疗后出现甲状腺功能异常的相关性。方法:前瞻性选取上海交通大学医学院附属第九人民医院黄浦分院放疗科2022年1月—2022年6月收治的无甲状腺疾病史且在乳腺癌术后接受放疗的女性患者,按照有无锁骨上区放疗野分成两组。所有患者入组前均被完整告知研究内容,并签署知情同意书。本研究设计通过了上海交通大学医学院附属第九人民医院黄浦分院伦理委员会的伦理审查(审批号:伦审2021-KY-2)。分别记录入组患者放疗前、放疗结束时、放疗结束后6、12和24个月两种甲状腺转录因子(TTF-1、PAX-8)的血清水平、血清甲状腺功能指标的检查结果,包括三碘甲状腺原氨酸(triiodothyronine,T3)、四碘甲状腺原氨酸(tetraiodothyronine,T4)、游离三碘甲状腺原氨酸(free triiodothyronine,FT3)、游离四碘甲状腺原氨酸(free tetraiodothyronine,FT4)、促甲状腺激素(thyroid stimulating hormone,TSH)、甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPO-Ab)。本研究严格遵循《加强流行病学中观察性研究报告质量》指南中的各项条目。结果:共80例患者入组(每组各40例)。两组患者中有19例发生甲状腺功能减退,其中锁骨上区野放疗组15例,无锁骨上区野放疗组4例(P=0.004)。两组患者放疗前血清TTF-1[5.70(5.11,7.13) vs 6.68(5.15,7.57),P=0.296]、PAX-8(5.26±1.01 vs 5.66±1.37,P=0.149)水平差异无统计学意义。其中锁骨上区野放疗组患者TTF-1、PAX-8的血清检测值在放疗结束后的12个月内逐渐升高;而无锁骨上区野放疗组TTF-1、PAX-8的血清水平在放疗结束后的24个月内无明显变化。两组患者的TTF-1的血清检测值在放疗结束后6个月[6.99(4.73,13.94) vs 5.79(5.01,6.28),P=0.049]、12个月[7.65(5.02, 17.85) vs 5.43(4.52,6.22),P=0.005]的差异均有统计学意义;PAX-8的血清检测值在放疗后12个月[6.79(4.86, 14.30) vs 5.81(4.70,7.25),P=0.042]的差异有统计学意义。以锁骨上区野放疗组TTF-1以及PAX-8均明显升高的放疗结束后12个月的检测值中位数作为参考数值,将检测值超过平均值的患者定义为甲状腺转录因子升高亚组,低于平均值定义为甲状腺转录因子正常亚组,比较两个亚组中甲状腺功能减退发生情况的差异,并分析锁骨上区野放疗组患者TTF-1/PAX-8升高与甲状腺功能减退发生的相关性,结果显示升高亚组的甲状腺功能减退发生率明显高于正常亚组(分别为65.0% vs 10.0%、60.0% vs 15%,P=0.001、P=0.008)。多因素分析结果显示乳腺癌术后锁骨上区野放疗结束后12个月的TTF-1/PAX-8升高与甲状腺功能减退的发生呈正相关(OR=9.702、OR=3.930,P=0.020、P=0.046)。结论:乳腺癌术后放疗引起的甲状腺功能异常主要表现为甲状腺功能减退;乳腺癌术后锁骨上区野放疗显著增加患者甲状腺功能减退的发生率;而在乳腺癌术后锁骨上区野放疗后甲状腺功能减退的患者中,甲状腺转录因子TTF-1和PAX-8的血清水平显著增高。
[关键词] 乳腺癌;放疗;锁骨上区放疗野;甲状腺转录因子;甲状腺功能异常
[Abstract] Background and purpose: Thyroid dysfunction can frequently be discovered in breast cancer patients during long-term follow-up after receiving post-operative radiation therapy (PORT). This study aimed to compare serum levels of thyroid transcription factors (TTFs) TTF-1 and paired box 8 (PAX-8) before and after PORT in breast cancer patients, combined with the results of serological thyroid indicators tests, and to analyze the relationship between the changes in serum levels of these two kinds of TTFs and thyroid dysfunction after breast cancer PORT. Methods: Female breast cancer patients without thyroid disease records who received PORT in Department of Radiation Oncology, Shanghai Ninth People’s Hospital Huangpu Branch, Shanghai Jiao Tong University School of Medicine from Jan. 2022 to Jun. 2022 were prospectively selected, and were divided into two groups according to being with or without supraclavicular radiation field. All the patients had given informed consent before joining the study. The study design was approved by the ethic committee of our hospital (Ethic Approval No. 2021-KY-2). Serum levels of TTF-1 and PAX-8, serological thyroid indicators [triiodothyronine (T3), tetraiodothyronine (T4), free triiodothyronine (FT3), free tetraiodothyronine (FT4), thyroid stimulating hormone (TSH) and thyroid peroxidase antibody (TPO-Ab)] were recorded before PORT, at the end of PORT, 6, 12 and 24 months after the end of PORT, respectively. The Strengthening the Reporting of Observational Studies in Epidemiology (STROBE) checklist was followed for this study. Results: Eighty patients were enrolled in this study (40 in each group). A total of 19 patients who had hypothyroidism were divided in two groups, 15 in supraclavicular field group (SC group) and 4 in non-supraclavicular field group (NSC group), respectively (P=0.004). Levels of TTF-1[5.70 (5.11, 7.13) vs 6.68 (5.15, 7.57), P=0.296] and PAX-8 (5.26±1.01 vs 5.66±1.37, P=0.149) did not show statistically significant deference between two groups before PORT. In SC group, levels of TTF-1 and PAX-8 gradually rose in 12 months after the end of PORT. In NCS group, levels of TTF-1 and PAX-8 did not change significantly during 24 months after the end of PORT. Test results of serum TTF-1 between two groups were statistically different at 6 months [6.99 (4.73, 13.94) vs 5.79 (5.01, 6.28), P=0.049], 12 months [7.65 (5.02, 17.85) vs 5.43 (4.52, 6.22), P=0.005] after the end of PORT, while test results of serum PAX-8 between two groups were statistically different at 12 months [6.79 (4.86, 14.30) vs 5.81 (4.70,7.25), P=0.042] after the end of PORT. The median values of TTF-1 and PAX-8 test results at 12 months after the end of PORT in SC group which were both significantly higher compared with NSC group were selected as the referent thresholds. Patients in SC group whose test results were higher than referent thresholds were defined as TTF-1/PAX-8 elevating subgroups, and patients whose test results under the threshold defined as TTF-1/PAX-8 normal subgroups. The incidences of hypothyroidism were higher in elevation subgroups than in normal subgroups (65.0% vs 10.0%, 60.0% vs 15.0%, respectively, P=0.001, P=0.008, respectively). Positive correlations were observed between the elevation of TTF-1/PAX-8 at 12 months after the end of PORT and hypothyroidism after breast cancer supraclavicular field radiation (OR=9.702, 3.930, and P=0.020, 0.046, respectively) according to multivariate analysis. Conclusion: Thyroid dysfunction after breast cancer PORT was mainly manifested with hypothyroidism; supraclavicular field radiation may significantly increase the incidence of hypothyroidism; serum levels of TTF-1 and PAX-8 elevated obviously in breast cancer PORT patients who had hypothyroidism after receiving supraclavicular field radiation.
[Key words] Breast cancer; Radiation therapy; Supraclavicular field; Thyroid transcription factor; Thyroid dysfunction
乳腺癌综合治疗手段(包括手术、放化疗、内分泌治疗、靶向治疗等)的不断进步,其局部控制与总体生存情况都得到明显改善,患者5年总生存率可达80%~85%[1-3]。随着乳腺癌患者获得长期的生存,其综合治疗带来的相关不良反应越来越受到重视。据中国肿瘤内科学会(Chinese Society of Clinical Oncology,CSCO)及美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)指南推荐,术后区域淋巴结分期达到N2~N3期的乳腺癌患者需要接受锁骨上、下区的放疗[3]。甲状腺作为锁骨上区放疗野的临近器官,不可避免地会受到一定程度的照射。甲状腺的功能异常在乳腺癌术后放疗患者的长期随访中越来越多地被现,并受到临床医务人员的重视。目前临床上主要通过检测血清甲状腺功能指标来观察甲状腺的功能变化,而甲状腺转录因子包括甲状腺转录因子1(thyroid transcription factor 1,TTF-1)和配对盒转录因子8(paired box 8,PAX-8),在甲状腺的功能及免疫调控中具有重要地位[4-6]。虽然已有学者将检测血清甲状腺转录因子水平的变化作为甲状腺恶性肿瘤疗效及患者预后的随访指标[7-9],但关于甲状腺转录因子在放疗后发生甲状腺功能异常的相关性研究仍鲜见报道。
本研究拟通过比较乳腺癌术后放疗患者放疗前后血清学甲状腺转录因子(TTF-1、PAX-8)水平的变化,结合血清甲状腺功能指标的变化,包括三碘甲状腺原氨酸(triiodothyronine,T3)、四碘甲状腺原氨酸(tetraiodothyronine,T4 )、游离三碘甲状腺原氨酸(free triiodothyronine,FT3)、游离四碘甲状腺原氨酸(free tetraiodothyronine,FT4)、促甲状腺激素(thyroid stimulating hormone,TSH)、甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPO-Ab),分析血清学甲状腺转录因子变化与乳腺癌术后放疗后甲状腺功能异常的相关性,为临床乳腺癌放疗后甲状腺功能异常的早期发现和及时干预提供依据。
1 资料和方法
1.1 临床资料
前瞻性收集2022年1月—6月上海交通大学医学院附属第九人民医院黄浦分院放疗科收治的女性乳腺癌术后放疗患者,纳入标准包括:① 放疗开始前无甲状腺疾病病史;②无颈部手术治疗史;③ 无肿瘤远处转移;④ 放疗前完成辅助化疗或不需化疗;⑤ 美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分0~1。排除标准包括:① 放疗前有甲状腺疾病病史;② 既往有颈部手术治疗史;③ 肿瘤发生远处转移;④ 放疗前未完成足疗程辅助化疗,放疗后仍需继续完成化疗;⑤ ECOG评分≥2。入组患者按照其放疗靶区是否包括锁骨上区(supraclavicular region,SC),分为锁骨上区放疗组(SC组)与无锁骨上区放疗组(NSC组)。所有患者入组前均被完整告知研究内容,并签署知情同意书。本研究设计通过了我院伦理委员会的伦理审查(审批号:伦审2021-KY-2)。
1.2 锁骨上区靶区和甲状腺勾画、处方剂量及计划设计
放疗科医师根据2010版美国肿瘤放疗协作组(Radiation Therapy Oncology Group,RTOG)乳腺癌放疗靶区及剂量设计指引专家共识进行锁骨上靶区、正常器官及甲状腺勾画,计划靶区(planned target volume,PTV)上、下界由临床靶区(clinical target volume,CTV)上下各外放1 cm,左右外放6 mm,锁骨上区放疗剂量 50 Gy/25 Fx/5 w,甲状腺剂量限制参数:30 Gy及以上的受照射体积(V30)<50%。患者在Eclipse 11计划系统(treatment planning system,TPS)上做逆向调强放疗计划,采用6~8野照射技术,计划靶区分为胸壁(乳腺)照射区±锁骨上淋巴引流照射区。
1.3 甲状腺转录因子血液标本的留取及检测
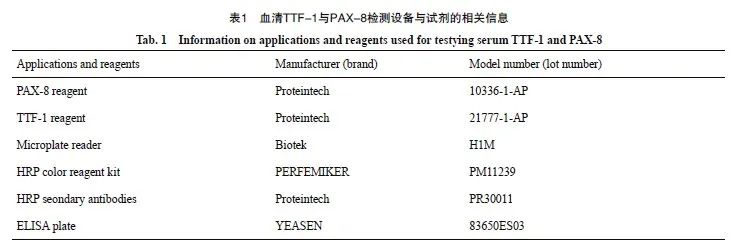
本研究中检测血液标本甲状腺转录因子使用到的设备及标本板的品牌型号详见表1。具体操作步骤:① 血清样本收集:使用不含热原和内毒素的试管收集血液,室温下血液自然凝固10~20 min,2 500 r/min离心20 min,将血清和红细胞迅速小心分离,收集上清液。② 加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、待测样品孔。在酶标包被板上标准品准确加样50 μL,待测样品孔中先加样品稀释液40 μL,然后再加待测样品10 μL。③温育:用封板膜封板后置37 ℃温育30 min。④洗涤:揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 s弃去,重复5次。⑤ 加酶:每孔加入酶标试剂50 μL,空白孔除外。再次用封板膜封板后置37 ℃温育30 min后洗涤。⑥ 显色:每孔先加入显色剂A 50 μL,再加入显色剂B 50 μL,轻轻振荡混匀,37 ℃避光显色10 min。⑦ 终止:每孔加终止液50 μL,终止反应(此时蓝色立转黄色)。⑧ 测定:以空白空调零,450nm波长处依序测量各孔的吸光度(D值),测定应在加终止液后15 min以内进行。
1.4 甲状腺功能指标的检测
所有入组患者分别在放疗前、放疗结束时、结束后6、12和24个月时空腹抽取2管3 mL肘静脉血,4 000 r/min离心10 min,取血清在3 ℃下保存,由我院检验科科医师应用罗氏游离甲状腺素检测试剂盒进行甲状腺功能检测。
1.5 统计学处理
对两组患者的甲状腺转录因子测量数据进行正态性检验和方差齐性检验,若符合正态分布,则以(x±s)表示,组间数据进行独立样本t检验(方差齐)或ANOVA单因素方差分析(方差不齐);若为偏态分布,则采用四分位法,以[M(P25,P75)]表示,组间数据进行独立样本Mann-Whitney U检验。明确甲状腺转录因子变化情况,以变化最显著阶段的平均值作为参考值,设置正常组与异常组,分别采用卡方检验(Chi square test)或费舍尔精确检验(Fisher test)进行单因素分析,采用二元logistic回归分析法进行多因素分析,明确甲状腺转录因子的变化与乳腺癌术后放疗后发生甲状腺功能异常的相关性。P<0.05为差异有统计学意义。本研究采用 SPSS 26.0进行数据统计,采用Graphpad Prism 9 进行制图。
2 结 果
2.1 入组患者及流程图
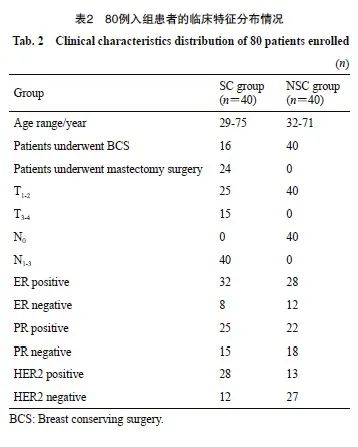
患者的纳入和排除流程见图1。本研究共纳入80例符合入组条件的患者,其中SC组40例,NSC组40例。80例患者均完成放疗后2年的随访。80例患者年龄范围21~76岁;其中,SC疗组患者的年龄范围:29~75岁,平均年龄53.7岁;NSC组的患者年龄范围:32~71岁,平均年龄50.3岁。80例患者的临床资料分布情况见表2。
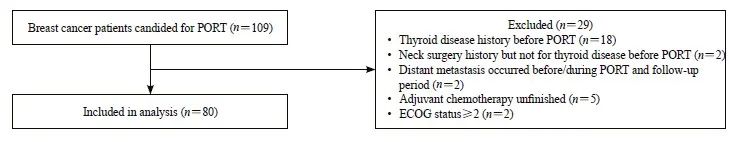
图1 入组患者纳入及排除流程图
Fig. 1 Flow chart of patients’ inclusion and exclusion procedure
PORT: Post-operative radiation therapy.
2.2 放疗后甲状腺功能异常的发生情况
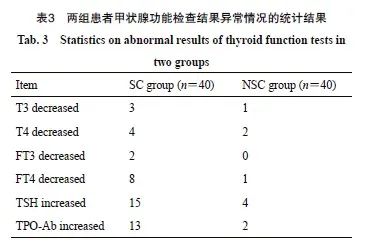
随访期间共有19例患者发生甲状腺功能减退,总体发生率为21.3%。其中1例患者有纳差伴乏力症状明显,给予优甲乐替代治疗后症状缓解,其余18例仅表现为TSH升高伴或不伴甲状腺激素水平的降低。其中SC组发生甲状腺功能减退15例,发生率为37.5%,有3例发生在放疗结束后6个月,12例发生在放疗结束后12个月;NSC组有4例,发生率为10%,其中3例发生在放疗结束后6个月,1例发生在放疗结束后12个月。SC组甲状腺功能减退发生率显著高于NSC组(P=0.000 4,表3、4)。
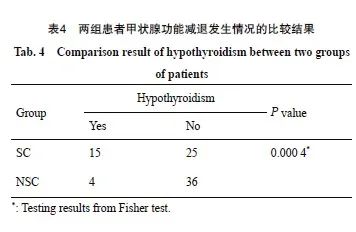
2.3 放疗前后血清甲状腺转录因子TTF-1、PAX-8的变化情况
两组患者的甲状腺转录因子检测值的统计结果显示,TTF-1的各阶段检测值均为偏态分布,而PAX-8的检测值在放疗前(方差不齐)与放疗结束时(方差齐)为正态分布,其余阶段均为偏态分布。放疗开始前,两组患者血清TTF-10.296]、PAX-8(5.26±1.01 vs 5.66±1.37,P=0.149)水平差异无统计意义。其中SC组患者TTF-1、PAX-8的血清检测值在放疗后的12个月内出现逐渐升高的趋势,至放疗后24个月又逐渐降低到放疗前的水平;而NSC组TTF-1、PAX-8的血清检测值在放疗后的24个月内无明显变化。两组患者的TTF-1的血清检测值在放疗后6个月[6.99(4.73,13.94) vs 5.79(5.01,6.28),P=0.049]、12个月[7.65(5.02,17.85) vs 5.43(4.52,6.22),P=0.005]的差异有统计学意义。PAX-8的血清检测值仅在放疗后12个月[6.79(4.86,14.30) vs 5.81(4.70,7.25),P=0.042]的差异有统计学意义(表5,图2、3)。[5.70(5.11,7.13) vs 6.68(5.15,7.57),P=0.296]、PAX-8(5.26±1.01 vs 5.66±1.37,P=0.149)水平差异无统计意义。其中SC组患者TTF-1、PAX-8的血清检测值在放疗后的12个月内出现逐渐升高的趋势,至放疗后24个月又逐渐降低到放疗前的水平;而NSC组TTF-1、PAX-8的血清检测值在放疗后的24个月内无明显变化。两组患者的TTF-1的血清检测值在放疗后6个月[6.99(4.73,13.94) vs 5.79(5.01,6.28),P=0.049]、12个月[7.65(5.02,17.85) vs 5.43(4.52,6.22),P=0.005]的差异有统计学意义。PAX-8的血清检测值仅在放疗后12个月[6.79(4.86,14.30) vs 5.81(4.70,7.25),P=0.042]的差异有统计学意义(表5,图2、3)。
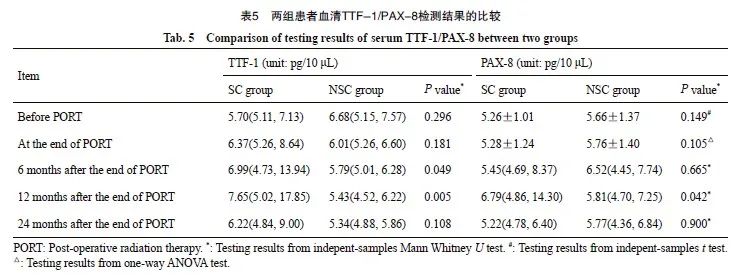
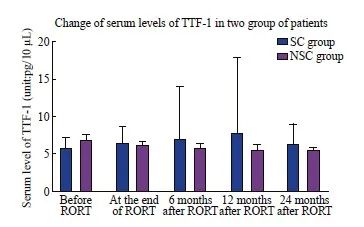
图2 两组患者血清TTF-1变化情况的比较
Fig. 2 Comparison of Change of serum TTF-1 between two groups PORT: Post-operative radiation therapy.
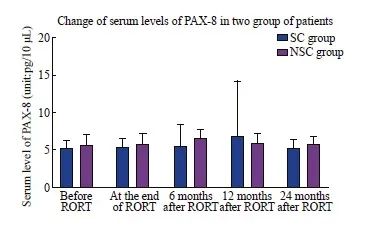
图3 两组患者血清PAX-8变化情况的比较
Fig. 3 Comparison of the changes of serum PAX-8 between two groups
PORT: Post-operative radiation therapy.
2.4 甲状腺转录因子变化情况与甲状腺功能异常的相关性分析
以SC组TTF-1以及PAX-8均明显升高的放疗结束后12个月的检测值中位数作为参考阈值,将检测值超过平均值定义为升高亚组,低于平均值定义为正常亚组。对SC组中40例患者的甲状腺功能减退情况与患者年龄(按照平均年龄53.7岁分成两组)、手术方式(保乳手术 vs 改良根治术)、TTF-1(升高亚组 vs 正常亚组)、PAX-8 (升高亚组 vs 正常亚组)等变量的相关性进行单因素分析。结果显示,TTF-1/PAX-8升高亚组甲状腺功能减退的发生比例明显高于正常亚组(分别为65.0% vs 10.0%、60.0% vs 15%,P=0.001、P=0.008)。而年龄(P=0.673)、手术方式(P=0.715)分组间的甲状腺功能减退发生情况差异无统计学意义。进一步对TTF-1/PAX-8升高与甲状腺功能减退相关性进行多因素分析,结果显示,TTF-1升高、PAX-8升高的(OR=9.702、OR=3.930,P=0.020、P=0.046),提示乳腺癌术后锁上野放疗结束后12个月的TTF-1/PAX-8升高与甲状腺功能减退的发生有明确的正相关性(表6、图4)。
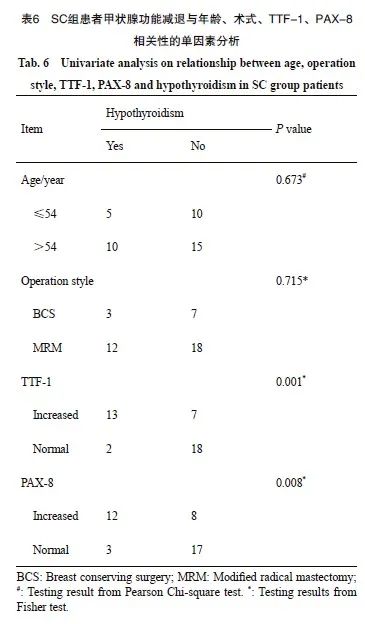
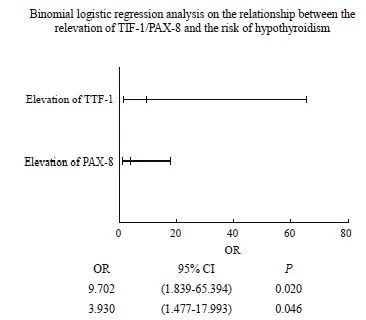
图4 SC组患者甲状腺功能减退与TTF-1/PAX-8升高的相关性多因素分析
Fig. 4 Multivariate analysis on relationship between the elevation of TTF-1/PAX-8 and hypothyroidism in SC group patients
3 讨 论
甲状腺疾病的发生、发展与内分泌功能的变化有着密切的联系,这与乳腺癌的发病有一定的相关性。有研究[10-12]发现乳腺癌与甲状腺疾病有共同的内源激素致病因子,内分泌功能的变化与腺体疾病的发生有密切关系,甲状腺激素受体与雌激素受体在编码基因的核苷酸序列上存在部分相似性,二者在调节靶细胞的生长过程中可能存在相似的信号转导通路,因此乳腺癌患者在发生甲状腺病变方面天然具有较高的易感性。
乳腺癌术后放疗作为综合治疗的重要手段之一,在提高乳腺癌局控率和改善患者的总生存情况上均起着重要的作用,同时治疗相关的不良反应不可避免地出现在患者的治疗过程中,包括对甲状腺功能的影响[13-15],通常以甲状腺功能减退为主要表现。放疗引起甲状腺损伤的机制主要有[16-17]:① 电离辐射对甲状腺细胞DNA链的直接损伤;② 放射线对甲状腺相关血管内皮细胞的损伤;③ 放射治疗导致的自身免疫反应:包括电离辐射对甲状腺组织和间质破坏后的产物刺激抗甲状腺抗体增多,从而引起局部的自身免疫反应。常见的甲状腺转录因子,包括TTF-1和PAX-8,在甲状腺的功能及免疫调控中起到重要作用,包括参与调控甲状腺球蛋白、甲状腺过氧化物酶抗体、促甲状腺激素受体等多种蛋白表达的基因,以及调控主要组织相容性复合物-1(major histocompatibility complex,MHC-1)蛋白表达的基因[4-6]。尽管目前尚未有研究分析甲状腺转录因子在放疗继发甲状腺损伤中的相关作用,但前者的功能与后者的发生机制有较高的契合度。已有学者将检测血清甲状腺转录因子水平的变化作为恶性肿瘤疗效及患者预后的随访指标[7-9],但将其作为甲状腺功能变化的监测指标,尚未见相关报道。
本研究入组患者在随访中发现甲状腺功能异常的19例患者均表现为甲减,发生率为21.3%,其中SC组有15例,发生率为37.5%。在此15例患者中,13例伴有TPO-Ab的异常升高,即乳腺癌锁上野放疗导致的甲状腺损伤主要表现为甲状腺功能减退,其发生机制与免疫功能异常有关,这一结论与文献报道[16-17]基本相符。
通过对乳腺癌患者术后放疗前与放疗后的血清甲状腺转录因子水平进行检测发现,SC组患者TTF-1、PAX-8的血清检测值分别在放疗后的6个月以及12个月内出现逐渐升高趋势,且在放疗后24个月又逐渐降低到放疗前水平;而NSC组TTF-1、PAX-8的血清检测值在放疗后的24个月内无明显变化。
在对甲状腺转录因子水平变化与乳腺癌术后锁上野放疗所致甲减的相关性分析中,TTF-1与PAX-8在放疗结束后12个月的升高与乳腺癌术后锁上野放疗后的甲减发生具有显著相关性,均可作为乳腺癌术后锁上野放疗继发甲状腺功能减退的监测指标。
综上所述,随着精准医学时代的到来,放疗技术的不断进步,使得甲状腺受照射剂量和受照射体积不断减少,放疗后继发性甲状腺功能异常的表现以甲状腺功能减退为主;乳腺癌锁骨上照射显著增加患者甲状腺功能减退的发生率,甲状腺转录因子TTF-1和PAX-8的水平在乳腺癌术后锁上野放疗后发生甲状腺功能减退的患者中显著增高,尤其是在放疗结束后1年左右。甲状腺转录因子TTF-1以及PAX-8可作为观察乳腺癌术后锁上野放疗后甲状腺功能减退的辅助指标,以便于临床早期发现、及时干预,指导临床医师在乳腺癌术后放疗继发甲状腺功能减退的诊疗中采取更加合理的策略。
利益冲突声明:所有作者声明不存在利益 冲突。
作者贡献声明:
陈刚:研究设计,数据收集与统计分析,文章撰写。张顺康:数据收集与统计分析,实验操作。郭绍文:实验操作,数据收集。卢月:数据收集,实验操作。孙丽云:数据收集,实验操作。沈磊:数据收集,放疗计划设计与参数收集。汪成:研究设计指导,研究实施监督与质量控制,文章审阅修改。
[参考文献]
[1] WEISS A, CHAVEZ-MACGREGOR M, LICHTENSZTAJN D Y, et al. Validation study of the American Joint Committee on Cancer eighth edition prognostic stage compared with the anatomic stage in breast cancer[J]. JAMA Oncol, 2018, 4(2): 203-209.
[2] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249.
[3] 中国抗癌协会乳腺癌专业委员会, 中华医学会肿瘤学分会乳腺肿瘤学组. 中国抗癌协会乳腺癌诊治指南与规范(2024年版)[J]. 中国癌症杂志, 2023, 33(12): 1092-1187.
The Society of Breast Cancer China Anti-Cancer Association, Breast Oncology Group of the Oncology Branch of the Chinese Medical Association. Guidelines for breast cancer diagnosis and treatment by China Anti-Cancer Association (2024 edition)[J]. Chin Oncol, 2023, 33(12): 1092-1187.
[4] SAJI M, SHONG M, NAPOLITANO G, et al. Regulation of major histocompatibility complex class Ⅰ gene expression in thyroid cells. Role of the cAMP response element-like sequence[J]. J Biol Chem, 1997, 272(32): 20096-20107.
[5] NAPOLITANO G, MONTANI V, GIULIANI C, et al. Transforming growth factor-beta1 down-regulation of major histocompatibility complex class Ⅰ in thyrocytes: coordinate regulation of two separate elements by thyroid-specific as well as ubiquitous transcription factors[J]. Mol Endocrinol, 2000, 14(4): 486-505.
[6] SUZUKI K, LAVARONI S, MORI A, et al. Autoregulation of thyroid-specific gene transcription by thyroglobulin[J]. Proc Natl Acad Sci U S A, 1998, 95(14): 8251-8256.
[7] 杨燕君, 张晓丽, 董跃华, 等. 血清甲状腺转录因子1水平对表皮生长因子受体酪氨酸激酶抑制剂治疗肺腺癌效果的评估价值[J]. 中国医药, 2020, 15(9): 1372-1376.
YANG Y J, ZHANG X L, DONG Y H, et al. Value of serum thyroid transcription factor-1 level in evaluating the efficacy of epdermal growth factor receptor-tyrosine kinase inhibitors treatment lung adenocarcinoma[J]. Chin Med, 2020, 15(9): 1372-1376.
[8] 李 笑, 万里燕, 申 洪, 等. 血清甲状腺转录因子-1蛋白的变化特点及在肺癌诊断中的意义分析[J]. 南方医科大学学报, 2011, 31(9): 1592-1596.
LI X, WAN L Y, SHEN H, et al. Variation of serum thyroid transcription factor-1 protein and its value in the diagnosis of lung carcinoma[J]. J South Med Univ, 2011, 31(9): 1592-1596.
[9] 王 静. 胃癌患者血清FOXO4和甲状腺转录因子1水平及其临床意义[J]. 实用癌症杂志, 2017, 32(5): 710-712.
WANG J. Serum levels of FOXO4 and thyroid transcription factor 1 in gastric cancer and its clinical significance[J]. Pract J Cancer, 2017, 32(5): 710-712.
[10] TAN H, WANG S S, HUANG F F, et al. Association between breast cancer and thyroid cancer risk: a two-sample Mendelian randomization study[J]. Front Endocrinol, 2023, 14: 1138149.
[11] YUAN S, KAR S, VITHAYATHIL M, et al. Causal associations of thyroid function and dysfunction with overall, breast and thyroid cancer: a two-sample Mendelian randomization study[J]. Int J Cancer, 2020, 147(7): 1895-1903.
[12] HALADA S, CASADO-MEDRANO V, BARAN J A, et al. Hormonal crosstalk between thyroid and breast cancer[J]. Endocrinology, 2022, 163(7): bqac075.
[13] KANYILMAZ G, AKTAN M, KOC M, et al. Radiation-induced hypothyroidism in patients with breast cancer: a retrospective analysis of 243 cases[J]. Med Dosim, 2017, 42(3): 190-196.
[14] HUANG H K, ROBERSON J, HOU W, et al. NTCP model for hypothyroidism after supraclavicular-directed radiation therapy for breast cancer[J]. Radiother Oncol, 2021, 154: 87-92.
[15] DIGKAS E, SMITH D R, WENNSTIG A K, et al. Incidence and risk factors of hypothyroidism after treatment for early breast cancer: a population-based cohort study[J]. Breast Cancer Res Treat, 2024, 204(1): 79-87.
[16] BHANDARE N, KENNEDY L, MALYAPA R S, et al. Primary and central hypothyroidism after radiotherapy for head-andneck tumors[J]. Int J Radiat Oncol Biol Phys, 2007, 68(4): 1131-1139.
[17] THOMAS O, MAHÉ M, CAMPION L, et al. Long-term complications of total body irradiation in adults[J]. Int J Radiat Oncol Biol Phys, 2001, 49(1): 125-131.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)