首页 > 医疗资讯/ 正文
摘要:缺血性卒中因其损伤机制复杂且发病率和致残率高,一直是脑血管病研究领域棘手的问题,寻找新型有效的干预及神经保护策略至关重要。白细胞介素33(IL-33)作为IL-1家族新发现的成员之一,是当前研究的热点,血清刺激素2(ST2)是其作用的主要受体。作者就IL-33/ST2信号通路在缺血性卒中中的研究现状进行综述,以梳理该信号通路在缺血性卒中中发挥保护作用的机制,包括扩增调节性T细胞、调节炎症和改善白质损伤等,以期为缺血性卒中的治疗提供新的思路。
缺血性卒中是由于脑供血动脉狭窄或闭塞、脑血栓形成等引起的局部血供减少或中断,约占卒中类型的85%。一项关于全球疾病、伤害和风险因素负担的研究分析显示,卒中是全球50岁以上年龄组伤残调整生命年降低的主要原因之一。白细胞介素33(IL-33)是IL-1家族中新发现的成员之一,其生物学功能广泛、作用机制复杂,是目前研究的热点,主要集中于炎症性疾病、癌症及心脑血管疾病领域。值得注意的是,相较于其他组织和器官,IL-33在大脑和脊髓中高表达,这表明IL-33在中枢神经系统中可能具有特殊功能。多项研究已表明,IL-33在中枢神经系统发育和稳态中发挥关键作用,并且通过多种机制在中枢神经系统疾病(包括多发性硬化症、神经胶质瘤和缺血性脑损伤等)中发挥重要的保护作用。笔者就IL-33/血清刺激素2(serum stimulation-2, ST2)信号通路在缺血性卒中中的作用及其作用机制作一综述,以期为缺血性卒中的治疗提供新思路。
1 IL-33/ST2信号通路概述
IL-33定位于染色体9p24.1上,包含8个外显子,共编码270个氨基酸,其蛋白主要由两个进化保守的结构域组成,即位于N端的核结构域和位于C端的IL-1样细胞因子结构域,前者在介导IL-33核定位以及和染色质结合中具有关键作用,后者主要识别靶细胞表面特异性受体ST2和共受体IL-1受体辅助蛋白(interleukin-1 receptor accessory protein, IL-1RAcP)组成的异源二聚体介导Th2型细胞反应。因此,IL-33是一种双重功能蛋白,其一,作为核因子,IL-33表现出转录抑制的特性,但是IL-33在细胞核内如何调控基因或蛋白表达仍不明确;其二,作为多功能免疫调节细胞因子,IL-33也是一种内源性警报蛋白,即当细胞暴露于病原体、损伤引起应激或坏死时,IL-33迅速释放以动员免疫系统。IL-33以全长或裂解形式释放,经各种炎性蛋白酶,如中性粒细胞弹性蛋白酶、组织蛋白酶G、糜蛋白酶等裂解产生成熟形式的IL-3395-270、IL-3399-270、IL-33109-270,具有比全长IL-331-270更高的生物活性;然而,经半胱氨酸天冬氨酸蛋白酶3和7处理可能会使IL-1样细胞因子结构域丢失,从而导致IL-33失活。
IL-33发挥作用的ST2受体主要有2种亚型:跨模型ST2(ST2ligand,ST2L)和可溶性ST2(solubleST2,sST2),这两种亚型的产生是单个信使核糖核酸(messenger ribonucleic acid,mRNA)的不同启动子差异性表达和mRNA选择性剪接的结果。较长的转录本ST2L是一种跨膜蛋白,也是IL-33主要发挥作用的受体,该亚型是由3个免疫球蛋白样基序为特征的细胞外结构域、1个跨膜结构域和1个胞内Toll样/IL-1受体家族(Toll-interleukin 1 receptor,TIR)结构域组成;较短的转录本sST2是一种可溶性受体,缺乏跨膜和胞内结构域,但含有独特的9个氨基酸的C末端。sST2作为诱饵蛋白,可与ST2L竞争性结合IL-33从而阻止信号传导;IL-33与ST2L的异源二聚体结合会导致二聚体上的TIR结构域二聚化,进而募集和衔接髓样分化因子88、IL-1相关激酶1、4以及肿瘤坏死因子相关受体6,从而将信号从细胞外传递到细胞质。募集后的复合物一方面诱导丝裂原活化蛋白激酶激活与之相关的介质,比如细胞外信号调节激酶、c-JunN末端激酶以及蛋白激酶P38,进而导致神经保护因子激活蛋白1在细胞核内积累;另一方面激活κB抑制因子激酶复合物,并将转录因子核因子κB释放到细胞核中。这些途径共同调节靶细胞内相关细胞因子和趋化因子的表达,从而发挥调节炎症反应、抗凋亡、促进修复等重要的生理功能。IL-33/ST2信号传导通路示意图见图1。
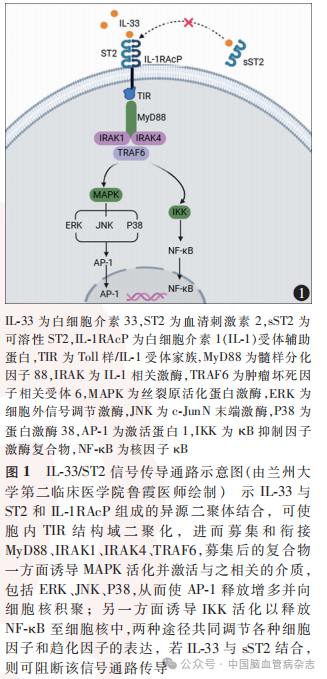
2 IL-33/ST2信号通路在缺血性卒中中可能的作用机制
2.1 扩增调节性T细胞(regulatory T cell, Tregs)
Tregs是CD4+T细胞的一个特殊亚群,特异性细胞内转录因子叉头盒P3(forkhead box P3, FoxP3)决定细胞的分化和功能。Tregs发挥负性调控作用,可抑制先天性和适应性免疫反应,是免疫稳态不可或缺的细胞。组织特异性Tregs是近年来研究的热点,Liston等在人类和啮齿类动物的脑组织中发现了与神经系统炎症相关的具有组织特异性功能的脑Tregs。研究表明,IL-33/ST2信号通路对Tregs的增殖和功能的维持至关重要,该通路不仅能明显驱动FoxP3+Tregs亚群扩增,还能促进ST2自身受体的表达,形成扩增的正反馈回路[20]。目前研究认为,Tregs是介导IL-33发挥免疫调节等作用的关键介质,这种介导机制已在多种疾病中证实,比如肿瘤相关性疾病、原虫感染、炎症性肠病和过敏性哮喘等。研究表明,促进Tregs扩增是缺血性卒中后IL-33发挥神经保护作用的关键原因。Liu等研究显示,与注射等量同种型免疫球蛋白G相比,腹腔注射IL-33(1μg/只)可明显增加大脑中动脉闭塞(middle cerebral artery occlusion, MCAO)模型小鼠缺血后第3天大脑和脾脏中Tregs的数量(分别为9.77%比4.48%,P<0.01;16.0%比8.95%, P<0.01),体外将Tregs与氧糖剥夺(oxygen glucose deprivation, OGD)后的神经元共培养,与注射等量同种型免疫球蛋白G的MCAO模型小鼠相比,IL-33处理使神经元的存活率明显增加(P<0.01),并促进Tregs相关细胞因子IL-10、IL-35、转化生长因子β(transforming growth factor-β, TGF-β)的表达(均P<0.01),可见IL-33能促进缺氧缺血诱导下大脑和脾脏中Tregs及Tregs相关细胞因子的表达;进一步采用三苯四氮氯化铵染色评估MCAO模型小鼠脑梗死面积,采用脱氧核糖核酸断裂的原位末端标记技术测量其脑梗死周围死亡神经细胞数目,采用改良神经系统严重程度评分量表评估感觉运动神经功能,结果显示,与空白对照组相比,经IL-33处理3d后的MCAO小鼠脑梗死面积及梗死周围死亡神经细胞数量均明显减少(均P<0.05),且经IL-33处理后第7天MCAO小鼠感觉运动神经功能改善(P<0.01),但是这些保护作用在注射抗CD25抗体耗竭Tregs后被消除。以上结果提示,Tregs在缺血性卒中脑损伤中可介导IL-33发挥神经保护作用,该研究结果在创伤性脑损伤模型鼠中也得到了验证。
然而Tregs介导IL-33发挥神经保护作用的机制尚未完全阐明。有研究者在小鼠MCAO前经脑室注射2μg的IL-33,结果显示,与注射5μl磷酸盐缓冲液(phosphate buffered saline, PBS)相比,IL-33不仅能明显增加缺血后48、72hMCAO小鼠脑组织及血清中Tregs、抗炎细胞因子IL-10和TGF-β1的相对表达水平(均P<0.05),还可上调Tregs分泌的双调蛋白(amphiregulin, AREG;P< 0.05),激活神经元中的表皮生长因子受体,促进神经元修复。另外,依赖于IL-33扩增的脑Tregs,通过AREG还可抑制MCAO小鼠缺血第14天神经毒性星形胶质细胞的过度增生,从而减少脑梗死区胶质瘢痕的形成。IL-33/ST2/Tregs/AREG信号通路作为治疗缺血性卒中的新型免疫调节靶点值得进一步研究。Yamamoto等利用IL-33和血清素可体外诱导脾脏来源的幼稚Tregs产生脑Tregs的特性,例如表达ST2、过氧化物酶体增殖物激活受体γ和5-羟色胺受体7,转录组测序及实时荧光定量聚合酶链反应显示,IL-33诱导产生的脑Tregs具有与体内脑Tregs相似的基因表达模式,并且与脾脏幼稚Tregs相比,脑Tregs能明显改善帕金森病模型鼠的神经退行性行为(旋转实验:P<0.05),提示利用IL-33诱导产生脑组织特异性的Tregs有望成为获取脑Tregs的新方法。
2.2 免疫调节和抑制炎症反应
缺血性卒中引起的神经炎症和全身炎症反应是造成脑组织损伤的重要机制之一,IL-33/ST2信号通路在缓解缺血性卒中后脑损伤中的免疫调节机制已逐渐得到认可。
2.2.1 维持辅助性T细胞(helper T cell, Th)1/Th2免疫平衡:正常情况下,Th1型、Th2型及其相关细胞因子处于动态平衡,急性脑梗死发生时会诱导神经毒性Th1型反应。而IL-33具有促进Th1/Th2平衡的功能,这与其在动脉粥样硬化中发挥保护作用的机制类似。Luo等于小鼠MCAO前经脑室给予2μg的IL-33(治疗组),与PBS组相比,治疗组在建模24h和72h后脑梗死面积更低[建模后24h:(21.89 ± 4.80)%比(36.27 ± 1.60)%,P<0.05;建模后72h:(8.52 ± 4.17)%比(37.08 ± 3.35)%,P< 0.05],且神经功能评分降低[建模后24h:(2.000 ± 0.302)分比(2.857 ± 0.125)分,P<0.05;建模后72h:(1.833 ± 0.167)分比(2.917 ± 0.193)分,P<0.05],这与治疗组在建模后24h和72h明显抑制脑组织中具有促炎作用的Th1型和Th17型免疫反应(与PBS组比较,干扰素γ+T细胞和IL-17+T细胞的百分比均下调;均P<0.05)变化相一致。另外,IL-33发挥神经保护作用可能与其调节外周脾脏Th1/Th2免疫反应有关,Xiao等研究表明,小鼠MCAO24h后脾脏明显萎缩,经IL-33(100g/kg)腹腔注射预处理24h后不但逆转了MCAO小鼠脾脏的萎缩(脾指数高于PBS组,P<0.05),且与等量腹腔注射PBS处理相比,IL-33预处理组MCAO小鼠脾脏中Foxp3+Tregs的表达(5.9%比12.2%,P< 0.05)及与Th2型免疫反应相关的细胞因子IL-4、IL-10和TGF-β的表达均增加(均P<0.05)。进一步明确缺血性卒中后T细胞亚群免疫反应可能有助于阐明缺血性卒中的机制,也有助于确定IL-33在其治疗中作用的靶点。
2.2.2诱导M2样抗炎性小胶质细胞极化:小胶质细胞是预防缺血性卒中后脑损伤的第一道防线,可极化成不同表型,在缺血性卒中后脑损伤的不同阶段发挥着不同作用。M1样促炎性小胶质细胞通过产生各种促炎细胞因子(IL-6、肿瘤坏死因子α)、神经毒性物质等导致继发性脑损伤;而M2样抗炎性小胶质细胞表达各种神经营养因子(精氨酸酶1、表皮生长因子)、抗炎细胞因子等促进神经修复、再生和恢复平衡。缺血性卒中后脑损伤的严重程度取决于M1样和M2样小胶质细胞之间的净效应。Luo等研究结果显示,与正常鼠比较,缺血-再灌注损伤后24、72hIL-33基因被敲除的缺陷鼠三苯四氮氯化铵染色下的脑梗死面积增加[分别为(36.78±3.10)%比(22.91±1.39)%、(46.83±4.01)%比(31.57±1.91)%,均P<0.05],进一步采用实时定量逆转录聚合酶链反应显示,缺血-再灌注损伤后72hIL-33基因被敲除缺陷鼠M2样小胶质细胞特异性标志物(CD206、CD163)及M2样抗炎因子Arg-1、IL-10及TGF-β的表达均降低(均P<0.01),提示IL-33缺失可导致小胶质细胞向M2样转化受损,而IL-33基因被敲除缺陷鼠腹腔注射IL-33可以使缺血后24h和72h小鼠脑梗死面积减小[分别为(28.93 ± 3.12)%比(13.53 ± 1.89)%、(40.18 ± 4.37)%比(16.31 ± 1.59)%,均P<0.01],并增加CD206、CD163的表达(均P<0.01)。此外,进一步研究基因敲除小鼠ST2对小胶质细胞表型的影响,结果显示,与健康小鼠比较,ST2的缺失降低了抗炎性M2样标志物IL-10、TGF-β、CD206的表达(均P<0.05),增加了M1样标志物CD16、诱导型一氧化氮合酶的表达(均P<0.05),ST2的缺失导致M1、M2比例失衡,其中M2样小胶质细胞标志物IL-10是IL-33诱导小胶质细胞释放的重要神经保护因子。综上所述,IL-33/ST2信号通路在缺血性卒中后脑损伤中通过影响小胶质细胞M1、M2样表型转化,即促进具有抗炎和组织修复作用的M2样极化来减轻脑损伤,这可能是该信号通路治疗缺血性卒中后脑损伤的一个关键靶点。
然而,Th细胞与小胶质细胞可相互影响,Th2型细胞因子IL-4、IL-10等可诱导M2样小胶质细胞极化,M2样细胞因子也能募集Th1型细胞并诱导其向Th2型分化,从而更有效地抑制炎症反应,促进组织修复。此外,IL-33还可作用于其他免疫细胞如星形胶质细胞、中性粒细胞等发挥抗炎作用。Zheng等研究显示,IL-33能动员脑组织中2型固有淋巴细胞扩增,2型固有淋巴细胞是缺乏抗原特异性受体的特化的先天性淋巴细胞,可以IL-4依赖的方式抑制卒中后过度的炎症反应和脑损伤。IL-33在缺血性卒中后脑损伤中调节免疫反应,抑制炎症的机制值得进一步探究。
2.3 改善白质损伤
神经系统白质主要由成束的有髓或无髓鞘的轴突以及各种神经胶质细胞组成,约占人类大脑体积的50%,白质对大脑不同区域之间的电信号传输至关重要,其损伤会导致严重的神经行为和认知障碍。白质损伤是缺血性卒中后脑损伤的重要组成部分,包括产生髓鞘的少突胶质细胞和少突胶质细胞前体细胞的凋亡、髓鞘的脱失以及轴突变性,可导致严重的神经行为和认知障碍。研究表明,IL-33/ST2信号通路在神经退行性疾病中发挥保护作用。韩玥莹等纳入了104例因脑灌注不足引起的缺血性脑白质病变患者,根据脑白质高信号严重程度评估量表分为轻度(1~2分)组、中度(3~4分)组和重度(5~6分)组,采用动脉自旋标记技术测量脑白质病变区局部脑血流量,结果显示,血清中IL-33水平(OR=0.818,95% CI:0.715~0.935,P=0.003)、半卵圆中心(OR=0.817,95% CI:0.692~0.966,P= 0.018)及侧脑室旁局部脑血流量(OR=0.659,95% CI:0.506~0.859,P= 0.002)是脑缺血后白质病变严重程度的影响因素,低IL-33水平与中、重度脑白质病变显著相关(受试者工作特征曲线下面积0.778,95% CI:0.691 ~ 0.865,P< 0.01),提示IL-33可用于预测中、重度脑缺血后白质病变的严重程度。然而IL-33改善脑白质损伤的机制仍未完全明确,漆树酸是一种已知的组蛋白乙酰转移酶抑制剂,可通过直接或间接作用促进少突胶质细胞前体细胞中髓鞘基因和髓鞘碱性蛋白的表达,进而促进髓鞘再生,IL-33介导了漆树酸对髓鞘基因间接作用的过程。王春慧将小胶质细胞与少突胶质细胞前体细胞共培养3d,与只添加脂多糖处理相比,脂多糖+IL-33处理组M1样小胶质细胞标志物CD16(P=0.001)、iNOS(P=0.002)、肿瘤坏死因子α(P= 0.027)表达均降低,M2样小胶质细胞标志物CD206(P=0.002)、TGF-β(P= 0.031)表达均增加,同时伴随着少突胶质细胞相关蛋白髓鞘碱性蛋白(P=0.037)、髓鞘蛋白脂蛋白(P=0.033)的表达增加,提示IL-33可能通过促进小胶质细胞向M2样分化,从而形成抗炎微环境,促使少突胶质细胞前体细胞分化成熟,促进髓鞘再生修复。Xie等将不同浓度IL-33(0~200μg/L)处理的小胶质细胞培养基转移到OGD条件下的少突胶质细胞和少突胶质细胞前体细胞中,与未做任何处理相比,IL-33(25~100μg/L)处理的小胶质细胞能显著降低少突胶质细胞和少突胶质细胞前体细胞的死亡率(均P<0.01)。上述研究结果揭示了IL-33在改善缺血性卒中后白质结构和功能完整性方面的重要性,其中小胶质细胞可能起到了关键作用。
2.4 其他
在中枢神经系统中,IL-33在大脑和脊髓中高表达,其主要由星形胶质细胞、少突胶质细胞产生,并通过自分泌和旁分泌的方式作用于小胶质细胞和星形胶质细胞上的ST2受体。间充质干细胞来源的外泌体(mesenchymal stem cells-derived exosomes, MSC-Exo)在缺血性卒中后脑损伤治疗中具有极大潜力,是近年来研究的热点。Liu等在小鼠脑缺血-再灌注后静脉注射100μl的MSC-Exo,与静脉注射等量PBS干预相比,MSC-Exo治疗后的小鼠脑梗死面积减少(P<0.05),采用旋转实验、热板测试等评估的神经系统功能行为改善(均P<0.05),进一步研究显示,MSC-Exo给药使脑缺血后24h小鼠脑梗死周围IL-33和ST2的表达增加(均P<0.05),体外将星形胶质细胞培养基与OGD下的原代神经元共培养,与PBS处理相比,MSC-Exo处理可提高星形胶质细胞对OGD条件下神经元的保护作用率(增加细胞生存能力,P<0.05),然而当星形胶质细胞转染了靶向沉默IL-33或ST2的小干扰RNA,则可使星形胶质细胞失去对神经元的保护作用(与MSC-Exo处理组相比,细胞生存能力降低,P<0.05)。这表明MSC-Exo可能通过激活星形胶质细胞中的IL-33/ST2信号通路在缺血性卒中后脑损伤中发挥保护作用。
3 潜在生物标志物
IL-33被认为是缺血性卒中潜在的生物标志物。Qian等初步分析了206例急性缺血性卒中(acute ischemic stroke, AIS)患者资料,与健康对照组相比,AIS患者发病72h内血清中IL-33水平升高(57.68ng/L比47.48ng/L,P<0.01),使用巴塞尔指数(Barthel index,BI)评估AIS后3个月时的神经功能(BI低于85为预后不良),结果显示,缺血性卒中发病72h内血清IL-33水平降低与神经功能预后良好(BI≥85)相关(OR=0.932,95% CI:0.882 ~ 0.986,P= 0.006)。另一项纳入304例首次诊断为AIS患者的前瞻性研究结果表明,发病72h内血清中IL-33水平与发病后1年不良结局(BI<90,OR=0.956,95% CI:0.937~0.976,P< 0.01)和发病2年内缺血性卒中复发(OR=0.979,95% CI:0.961~0.997,P= 0.025)有关。可溶性sST2被认为是一种有前途的预测缺血性卒中预后的生物标志物,其可随着细胞损伤或坏死和促炎细胞因子的增加而增加,可作为诱饵受体独立存在于循环系统中以阻断IL-33的下游效应,脑脊液或血清sST2浓度的升高可能是缺血性卒中发生发展或疾病恶化的征象。已有指南将sST2列为心脏衰竭患者心肌纤维化新的生物标志物,同其他生物标志物联合可增加其预测危及生命的心血管事件的能力。在短暂性脑缺血发作或AIS患者中,将血清sST2水平添加到包含年龄、性别和入院病情严重程度的预测模型中,可显著提高短暂性脑缺血发作或AIS患者发病90d(净重分类指数=60.98%,95% CI:15.37%~106.6%,P= 0.009)和1年内(净重分类指数=41.68%, 95% CI:8.74%~74.61%,P=0.013)出现新的脑血管事件(缺血或出血性脑血管病)和全因死亡这些不良结局的预测价值。综上,sST2可能是预测缺血性卒中预后潜在的生物标志物。
4 展望
综上所述,IL-33/ST2信号通路可能通过多种机制在缺血性卒发生、发展中发挥保护作用,该信号通路作为治疗缺血性卒中潜在的新靶点,具有一定的应用前景,但仍有许多问题有待解决:(1)各种蛋白酶对IL-33的切割导致其活性增强或减弱以及完整长度和裂解形式的IL-33在不同疾病中的作用仍具有极大争议;(2)由于IL-33在多种组织和器官中表达,因此IL-33及其受体在中枢神经系统中的细胞定位需要进一步阐明;(3)研究显示,IL-33在缺血性卒中等疾病中可通过诱导星形胶质细胞和小胶质细胞的增殖、募集和活化加重神经系统炎症,所以如何规避破坏作用而有效发挥其保护作用,即如何调节IL-33浓度及活性靶向相关疾病特定阶段的特定受体来最大限度地发挥神经保护作用需更多体内外实验进一步研究;(4)目前关于IL-33在缺血性卒中中的研究大多依赖于小鼠模型,这些观察结果是否适用于临床仍有待证实;靶向IL-33/ST2通路的药物已在哮喘、慢性阻塞性肺疾病等呼吸系统疾病中进入临床研究阶段,然而目前尚未见针对此通路在缺血性卒中患者中的研究,未来仍需大量研究来设计靶向此通路的药物,以及明确该类药物是否适用于临床;(5)联合检测脑脊液或外周循环中的IL-33或sST2水平可能为卒中的诊断和预后预测提供依据,但目前关于两者作为相关生物标志物的研究尚不足。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)