首页 > 医疗资讯/ 正文
引言
出生后不久,新生心肌细胞经历了一个被称为心肌细胞成熟(cardiomyocyte maturation)的转变过程,包括能量代谢和细胞结构的变化。心肌细胞成熟的一个关键方面是代谢重编程,以从糖酵解转向脂肪酸氧化为标志。代谢重编程也是心力衰竭的一个标志。除了作为主要能量底物的葡萄糖和脂质的代谢改变外,衰竭心脏对酮体的利用增加。有趣的是,作为酮体生成最终产物的β-羟基丁酸(β-HB),在出生后早期阶段在心脏组织中达到峰值,之后迅速下降,这暗示了酮体生成与心肌细胞成熟之间可能存在某种关联。然而,酮体生成对心肌细胞成熟的确切影响及涉及的具体机制仍有待完全阐明。
破坏心肌细胞成熟的遗传突变常表现为先天性心脏病。在这个关键的发育过程中,与成熟相关的mRNA和蛋白表达呈现出时间特异性,这表明多维度的基因表达调控参与到该过程。以前的研究已经涉及多种调控因子,包括转录因子、增强子和microRNA,它们通过转录或转录后机制协调心脏成熟过程。最近,人们越来越认识到RNA修饰在心脏疾病中的重要性,特别是它们对转录后翻译的调控作用。然而,RNA修饰在心肌细胞成熟中的潜在作用和机制尚不清楚。
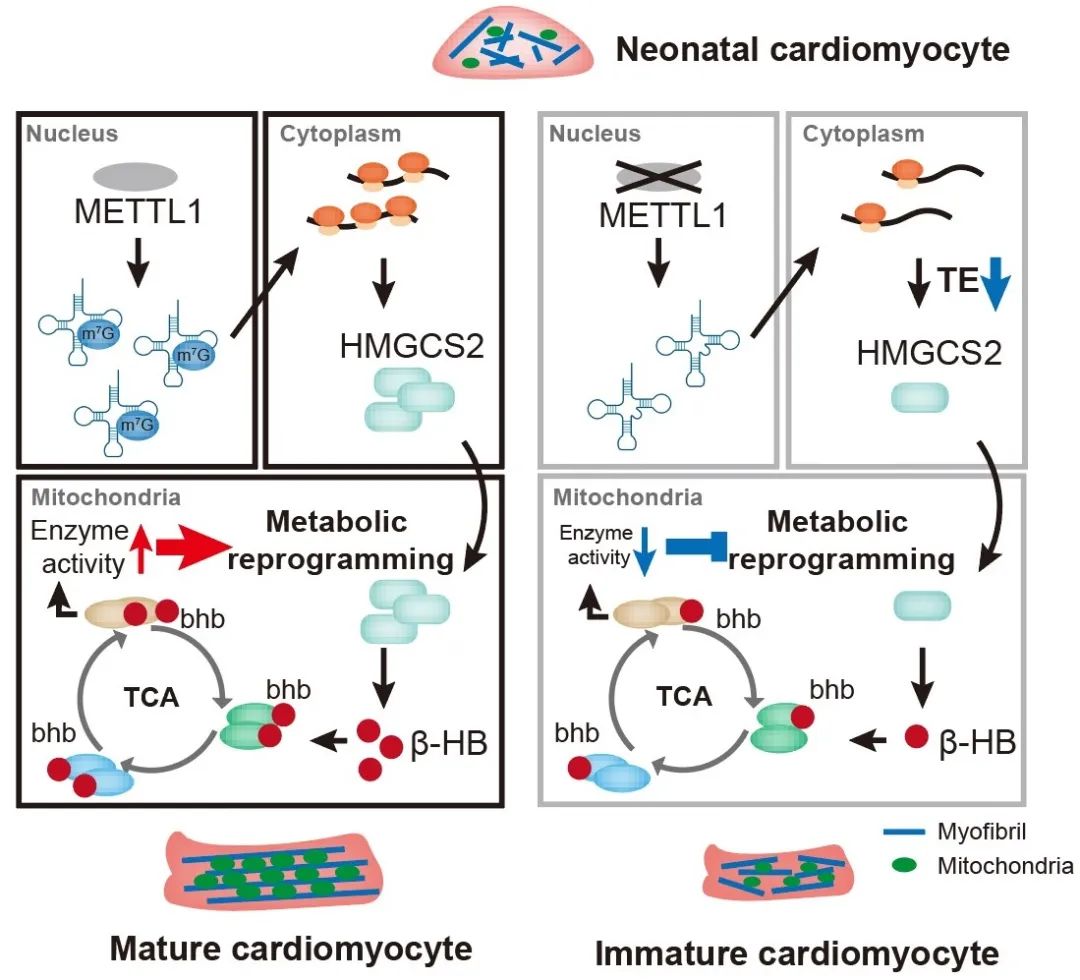
2024年11月25日,中山大学附属第一医院黄展鹏研究员团队在Nature Cardiovascular Research杂志上在线发表题为“The tRNA methyltransferase Mettl1 governs ketogenesis through translational regulation and drives metabolic reprogramming in cardiomyocyte maturation”的研究论文。该研究揭示了tRNA修饰酶Mettl1通过影响酮体生成限速酶Hmgcs2的翻译,驱动出生后心肌细胞成熟过程中的代谢重编程。

研究结果
1. Mettl1对出生后的心脏发育是必需的
为了探究RNA修饰在心肌细胞出生后成熟中的潜在作用,研究分析了人和小鼠出生后不同年龄段个体心脏中RNA修饰酶的表达情况。tRNA m7G甲基转移酶Mettl1,因其在出生后早期阶段心脏中的短暂升高而被筛选出来。为了探索Mettl1在心肌细胞成熟中的潜在调控功能,作者构建了出生后心肌细胞特异性敲除Mettl1的小鼠模型(M1cKO)。M1cKO小鼠心脏显示出肌节长度缩短且排列紊乱以及心肌细胞内较小的线粒体体积,提示Mettl1缺失的心肌细胞存在成熟障碍。
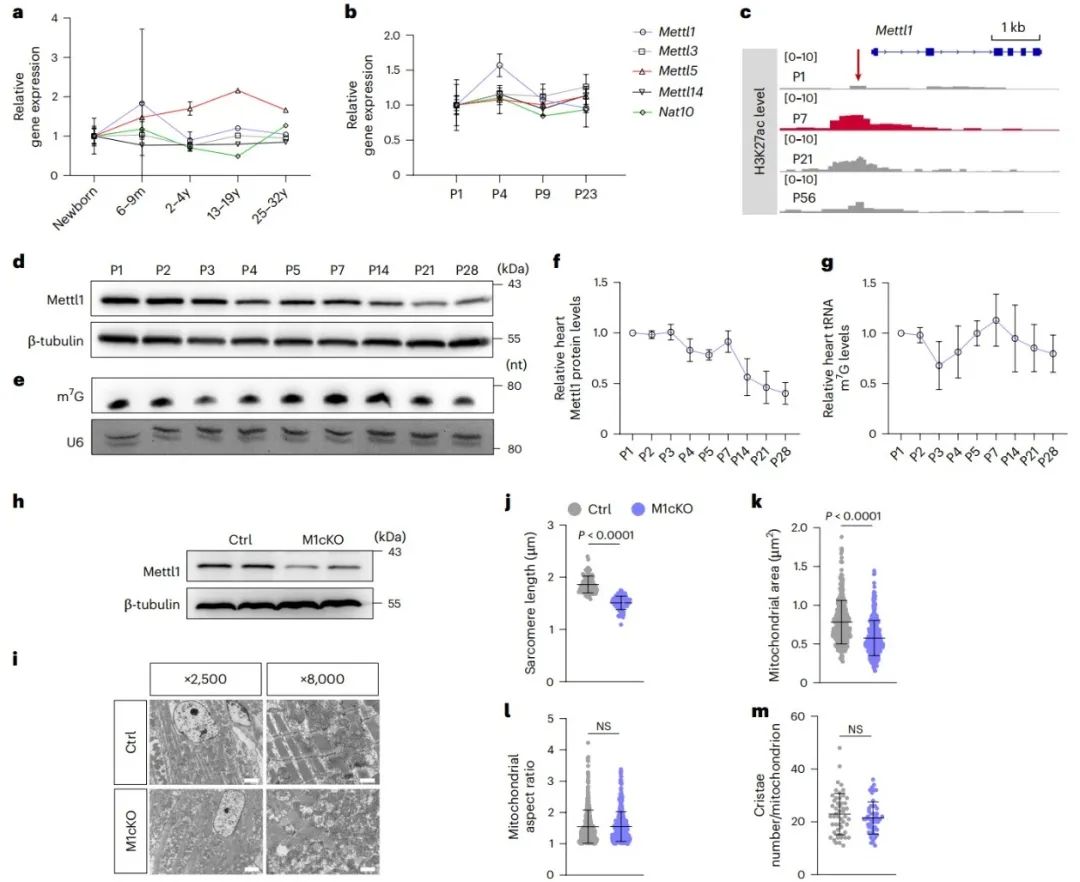
2. Mettl1缺失导致心肌细胞成熟异常及心力衰竭
作者进一步研究体外Mettl1敲低对大鼠乳鼠心肌细胞成熟的影响。脂肪酸(油酸(OA)/棕榈酸(PA))被用来促进大鼠乳鼠心肌细胞的成熟,表现为更长的肌节、更好的肌节组织和更高的钙瞬态振幅。而Mettl1敲低显著损害了由脂肪酸(OA/PA)诱导的上述心肌细胞成熟表型。此外,M1cKO小鼠发展为心力衰竭,并呈现为心室扩张,它们在12至17周龄之间死亡。
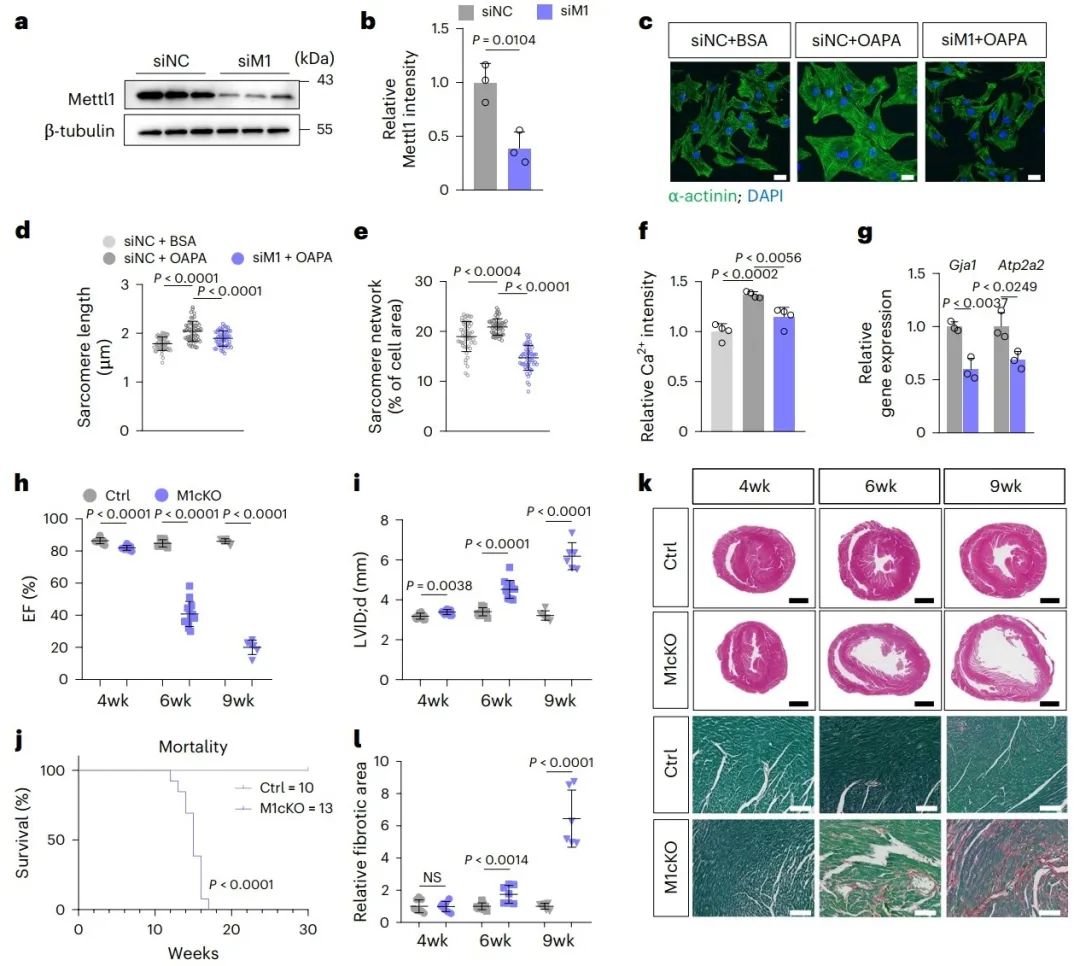
3. Mettl1缺失在心脏中诱导异常的代谢重编程
为了进一步探究Mettl1缺失损害心肌细胞成熟的潜在原因,转录组测序分析显示M1cKO小鼠心脏中异常的代谢重编程,具体表现为脂肪酸代谢和氧化磷酸化基因的下调和糖酵解基因的上调。后续的代谢组学分析和体内检测进一步证实了上述发现。
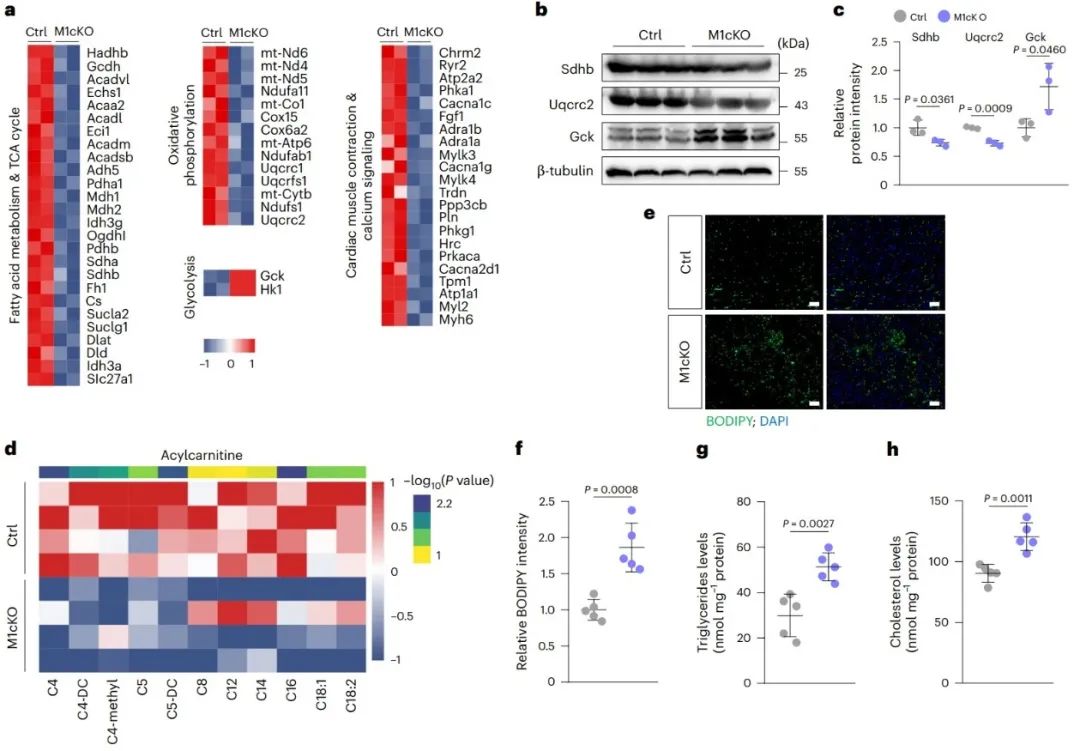
4. Mettl1调控新生心肌细胞的脂肪酸代谢
为了评估体外脂肪酸(OA/PA)刺激下,Mettl1敲低的大鼠乳鼠心肌细胞中的代谢改变,研究发现Mettl1敲低促进了心肌细胞内的脂滴积累,甘油三酯和胆固醇水平升高。后续实验发现上述现象归因于Mettl1敲低导致的心肌细胞脂肪酸氧化(FAO)受损,而非脂肪酸摄取增加和甘油三酯周转失调。而这最终导致了心肌细胞能量生成受损。
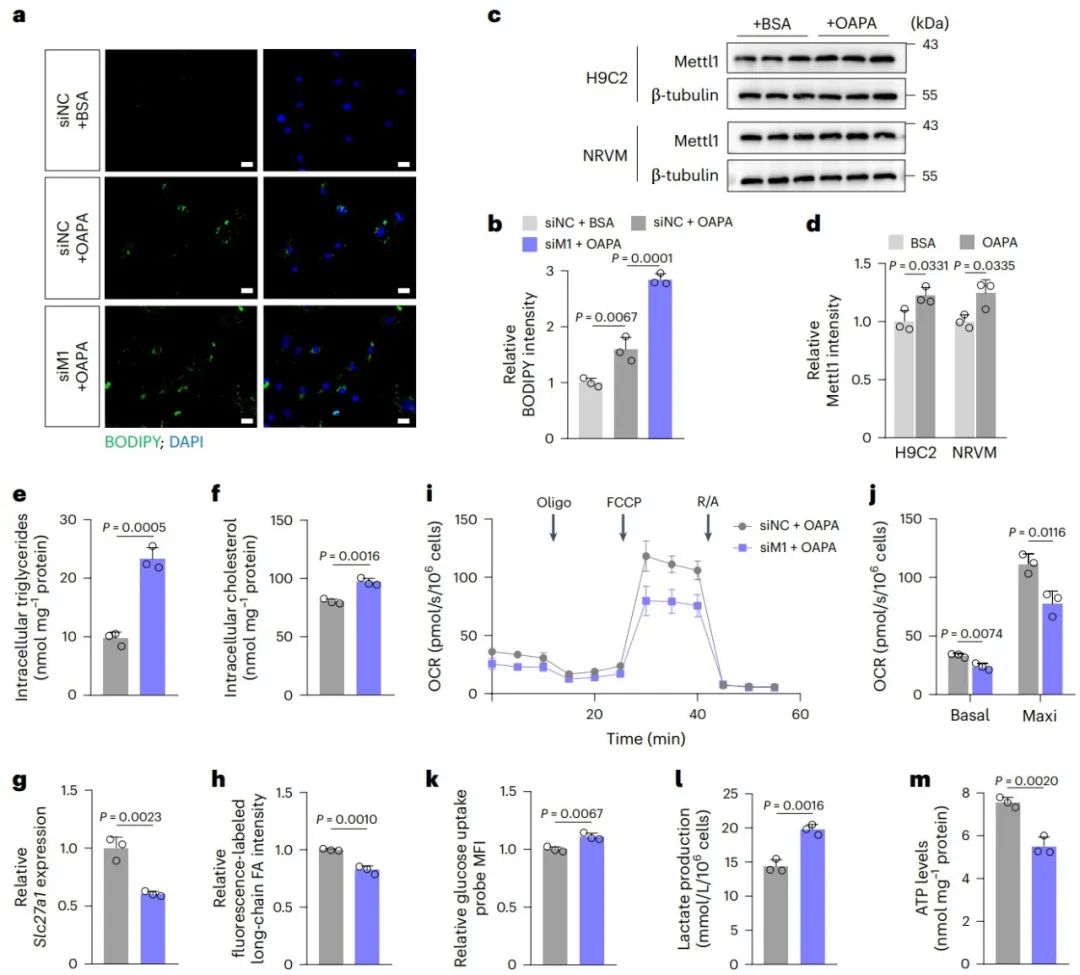
5. Mettl1通过tRNA m7G调控mRNA翻译
以往的研究表明,Mettl1通过行使tRNA m7G修饰功能而发挥重要作用。为了揭示Mettl1调控代谢的潜在分子机制,研究评估了M1cKO心脏中tRNA m7G修饰情况。TRAC-seq (tRNA reduction and cleavage sequencing)和Northern blot显示M1cKO心脏中,绝大多数m7G修饰tRNA的表达量下降,而非m7G修饰tRNA的表达量基本未变。基于tRNA在翻译中的作用,研究结合Ribo-seq分析发现,M1cKO心脏中翻译效率(translation efficiency, TE)下降的mRNA具有更高的m7G密码子频率,而这些mRNA富集到代谢和线粒体相关通路,其蛋白产物主要定位在线粒体。
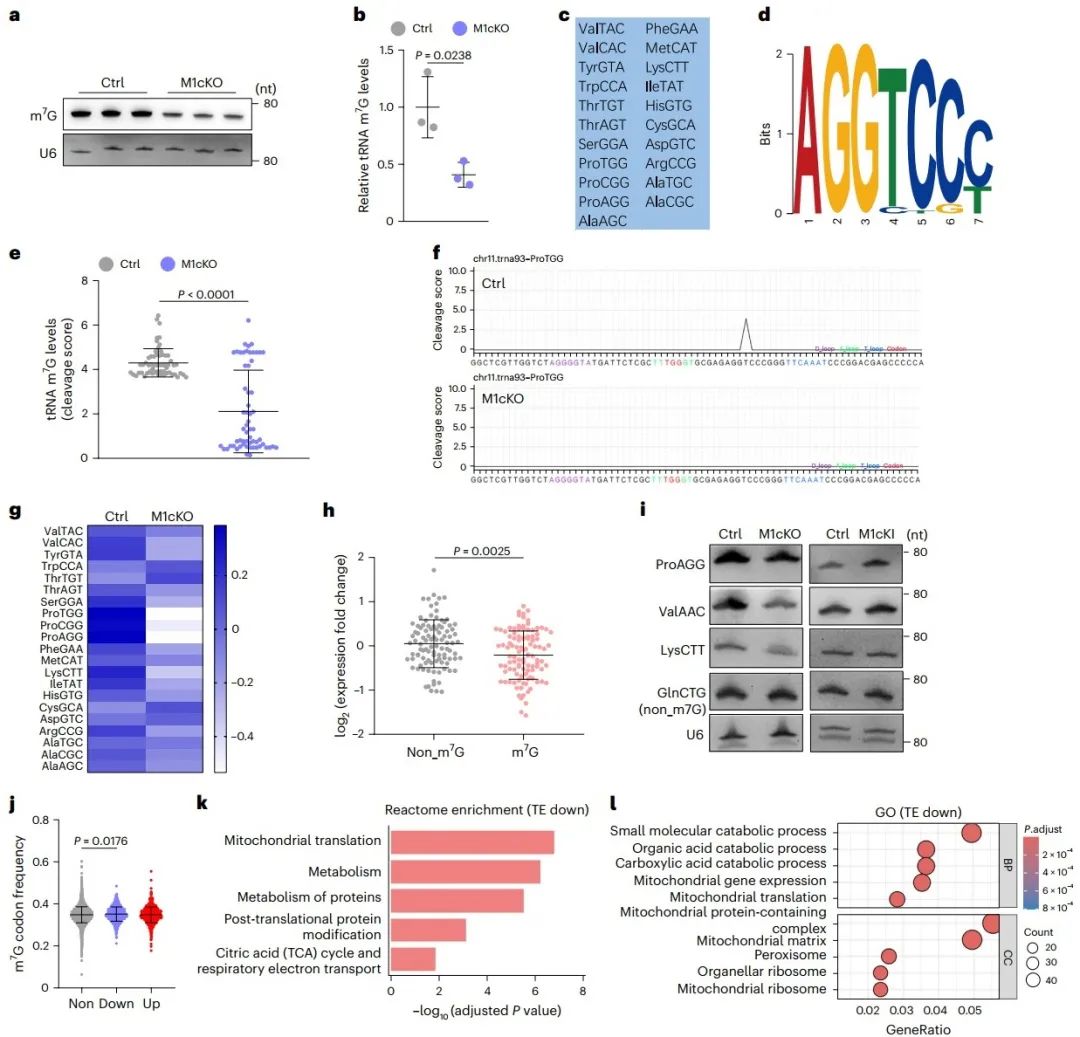
6. Mettl1通过影响Hmgcs2翻译控制新生心脏酮体生成
为了寻找Mettl1翻译调控的主要靶标,研究从定义的四个基因/蛋白集合的交集中筛选出4个候选分子,而其中Hmgcs2的蛋白水平在新生心脏中达到峰值,而且表达量远超过其他分子,提示其在心肌细胞成熟中的潜在重要作用。随后,研究分别在三种小鼠品系(M1cKO; M1iKO; M1cKI)中验证了Mettl1对Hmgcs2的翻译调控。基于Hmgcs2是酮体生成的限速酶,研究评估了酮体生成终产物β-羟基丁酸(β-HB)的水平。尽管肝脏被认为是成年时期酮体生成的主要器官,研究发现新生小鼠的心脏相比于肝脏具有更高的β-HB水平。此外,M1cKO新生小鼠心脏中的β-HB水平显著下降,而血清中的含量不变。以上结果提示,Mettl1介导的tRNA m7G修饰通过影响Hmgcs2翻译控制新生心脏酮体生成,这可能对心肌细胞成熟至关重要。
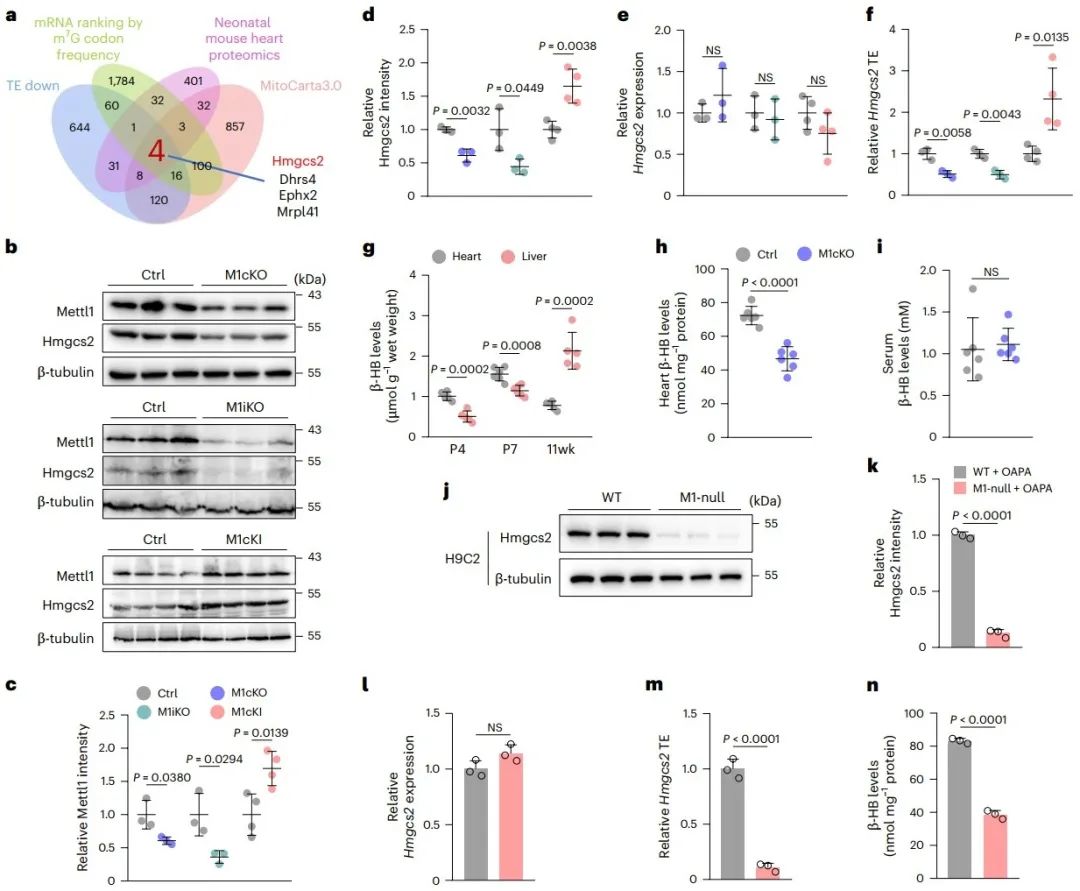
7. 纠正酮体生成缺陷可以挽救由Mettl1缺失引起的心肌细胞成熟异常
为了评估酮体生成缺陷是否是Mettl1缺失引起的心肌细胞成熟异常的主要原因,研究发现在脂肪酸(OA/PA)处理的Mettl1敲低的大鼠乳鼠心肌细胞中,补充β-HB和过表达Hmgcs2均能改善Mettl1敲低引发脂肪酸代谢紊乱和心肌细胞成熟异常。此外,在M1cKO小鼠出生后前两周连续补充β-HB同样改善了M1cKO心脏的脂肪酸代谢紊乱和心肌细胞成熟异常,并显著改善左心室扩张、心肌纤维化和心功能受损的心衰表型。
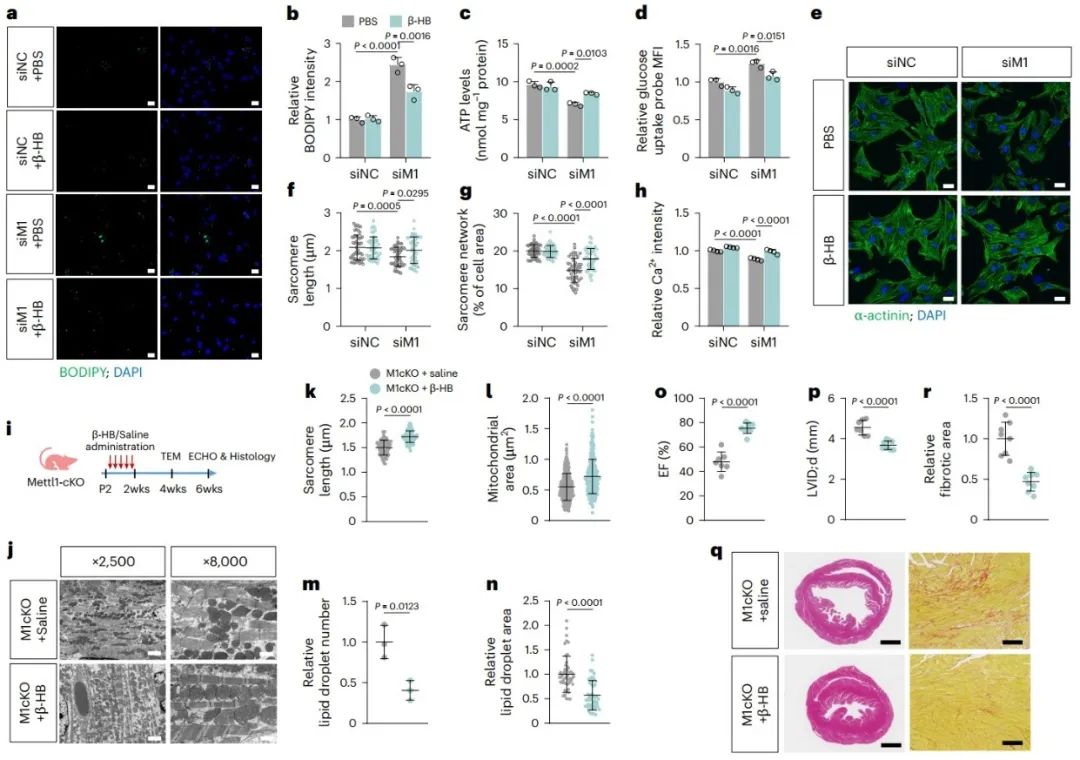
8. β-HB介导的K-bhb调控TCA循环蛋白的酶活性
研究进一步探究了Mettl1缺失引起的酮体生成缺陷影响脂肪酸代谢的机制。之前的研究表明,酮体不仅可以作为能量底物,还可以通过蛋白质的赖氨酸β-羟基丁酰化(K-bhb)作为信号转导分子。通过K-bhb修饰组学分析和免疫沉淀验证,发现在Mettl1缺失的心肌细胞中TCA循环相关酶(Idh2、Sucla2、Etfa和Mdh1)的K-bhb修饰下调。酶活性测定发现,Mettl1缺失引发的K-bhb修饰下调导致线粒体IDH、琥珀酰辅酶A合成酶(SCS)和胞质MDH的酶活性下降。分子动力学模拟显示上述酶的K-bhb修饰减小了催化底物的空间距离,增强了酶活性。上述结果表明,β-HB介导的K-bhb增强TCA循环蛋白的酶活性。
结论
该研究发现,Mettl1通过调控限速酶Hmgcs2的翻译来调节酮体生成,从而控制心肌细胞出生后的成熟过程。该研究表明,新生心肌细胞中的酮体生成是一个关键过程,它通过K-bhb蛋白修饰调节TCA循环相关酶的活性,促进心肌细胞成熟期间代谢底物从葡萄糖向脂肪酸转变的相应代谢程序改变。
本研究获得中山大学附属第一医院的林水宾研究员、区景松教授、陈德猛研究员、董吁钢教授、廖新学教授和刘晨教授的指导和帮助。
黄展鹏研究员课题组的主要研究方向为心肌重构及心力衰竭中的基因调控网络,着重研究其中的翻译调控机制,并以探寻新的心肌肥厚及心力衰竭临床治疗干预靶标为目标。课题组的研究获国家重点研发计划项目(2021YFA1302500)、国家自然科学基金委联合基金重点项目(U23A20396)、面上项目(82270252;81873463)、广东省自然科学基金杰出青年项目(2019B151502003)等项目经费的支持。课题组近年来的在JCI、Cardiovasc Res、Mol Ther、STTT等中科院一区期刊发表多篇相关论著。课题组计划招收博士后2名及科研助理(可进一步招收为博士生)2名,有意加入团队的小伙伴请联系 huangzhp27@mail.sysu.edu.cn
全文链接:
https://www.nature.com/articles/s44161-024-00565-2
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)