首页 > 医疗资讯/ 正文
CAR-T的联合疗法
CAR-T已在淋巴瘤、骨髓瘤、白血病等部分血液肿瘤中得到巨大成功,在治疗自身免疫疾病方面也显示出了前景,但在实体瘤的治疗中仍面临肿瘤复发和疗效有限的问题。近期很多研究探索了CAR-T的联合策略(例如抗体、病毒和小分子),旨在提高疗效和减轻治疗相关毒性,以拓宽治疗领域并改善安全性。
近日,CAR-T细胞疗法先驱 Carl June 教授在《Cancer Cell》发表Commentary文章“CAR T cell combination therapies to treat cancer”,阐述了CAR-T治疗肿瘤的联合疗法,目的包括增强疗效和降低毒性。

CAR-T治疗的挑战
对于血液肿瘤,CAR-T的主要障碍在于持久性。虽然初始反应较为强烈,但长期预后存在异质性且肿瘤复发仍可发生。影响工程细胞寿命的因素包括记忆样T细胞亚群的存活、T细胞耗竭和细胞因子信号动力学。肿瘤细胞也可能发生演变并丢失靶抗原,从而逃逸CAR-T细胞(即抗原丢失复发)。CRS、ICANS和噬血细胞性淋巴组织细胞增生症(hemophagocytic lymphohistiocytosis,HLH,亦称巨噬细胞活化综合征[macrophage activation syndrome,MAS])等严重副作用也可发生,它们是由激活的T细胞和骨髓细胞分泌高水平促炎细胞因子所引起。
对于实体瘤,CAR-T细胞治疗的疗效受到解剖学和生理学障碍的限制,例如难以将T细胞递送到肿瘤部位以及复杂和负向的肿瘤微环境(TME)。TME以缺氧、酸性和免疫抑制细胞和分子的存在等因素为特征,可严重限制工程细胞功能并诱导T细胞耗竭。尽管CRS和ICANS在实体肿瘤中不太常见,但由于肿瘤和健康组织之间存在共同的抗原,因此on-target off-tumor风险仍存在。最近的临床试验显示出令人鼓舞的结果,例如针对神经母细胞瘤(NCT03373097)、恶性胶质瘤(NCT04196413和NCT02208362)和胃肠道肿瘤(NCT03874897)的特异性抗原的试验已显示出巨大的治疗潜力和临床效益,表明CAR-T细胞治疗实体肿瘤的能力不断增强。
CAR-T的联合策略
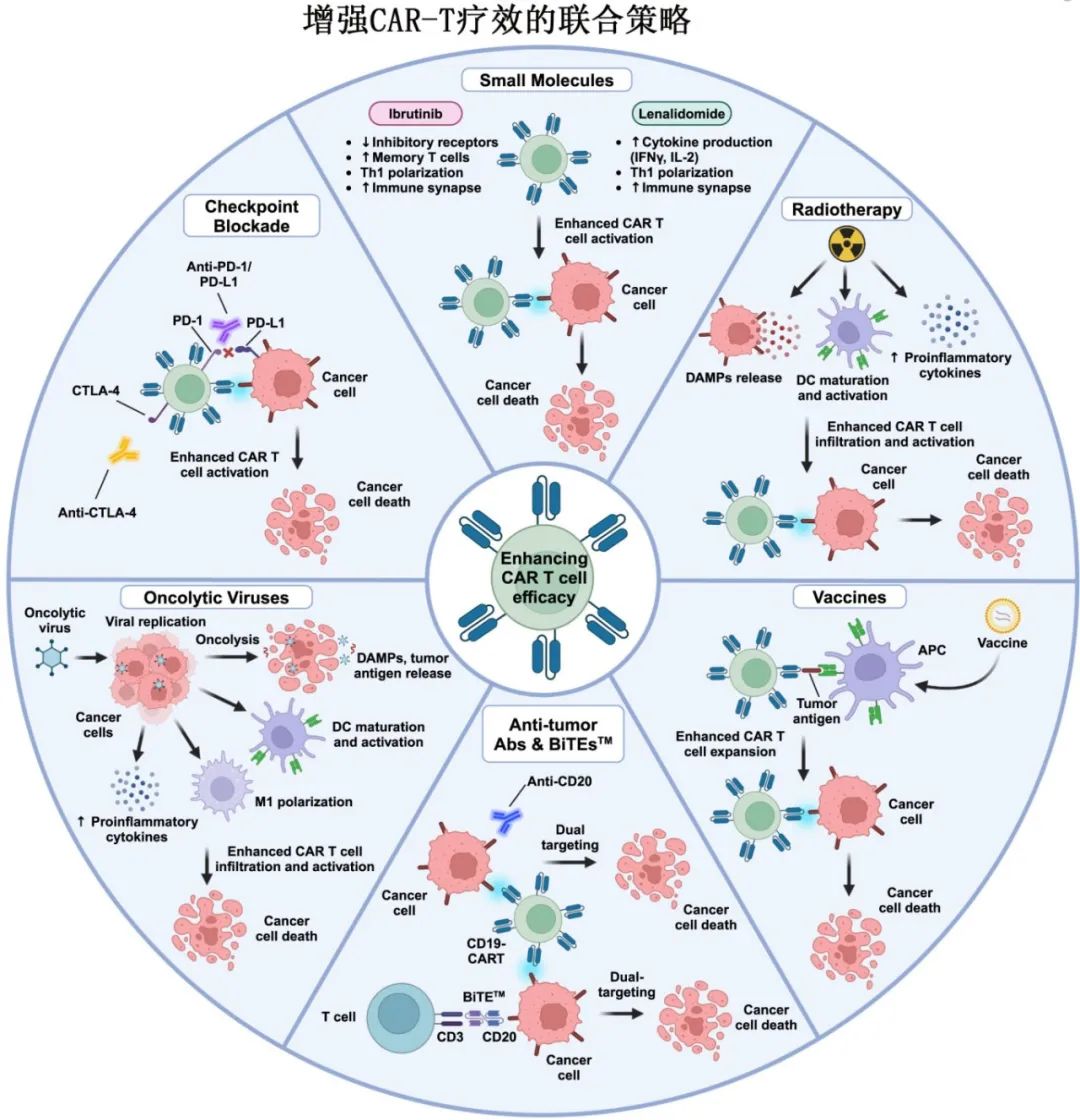
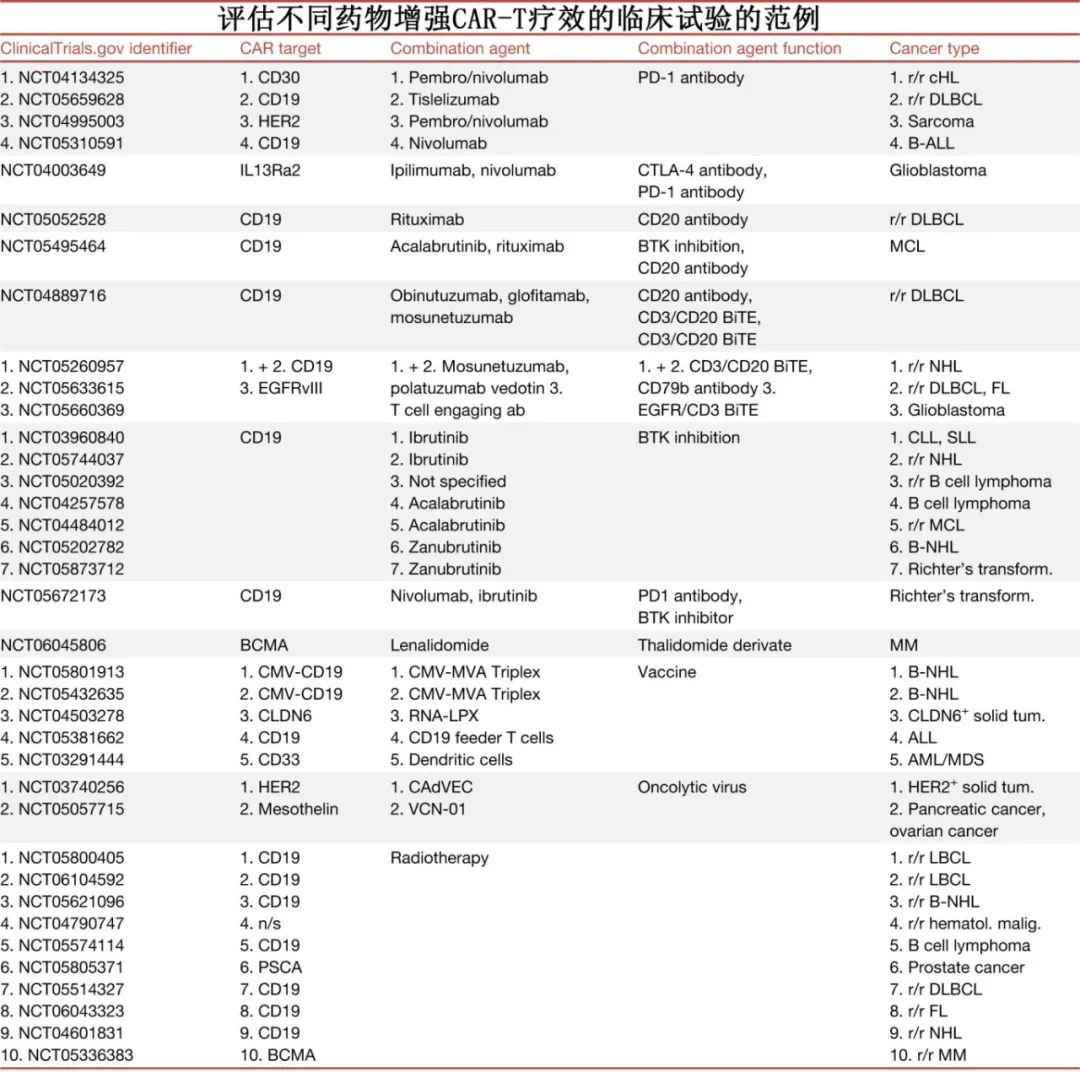
靶向免疫检查点以增强CAR-T细胞疗效
靶向PD-1和PD-L1的单抗可增强肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes,TIL)的功能,恢复其攻击癌细胞的能力。结合CAR-T细胞疗法,这些免疫检查点抑制剂(ICI)可以提高TME内工程细胞的持久性和疗效。
抗体和BITE靶向肿瘤以增强CAR-T细胞疗效
利妥昔单抗和奥妥珠单抗(靶向CD20的单抗)以及格菲妥单抗和mosunetuzumab(靶向CD3/CD20的双特异性T细胞衔接器[BiTE])已获批治疗不同的血液肿瘤,并且在联合CAR-T细胞使用时可以增强后者的疗效。将靶向CD20的抗体与靶向CD19/BCMA的获批CAR产品结合使用的双靶向策略,可以更有效地根除肿瘤细胞,降低抗原逃逸的风险。
使用小分子以增强CAR-T细胞疗效
除了抗体,一些小分子已经也获批用于治疗血液恶性肿瘤和实体瘤,其中部分正在与CAR - T细胞联合进行评估。包括伊布替尼和其他BTK抑制剂、来那度胺。
使用其他治疗药物和细胞因子以增强CAR-T细胞疗效
癌症疫苗可激活免疫系统对抗肿瘤细胞,在临床试验中显示出潜力,特别是当与其他免疫疗法(如ICI)联合使用时。临床试验目前正在研究将CAR-T细胞与疫苗治疗结合使用;疫苗可以特异性靶向CAR-T细胞,以增强其激活、增殖和持久性。
溶瘤病毒(OV)疗法也越来越多地与其他免疫疗法联合使用。OV具有在肿瘤细胞中选择性复制的独特能力,同时不影响健康细胞,并且可以通过基因修饰产生各种治疗药物,如白细胞介素、抗体和肿瘤抑制因子。OV联合CAR-T细胞疗法在临床前研究中显示出克服肿瘤免疫抑制的潜力,临床试验正在评估该组合在实体瘤中的疗效。
放疗是另一种有吸引力的联合治疗方法,因其在不同肿瘤类型中的广泛适用性、非侵入性和消除肿瘤细胞的有效性而受到重视。放疗可以作为CAR-T治疗前有效的减瘤和桥接方案,也可以作为复发后挽救治疗的可行选择。
CAR-T细胞疗法的最新进展也集中于细胞因子的使用上。所谓的“装甲”CAR-T细胞设计成共同表达细胞因子(例如IL-12、IL-15、IL-18、IL-21),在提高疗效和持久性方面显示出较大希望。细胞因子的持续分泌可引起安全问题,但可以通过工程CAR-T细胞仅在激活时分泌细胞因子或采用正交细胞因子系统(例如正交IL-2受体 CD19 CAR-T)来缓解。
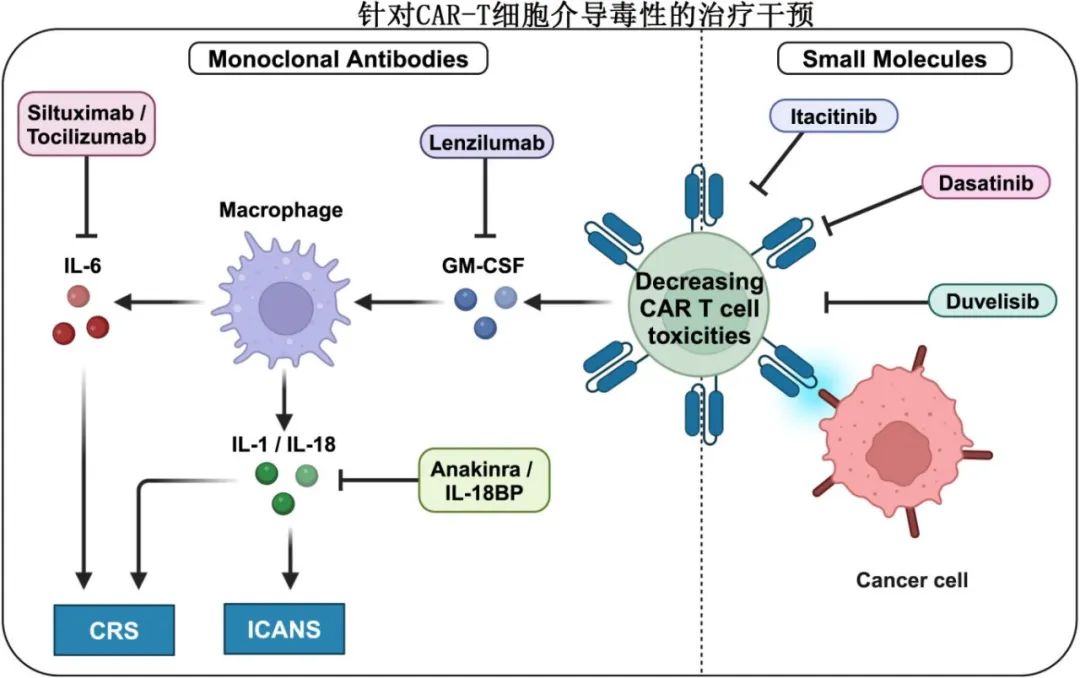
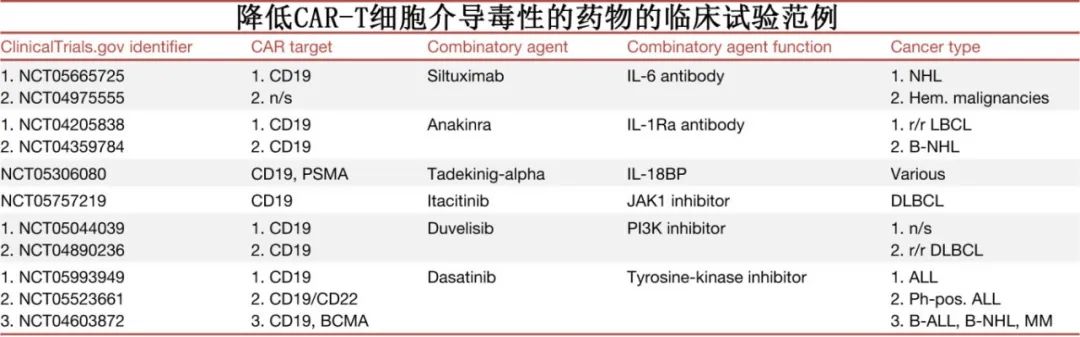
通过单抗降低CAR-T毒性
靶向CRS或ICANS相关细胞因子的抗体在管理相关毒性方面有效。托珠单抗目前FDA批准的唯一一种治疗CRS的药物,但无法充分降低ICANS。皮质类固醇可以减轻ICANS的严重程度,尽管由于对CAR-T细胞疗效的潜在不利影响,其使用一直存在争议。然而,目前的共识是皮质类固醇不会损害检查点疗法或CAR-T细胞疗法的疗效,因此目前的临床试验主要侧重于解决ICANS问题。研究正在探索另一种靶向IL-6的抗体司妥昔单抗在CAR-T细胞输注之前和之后出现副作用时的应用。
靶向IL-6/IL-6R以外的细胞因子治疗ICANS也值得关注。Anakinra是一种IL-1受体拮抗剂,临床前研究证实可有效消除CRS和ICANS,正在进一步探索在管理神经毒性方面的作用。
髓系细胞是参与CRS和ICANS的促炎细胞因子的重要生产者。Lenzilumab是一种靶向粒细胞-巨噬细胞集落刺激因子(GM-CSF)的拮抗剂,在临床前模型中显示出降低CRS和ICANS的潜力,同时提高CAR-T细胞的疗效。针对复发或难治性LBCL患者的1/2期临床试验证实,lenzilumab可剂量依赖性地降低促炎髓细胞相关细胞因子的血清浓度。
通过小分子降低CAR-T毒性
小分子药物Itacitinib可以通过其作为Janus激酶1 (JAK1)的选择性抑制剂的作用,潜在地降低CAR-T细胞治疗介导的毒性。JAK1是介导各种细胞因子信号通路的关键酶,参与免疫激活和炎症。通过抑制JAK1, itacitinib可以调节细胞因子如IL-6和IFN-g激活的信号通路,从而有助于减轻炎症反应。
另一个有希望降低CAR-T细胞治疗相关毒性的候选药物是duvelisib,其对磷酸肌苷激酶(PI3K)的抑制作用影响T细胞的功能和存活,也影响巨噬细胞和树突状细胞等其他免疫细胞的功能和存活,因此可以减少细胞因子的产生。
达沙替尼是一种酪氨酸激酶抑制剂,最初开发用于靶向BCR-ABL,也影响广泛的其他激酶,包括Src家族的激酶,这些激酶对T细胞的激活和功能至关重要,其抑制Src家族激酶的能力使其能够调节T细胞的激活和增殖。达沙替尼在控制CAR-T细胞毒性以及对抗CAR-T细胞耗竭方面具有潜在效用。
总结
尽管在大多数已发表的临床试验中患者队列较小,但联合方法仍显示出推进CAR-T细胞治疗血液恶性肿瘤和实体瘤的希望。通过靶向涉及复发和肿瘤逃避的多种通路,这些方法旨在改善疗效并克服耐药性。除了上面讨论的联合治疗之外,其他联合治疗方法也有希望但尚未进入临床开发,包括:干扰素基因刺激剂(STING)激动剂,可以刺激先天免疫反应并增强CAR-T细胞的疗效;ICI靶向LAG-3、TIM-3和TIGIT,可以帮助克服TME内不同的免疫抵抗机制;各种小分子。此外,表观遗传调节剂(如HDAC和EZH2抑制剂)可改造TME,增加肿瘤抗原表达和减少免疫抑制机制,从而提高CAR-T细胞治疗的疗效;一项临床试验目前正在评估西达本胺作为CAR-T细胞的桥接疗法。
联合治疗方法还可以通过降低毒性来提高治疗指数。另一种可能提高CAR-T细胞安全性的联合疗法尚未在临床试验中评估,包括使用靶向IFNγ的单克隆抗体。特别值得注意是,HLH/MAS是由过量的IFNγ释放驱动的,因此靶向IFNγ的单克隆抗体可以显著减少与HLH/ MAS及CRS和ICANS相关的高炎症,在不影响CAR-T细胞抗肿瘤功效的情况下改善患者预后。然而需要注意的是,IFNγ信号对于CAR-T细胞治疗实体瘤的疗效至关重要,但在血液系统恶性肿瘤中则不然,这使得IFNγ抗体的使用在后一种情况下特别有益。
CAR-T细胞疗法与其他疗法相结合的潜力是巨大的,包括极为广泛的选择。考虑到这些组合的不同机制和好处,很难确定两种组合之间哪种更优。临床和临床前持续研究对于实现CAR-T细胞联合疗法在肿瘤治疗中的全部潜力至关重要。此外,诸如优化给药方案、最小化额外毒性和识别预测性生物标志物等挑战也仍有待解决。正在进行的临床试验将为CAR-T细胞联合治疗的安全性、有效性和长期结局提供有价值的见解,最终指导肿瘤免疫治疗的未来。
参考文献
Uslu et al., CAR T cell combination therapies to treat cancer, Cancer Cell (2024), https://doi.org/10.1016/j.ccell.2024.07.002
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)