首页 > 医疗资讯/ 正文
卒中导致血管事件复发的持续高风险,这是由内皮细胞(EC)激活引起的系统性动脉粥样硬化进展。然而,中风是否以及如何在全身血管中诱导持续的促炎和促动脉粥样硬化内皮改变仍然知之甚少。
2024年7月29日,天津医科大学刘强、艾玎、周洁共同通讯在Immunity在线发表题为“Brain ischemia causes systemic Notch1 activity in endothelial cells to drive atherosclerosis”的研究论文,该研究表明脑缺血引起内皮细胞的系统性Notch1活性,从而驱动动脉粥样硬化。
研究发现,脑缺血诱导持续激活,粘附分子VCAM1上调,外周ECs衰老增加,直到中风发作后4周。这种异常的EC活性是由持续的Notch1信号引起的,Notch1信号是由小鼠和人类中风后循环Notch1配体DLL1和Jagged1增加引发的。因此,这通过产生衰老的促炎内皮导致骨髓细胞粘附增加和动脉粥样硬化进展。Notch1-或VCAM1阻断抗体和内皮Notch1基因消融可减少卒中后动脉粥样硬化的进展。该研究结果揭示了卒中后诱导外周ECs持续激活的系统性机制,这为治疗干预或预防卒中后血管事件复发铺平了道路。

卒中导致系统性血管区域动脉粥样硬化性血栓事件复发的风险显著增加。在中风幸存者中,5年内复发的风险高达30%,大约是普通人群中风风险的9倍。第一次中风后的早期风险特别高,即1年后高达15%,约为一般人群风险的15倍。这些研究结果表明,中风会导致全身血管不良反应,即使在首次中风后数年仍会升高。中风会激活免疫系统,导致全身血管炎症。最近的证据表明,脑缺血调动促炎单核细胞,并加速它们在卒中初始发作后进入外周动脉斑块。虽然中风诱导的单核细胞活化及其进入外周动脉斑块已经被描述过,但对中风后内皮特异性改变及其对动脉粥样硬化进展的潜在影响知之甚少。
作为动脉粥样硬化的驱动因素,内皮细胞(ECs)控制着动脉粥样硬化发生的部位特异性,并表达粘附分子来指导髓细胞进入病变部位。卒中后持续的血管炎症和加剧的全身动脉进展提示,急性缺血性脑损伤可能使整个血管系统促进单核细胞进入斑块并加剧斑块扩张,从而导致卒中复发的风险增加,并增加对进一步脑血管或心血管事件的易感性。在这方面,仍有若干关键问题有待解决。
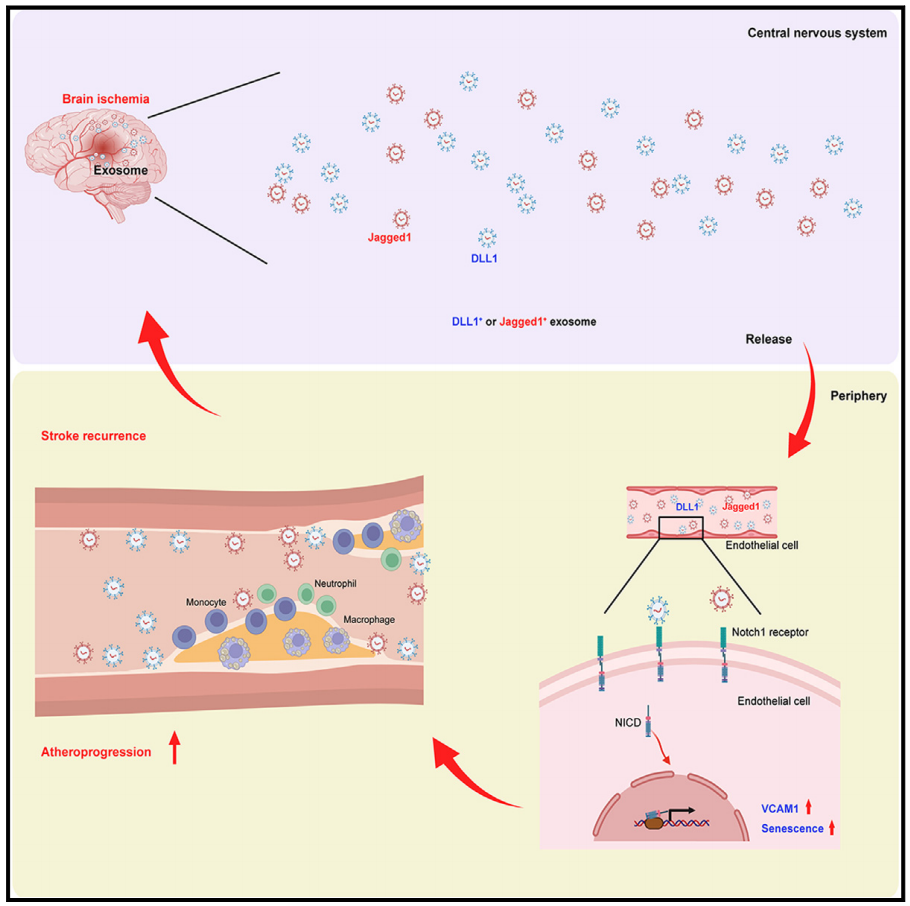
机理模式图(图源自Immunity )
首先,中风后内皮特异性改变的动态尚不清楚,这对于了解内皮细胞是否可能对血管炎症和动脉粥样硬化进展产生长期影响至关重要。其次,中风后驱动内皮特异性改变的特定信号将被识别,这些信号如何传递到外周内皮细胞以产生全身血管反应?第三,控制单核细胞聚集到周围斑块病变的内皮机制仍然相对未被探索。最后,中风后增加的远端斑块炎症是否可以通过靶向内皮特异性改变来抑制仍不确定。
在这项研究中,作者发现脑缺血诱导外周内皮Notch1信号的持续激活,中风导致全身内皮细胞的激活和EC粘附分子的上调。这些过程导致单核细胞募集和内皮细胞粘附增强,从而加速脑卒中后斑块进展。EC Notch1激活或VCAM1介导的白细胞粘附的破坏可抑制这些不利的全身EC变化。该研究结果揭示了中风后血管事件复发风险增加的机制,并确定了可能作为潜在治疗靶点的可调节过程。
参考信息:
https://www.cell.com/immunity/abstract/S1074-7613(24)00351-0
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)