首页 > 医疗资讯/ 正文
在患有棘皮动物微管相关蛋白样4(EML4)-间变性淋巴瘤激酶(ALK)重排的晚期肺腺癌(LADC)患者中,与化疗相比,一线靶向治疗通常表现出优越的疗效。在对ALK酪氨酸激酶抑制剂(TKI)产生耐药性后,采用含铂双药或与贝伐珠单抗联合治疗的方案通常有效。然而,在TKI和含铂疗法产生耐药性后,替代方案有限。鉴于大多数ALK阳性非小细胞肺癌(NSCLC)为LADC,TKIs对ALK阳性肺鳞状细胞癌(LSCC)患者的疗效以及鳞癌患者的最佳治疗策略仍然存在争议。在本案例研究中,报告了一名晚期LSCC患者,通过基因检测发现该患者携带EML4-ALK重排。该患者接受了克唑替尼和阿来替尼治疗,尽管无进展生存期(PFS)有限,但一线和二线ALK-TKI治疗均显示出有效性。随后患者对第二代TKI产生耐药性,通过CT扫描检测到左颈部区域存在肿瘤。活检病理显示为非鳞状细胞癌,随后含铂双药治疗无效。再次进行基因检测,下一代测序(NGS)结果显示ALK阴性,但程序性死亡配体1(PD-L1)高表达。随后开始免疫治疗,实现了超过 29 个月的无进展生存期(PFS)和临床完全缓解(cCR)。该病例强调了ALK-TKI对ALK阳性LSCC患者的潜在价值。对第二代TKI的耐药性可能会导致ALK阴性和组织学转化,这凸显了TKI耐药后重复活检以做出正确治疗决策的必要性。截至 2023 年 11 月,影像学检查仍表明患者实现cCR,生存时间超过 47 个月。
背 景
肺癌仍然是全球癌症治疗中最重要的挑战。在这一领域内,非小细胞肺癌(NSCLC)是主要亚型,约占所有肺癌病例的 85%。NSCLC主要表现为两种病理形式:肺鳞状细胞癌(LSCC)和肺腺癌(LADC)。随着对非小细胞肺癌(NSCLC)认识的不断进展,开创了基于分子结果个性化定制治疗的时代,特别需要关注在肿瘤发展中起关键作用的驱动基因。基于特定驱动基因突变的靶向治疗可提高患者的客观缓解率(ORR)和无进展生存期(PFS),从而提高患者总体生活质量并延长总生存期(OS)。NSCLC中的一个重要驱动基因是间变性淋巴瘤激酶(ALK)融合,在大约 5% 的NSCLC患者中发现,主要在LADC亚组中。相反,ALK融合在LSCC中相当罕见。因此,ALK-酪氨酸激酶抑制剂(ALK-TKIs)在LSCC患者中的有效性仍不清楚,因为它们在临床研究中的代表性较低。本文讨论了一名晚期LSCC患者的案例研究,该患者携带EML4-ALK重排,该患者在ALK-TKI治疗失败后对抗PD-1免疫治疗有良好反应。
病 例
患者男,40 岁,无吸烟、饮酒史,于 2019 年 12 月就诊于中山市人民医院,主诉轻微干咳,持续两个多月;左胸轻微疼痛,持续一个多月。胸部CT扫描显示,左肺中央存在 42x21 mm肿块,伴有同侧肺门和纵隔淋巴结肿大、同侧胸膜结节和少量胸腔积液(图1 A1、B1)。通过磁共振成像(MRI)扫描进一步评估,存在椎骨转移(图1 C1)。在肝脏(图1 D1)或颅内(图1 E1)没有观察到转移性病灶。左肺肿块的病理检查证实为低分化LSCC。免疫组织化学分析显示CK、CK7、CKHMW、CK5/6、P63和CK7呈阳性染色,Ki-67指数为 40%(图2C)。然而,嗜铬粒蛋白A、Syn、CD56、NapsinA、CD4、CD8、CD20和甲状腺转录因子-1(TTF-1)呈阴性(图2C)。ARMS-PCR检测发现EML4-ALK融合(图2A)。左侧胸腔积液的病理学表明存在可疑的肿瘤细胞。该患者的ECOG体力状态评分为 1,鳞状细胞癌抗原(SCCA)水平为 3.2 ng/ml(正常范围:0.6-2.3 ng/ml)。
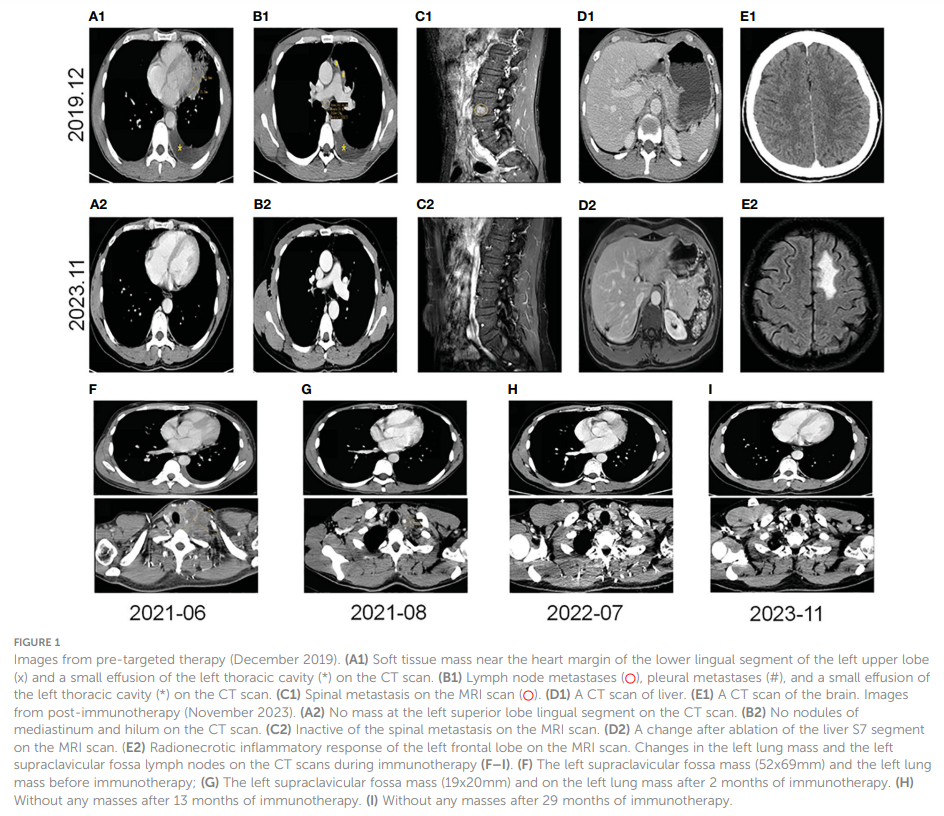
▲图1 靶向治疗前的影像
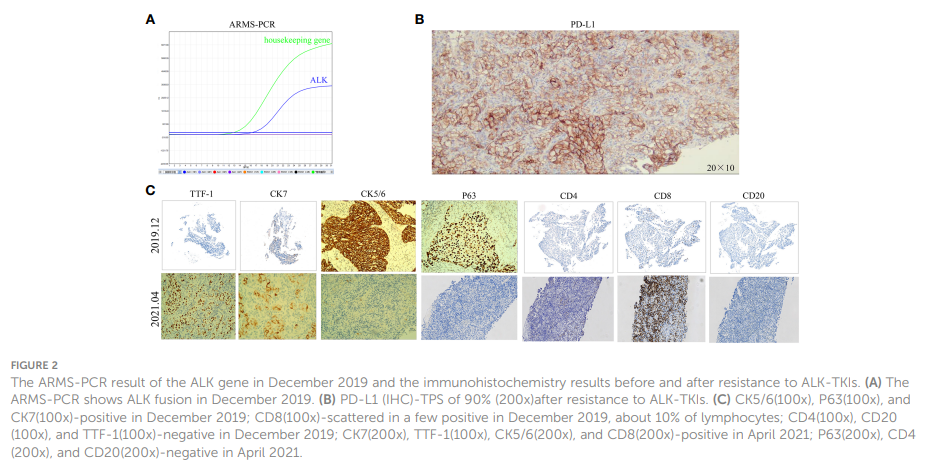
▲图2 2019年12月ALK基因ARMS-PCR检测结果,和耐药前后的免疫组化结果
该患者确诊为IVB期ALK阳性晚期LSCC(cT2bN2M1c)。随后,患者于 2019 年 12 月接受克唑替尼治疗(250mg BID[每天两次])。2020 年 3 月CT扫描显示左侧肿块(22x13 mm)、纵隔和左肺门淋巴结以及胸膜结节缩小。同时,MRI扫描发现肝S7段存在结节,疑似转移(11×10 mm,图3A)。根据RECIST v1.1版标准,评估为疾病进展(PD)。患者体力状态评分仍为 1。2020 年 3 月,患者在继续克唑替尼治疗的同时,接受了针对肝转移灶的射频和化疗消融术。2020 年 7 月,MRI扫描显示肝S7段转移灶在治疗后发生变化,包括凝固和坏死。然而,在左侧额叶发现了一个新的T2W-FLAIR高信号灶,直径约为 4.6 mm,表明存在潜在的脑转移。再次评估为PD。患者当时的PS为 1。因此,治疗方案于 2020 年 7 月改为阿来替尼(600mg BID)。2020 年 8 月和 10 月的脑部MRI检查显示没有脑转移相关证据。然而,2021 年 1 月,患者出现间歇性头晕,MRI显示左侧额叶出现结节(9x9.5 mm),周围脑组织水肿,提示转移。2021 年 2 月 3 日至 2 月 7 日对脑转移瘤进行了立体定向放疗(SRS,3Gy/次,共30Gy),同时维持阿来替尼治疗。这一方案使患者的头晕症状得到改善。2021 年 8 月的脑部MRI显示左侧额叶肿块的变化与脑转移放疗后的效果一致。随后的定期评估表明,左侧额叶病变中没有活动性肿瘤,也没有新的脑转移灶。2020 年 6 月和 10 月CT扫描显示左肺肿块缩小。随后从 2020 年 10 月到 2021 年 6 月的定期CT扫描显示,该肿块的大小基本保持不变。然而,2021 年 4 月,患者发现其颈部左侧有肿块,并伴有严重声音嘶哑和中度头晕等症状。此时CT扫描显示左肺肿块大小无明显变化,但左侧锁骨上窝淋巴结明显融合成一个较大的肿块,尺寸为 32×47 mm(图3B)。基于这一观果,研究人员怀疑出现疾病进展。对左侧锁骨上淋巴结进行穿刺活检。病理检查发现存在转移性低分化癌,可能起源于肺部。免疫组织化学分析表明,肿瘤细胞的细胞角蛋白(CK)、CK7、TTF-1、CK5/6、CD8和Ki-67呈阳性(60%)(图2C),而NapsinA、P40、P63、PAX-8、CD10、CgA、CD4、CD20、CD56、肝细胞、TG和BEER为阴性(图2C)。SCCA水平在正常范围内。2021 年 5 月 1 日至 5 月 22 日,患者接受GP化疗(第 1 天和第 8 天吉西他滨1.6g,第 1-3 天奈达铂 40 mg)以及重组人血管内皮抑制素(恩度,210 mg)。化疗期间患者出现二级呕吐、腹泻,但未观察到血液学不良反应。2021 年 6 月。CT扫描(图1F)显示双侧肺门和左侧锁骨上窝淋巴结尺寸增大,尺寸为 52x69 mm,表明转移灶出现进展。评估为PD;该患者的PS评分为 3 分,并伴有持续的声音嘶哑和头晕。为了进一步研究,对左颈淋巴结和外周血样本进行了下一代测序(NGS)。NGS结果表明ALK融合阴性,而程序性死亡配体1(PD-L1)呈高表达(90%,图2B)。随后,患者于 2021 年 6 月 18 日和 7 月 9 日接受白蛋白结合型紫杉醇(400 mg,第 1 天)和PD-1单克隆抗体帕博利珠单抗(200 mg,第 1 天)治疗。2021 年 8 月,CT扫描显示肺结节几乎消失,左侧锁骨上窝结节大小减小至 19x20 mm(图1G)。然而,使用白蛋白结合型紫杉醇后,患者出现神经毒性和手足麻木,但没有出现血液毒性。患者选择放弃进一步化疗,继续使用帕博利珠单抗单药治疗直至 2023 年 7 月。患者的神经毒性症状在白蛋白结合型紫杉醇停药约三个月后消失。2021 年 8 月至 2022 年 3 月期间对患者进行了定期随访,评估为疾病稳定(SD)。2022 年 7 月的CT扫描(图1H)未发现肺部或锁骨上结节。2022 年 7 月至 2023 年 11 月的定期评估证实没有肺部或锁骨上结节。患者严重声音嘶哑的症状持续了一年左右,后来逐渐好转。2023 年 8 月,患者PS为 0,并在接受帕博利珠单抗治疗两年后,因经济原因选择改用信迪利单抗(PD-1单克隆抗体,200 mg)。截至 2023 年 11 月,胸部CT扫描显示没有可检测到的病变(图1 A2、B2),MRI扫描显示脊柱、肝脏和大脑没有活动性病变(图1 C2、D2、E2)。PS 0表示患者对治疗效果和目前的生活质量感到满意。治疗过程的时间线如图3C所示。图4显示了治疗过程中左肺、肝、脑、左锁骨上窝病灶的动态变化。
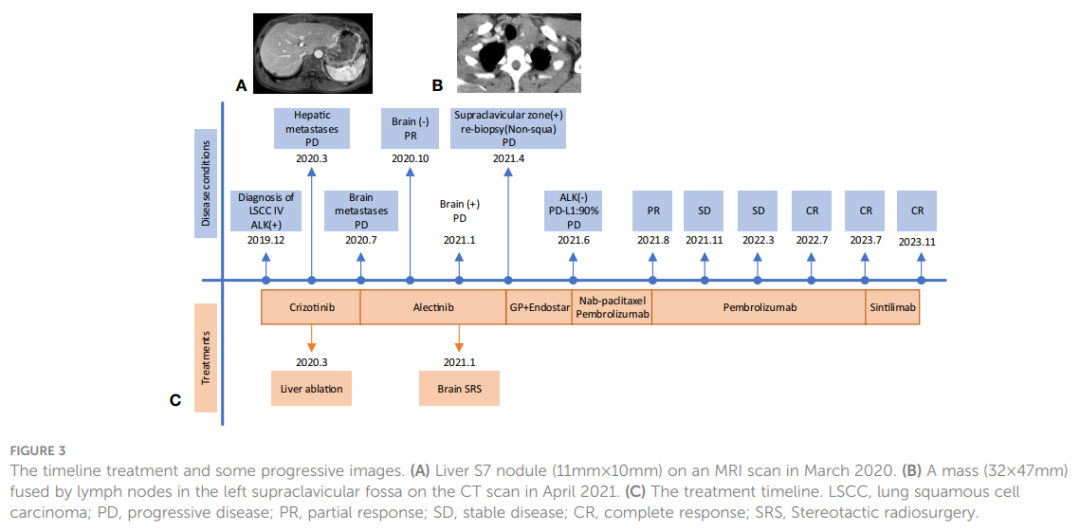
▲图3 治疗时间线和部分进展影像
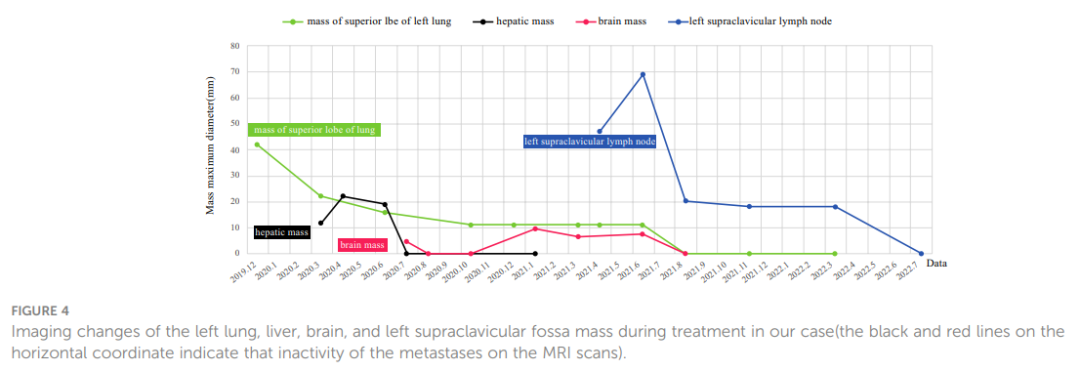
▲图4 治疗期间左肺、肝、脑及左锁骨上窝肿块的影像学变化
讨 论
在LADC和LSCC领域,ALK阳性病例相对较少,发生率分别低于 5% 和 1%。Lewis等人的一项研究。检查了 6 名患有EML4-ALK重排的LSCC患者,报告使用ALK-TKI作为一线或二线治疗时,中位PFS为 2.8 个月(范围为 1.8-6.3 个月),OS为 8.3 个月(范围为 3.2-32.1 个月)。Yuan等人记录了一例ALK阳性的晚期LSCC病例,使用一线阿来替尼治疗,获得 4.5 个月的PFS和 6 个月的OS。此外,Meng等人对 31 名ALK阳性LSCC患者进行了单中心病例回顾,其中 20 名接受ALK-TKI作为一线或后线治疗。该组的中位PFS为 6.4 个月(± 4.4 个月),明显短于接受ALK抑制剂治疗的ALK阳性LADC患者PFS。Lu等人回顾了 11 名ALK阳性LSCC患者,并指出,无论是用克唑替尼还是阿来替尼治疗,他们的PFS都比LADC患者更短。他们强调了一个案例,一名EML4-ALK(V1)融合和TP53共突变的患者接受了恩沙替尼治疗,实现了 19 个月的最长PFS,然后由于疾病进展和疗效下降而转用洛拉替尼。在本文研究中,接受一线或二线ALK-TKI治疗的ALK阳性LSCC患者的PFS与既往文献的结果一致,但生存时间超过 47 个月,超过所有类似报告。目前,患者的体能状态(PS)评分保持为 0。
脑转移(BMS)的治疗对ALK阳性NSCLC提出了重大的临床挑战。与表皮生长因子受体(EGFR)阳性NSCLC患者相比,ALK阳性NSCLC患者对BMS更敏感。这些患者中约 30% 在初次诊断时就出现中枢神经系统(CNS)转移,约 58% 在三年内出现中枢神经系统(CNS)转移。晚期ALK阳性NSCLC的一线标准治疗通常涉及ALK-TKI。然而,由于血脑屏障的穿透性较差,第一代ALK-TKI在控制脑转移方面的疗效有限。相比之下,第二代ALK-TKIs增强了血脑屏障的穿透性,可以更好地管理脑转移。因此,现在推荐第二代或第三代ALK-TKI作为无BMS的ALK阳性NSCLC患者的一线治疗,以降低发生BMS的可能性。BMS显著影响了患者的生活质量和生存预后。立体定向放疗(SRT)和SRS等放疗的进步提高了肺癌脑转移患者脑部放疗的精度。局部放疗不仅可以增强疾病控制,还可以增加血脑屏障的通透性。在本文案例研究中,一名晚期ALK阳性NSCLC患者在开始克唑替尼治疗 7 个月后出现脑转移。在改用阿来替尼后一个月内,脑转移就消失了。然而,在开始第二代ALK-TKI治疗 6 个月后,脑转移再次出现。为了解决这个问题,同时使用SRS与持续的系统性治疗一起使用。截至 2023 年 11 月,左额叶的转移灶没有表现出肿瘤活性,大脑中也没有检测到新的转移瘤。
在接受第二代ALK-TKI治疗后进展的ALK阳性NSCLC患者中,近一半的患者在临床复发时未检测到ALK突变。这表明出现了不依赖于ALK的耐药性,此类患者仅从下一代ALK-TKI中获得有限的益处。肿瘤向不同组织学亚型的转变通常与失去对最初致癌驱动因素的依赖有关,从而导致耐药性。尽管大多数新确诊的ALK阳性NSCLC病例是LADC,但在接受各代ALK-TKI治疗的患者中观察到向小细胞肺癌(SCLC)转化的情况。然而,这种情况并不常见,根据回顾性分析确定,这一情况的发生率低于 3%。迄今为止,只有 6 个病例报告记录了ALK阳性肺癌向SCLC的转化。ALK阳性NSCLC患者在发生组织学转化后,通常表现出快速的疾病进展,大多数情况下靶向治疗和化疗均无效。值得注意的是,只有一例记录在案的患者在ALK-TKI治疗后转化为SCLC,并对化疗和免疫治疗产生积极反应。Yan等人提出了一例PD-L1高表达的ALK重排阳性肺腺癌,在给予阿来替尼后转化为LSCC。报告表明,在靶向治疗的压力下,NSCLC转化为SCLC的可能性增加。在使用第二代ALK-TKI治疗后,这种转化似乎更加普遍,可能是由于肿瘤细胞在这些药物作用下暴露应激加剧,为了适应这种压力,细胞可能会发生生物学或组织学变化。由于ALK阳性LSCC的发生率较低,目前尚无ALK阳性LSCC组织学转化的病例报道。在本文病例中,患者在靶向治疗前表现出血清SCCA水平升高,在第二代TKI治疗后恢复正常。肿瘤病理由LSCC转变为非鳞状细胞癌,NGS未检测到ALK突变。尽管不能排除肿瘤异质性,但这可能表明存在不依赖ALK的耐药机制。第二代TKI耐药后,病情迅速进展,含铂化疗无效。然而,由于PD-L1高表达,患者对免疫治疗表现出显著反应。免疫治疗的PFS超过 29 个月,患者实现临床完全缓解(cCR),生存时间超过 47 个月。本文病例提出了一种治疗晚期ALK阳性LSCC的新方法。这再次暗示ALK-TKI耐药后可能会发生组织学转化,强调了对TKI耐药患者重复活检的重要性。
在这种情况下,虽然靶向治疗一开始有效,但PFS有限。值得注意的是,靶向治疗后,患者的肿瘤病理从LSCC转变为非鳞状细胞癌。此外,NGS没有发现任何基因突变。最可能的解释是TKI治疗期间对鳞状肿瘤细胞施加了更严重的选择压力,在克服了选择压力的进化过程后,TKI耐药的肿瘤细胞会更频繁地发生生物学变化。这些变化并没有消除肿瘤异质性的可能性,这是一个不可忽视的因素。患者转向免疫治疗后观察到显著改善。据研究人员所知,这是文献中报道的唯一一例ALK阳性晚期LSCC患者在接受ALK-TKI、局部治疗和免疫治疗后实现cCR的病例。然而,该病例存在一些局限性,例如缺乏ALK-TKIs治疗前肝转移灶的病理学和PD-L1表达水平。截至目前,患者的生存时间已超过 47 个月,凸显了这种治疗方案的潜在疗效。
参考文献:
Yang C, Zeng R, Zha Y, Li Y, Wang T, Zhao R, Li M and Zhang J (2024) Case report: Clinical complete response in advanced ALK-positive lung squamous cell carcinoma: a case study of successful anti-PD-1 immunotherapy post ALK-TKIs failure. Front. Immunol. 15:1360671. doi: 10.3389/fimmu.2024.1360671

猜你喜欢
- 如何维持夫妻间的亲密感
- JAHA:伴有房颤的心力衰竭患者使用SGLT2i和ARNi的情况分析
- 膝盖疼是缺钙吗
- 加强口岸城市新冠肺炎疫情防控工作
- 学生用脑过度有哪些能够补脑的食谱
- Signal Transduct Target Ther:PD-1抑制剂Toripalimab(特瑞普利单抗)联合化疗二线治疗晚期EGFR突变NSCLC一线TKI进展后显示良好抗肿瘤疗效和可控安全性
- 大蒜能够抑制幽门螺杆菌但是两种人不能吃
- 辉瑞又双叒顶刊发布RSV疫苗3期数据!NEJM:妊娠期注射RSVpreF疫苗预防婴儿RSV疾病
- 省局组织开展贴牌相关产品质量安全专项整治工作
- 男人如果有勃起障碍 女性应鼓励安慰共渡难关
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)