首页 > 医疗资讯/ 正文
本研究回顾性分析山东省肿瘤医院2011年1月1日至2021年12月31日收治的晚期NSCLC患者的病历资料,分析原发和获得性EGFR T790M突变患者的临床病理特征及预后差异,并且对合并其他突变的原发性T790M进行了亚组分析。
原发T790M突变患者中合并L858R突变的发生率为60.53%(23/38),合并19del突变的发生率为18.42%(7/38),合并脑转移的发生率为21.05%(8/38)。然而,获得性T790M突变患者中存在上述情况的发生率分别为36.53%(61/167)、58.68%(98/167)和44.31%(74/167),差异均有统计学意义(p<0.05)。两组的中位总生存期有显著差异,原发性T790M突变患者为33个月,而获得性T790M突变患者为48个月(p=0.030)。值得注意的是,在携带L858R共突变的患者中,获得性T790M突变患者接受第三代EGFR-TKIs治疗的中位至治疗失败时间显著长于原发突变患者(17个月vs. 9个月,p=0.009)。
原发性T790M患者具有独特的分子特征,预后较获得性T790M患者差。第三代EGFR-TKIs耐药可能与EGFR共突变有关。
研究背景
EGFR突变的非小细胞肺癌(NSCLC)是一种独特的分子亚型,其特征是EGFR基因的特异性变异。在东亚人群中EGFR突变率高于其他人群。既往研究表明,对于这些患者,第一代或第二代EGFR-TKI的疗效优于以铂类为基础的化疗,已被推荐作为EGFR突变的NSCLC患者的一线治疗。然而,大多数患者最终会在一年内产生耐药。一些潜在的机制包括EGFR受体的二次突变,c-MET、HER2扩增或组织学改变,如小细胞肺癌转化。获得性EGFR T790M突变是耐药的主要原因,约60%的患者存在T790M突变。此外,经典EGFR突变常与T790M突变共存,如第19号外显子缺失(19del)和第21号外显子L858R(L858R)等,对患者的预后产生不同的影响。例如,19del患者的生存预后被认为是优于L858R患者。分子特征可能对预测患者预后很重要。
原发T790M突变被证实存在于一小部分肿瘤细胞中。原发EGFR T790M突变患者对第一代TKIs治疗不敏感,预后差。这一人群的有效治疗仍然有限。本研究旨在比较原发EGFR T790M突变与获得性EGFR T790M突变患者的临床特征。
研究结果
研究人群和患者特征:
共有4287例NSCLC患者检测到EGFR突变。其中1704例患者患不可切除的III期或IV期疾病。363例患者存在EGFR T790M突变。经筛查,38例患者为原发性EGFR T790M突变,176例患者为获得性EGFR T790M突变。由于所有原发性EGFR T790M突变患者均处于IIIB期和IV期,为避免选择偏倚,仅保留了IIIB期和IV期获得性EGFR T790M突变患者(N=167)。EGFR T790M突变患者纳入最终分析,如图1所示。157例(76.59%)患者有可获得的突变数据。中位随访时间为26个月。
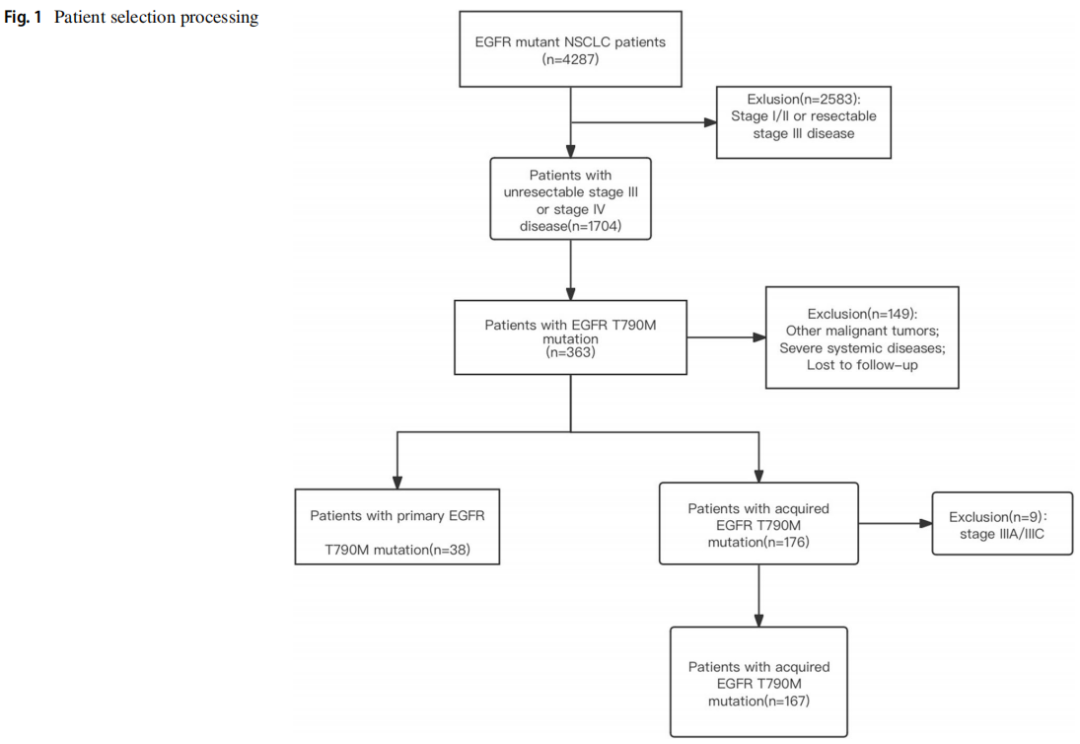
图1
如表1所示,原发T790M突变组中,女性占68.42%(26/38),男性占31.58%(12/38);84.21%(32/38)的患者无吸烟史;94.74%(36/38)为腺癌。89.47%(34/38)的患者在首次诊断时已发生远处转移。52.63%(20/38)患者采用NGS进行检测,其中73.68%(28/38)为组织学样本。L858R突变患者较19 del突变患者更易发生T790M突变(60.53% vs 18.42%)。将携带原发突变的患者分为L858R阳性组和L858R阴性组,如表2所示。两组患者性别差异有统计学意义。女性患者比男性患者更可能存在第21号外显子L858R突变(p=0.049)。在NGS亚组中(表3),30%(6/20)的原发性EGFR T790M突变患者存在TP53共突变。至随访结束,所有患者均存活。
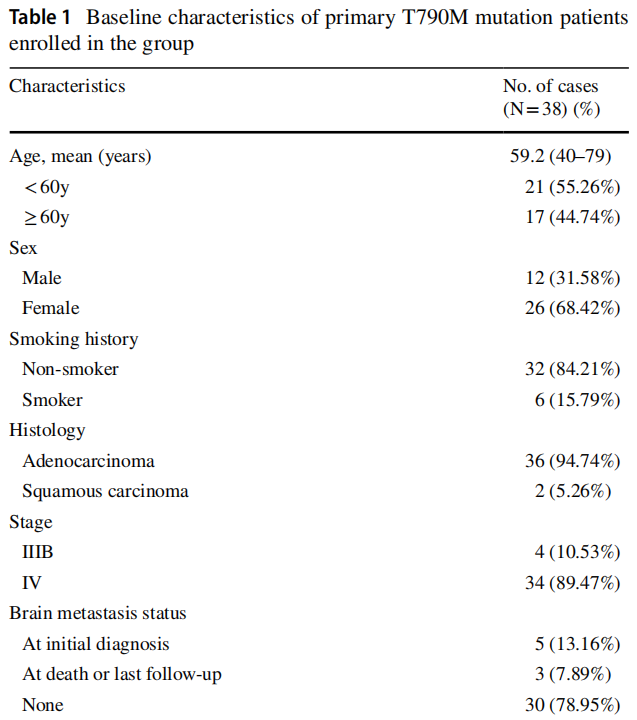
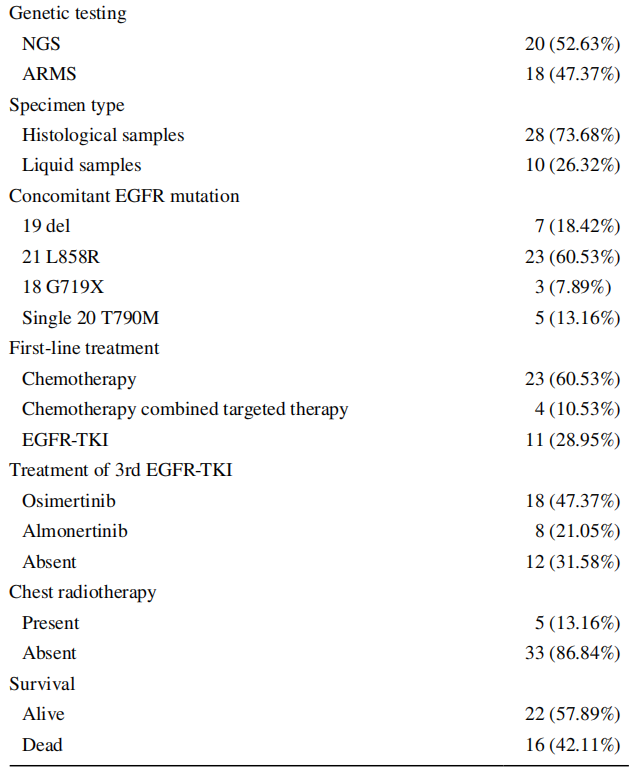
表1
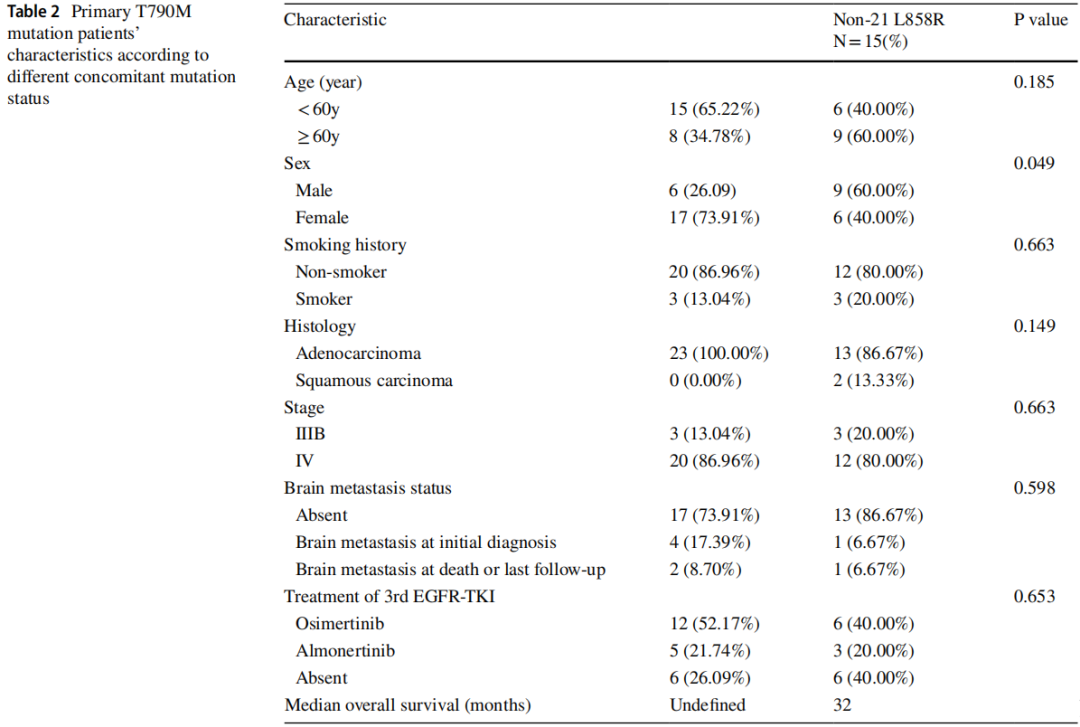
表2

表3
肿瘤反应和生存分析:
在一线治疗时,60.53%(23/38)的患者接受化疗,10.53%(4/38)的患者接受化疗联合靶向治疗,28.95%(11/38)的患者接受第三代EGFR-TKIs靶向治疗。68.42%(26/38)的患者在治疗过程中使用了第三代TKIs。队列的ORR为38.46%(10/26),DCR为80.77%(21/26),见表4。中位OS为33个月(95%CI:26.49-39.51,图2A),中位PFS为13个月(95%CI:6.36-19.65,图2B)。中位TTF(至治疗失败时间)为14个月(95%CI:8.74-19.23,图2C)。原发T790M突变患者接受第三代EGFR-TKIs治疗后的OS显著长于未接受第三代EGFR-TKIs治疗的患者(中位OS:未定义vs. 32个月,p=0.014,图2D)。单因素分析显示第三代EGFR-TKIs治疗为独立预后因素。然而,多变量分析表明这是不真实的(p=0.310,表5)。
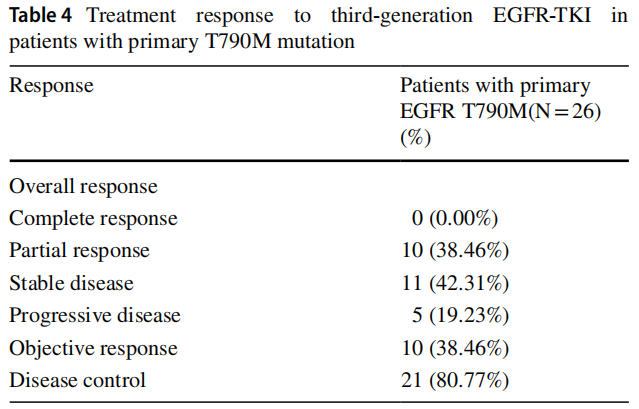
表4
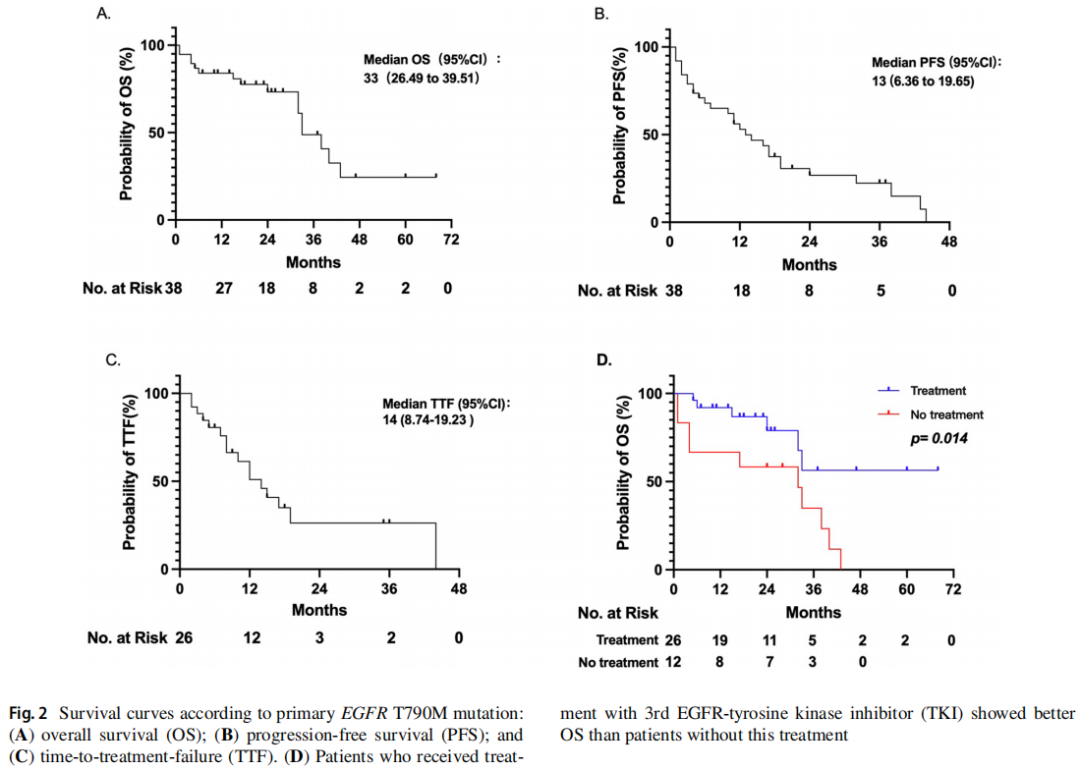
图2
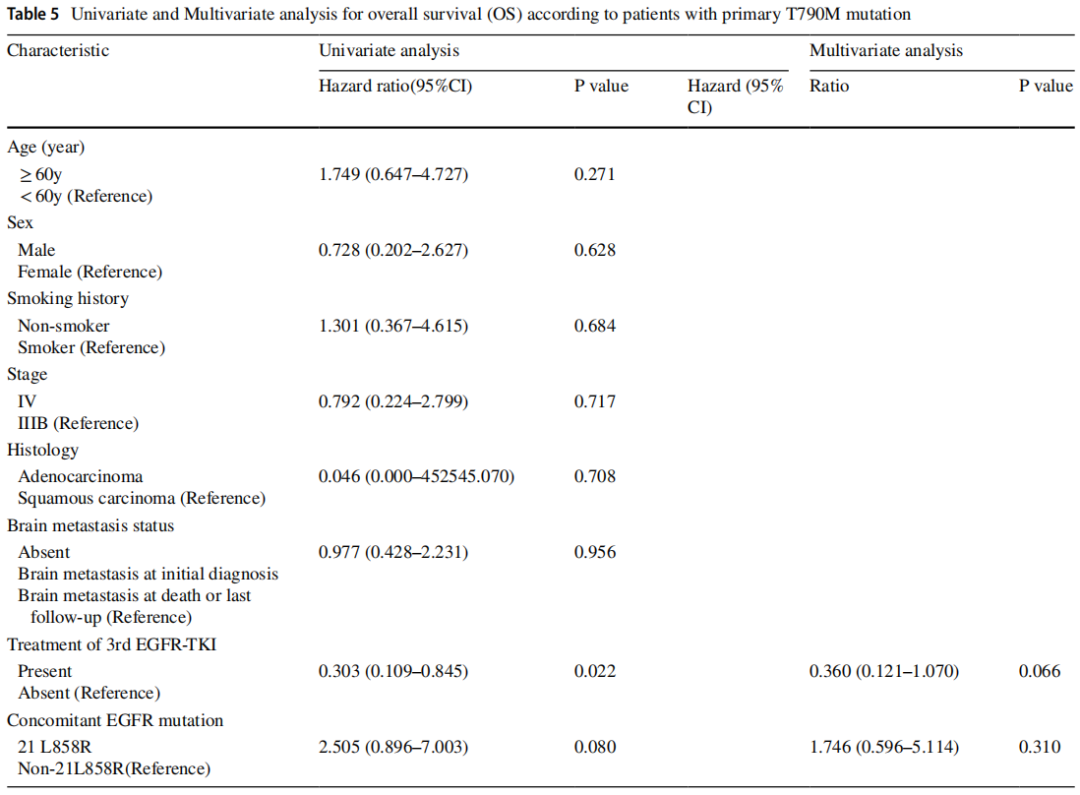
表5
原发性和获得性T790M突变患者的临床特征和预后差异:
T790M突变的时间与相关EGFR突变亚型的存在相关(p<0.001)。如表6所示,与获得性突变患者相比,原发T790M患者更有可能发生L858R突变。相比之下,获得性T790M患者发生19del的可能性高于原发突变患者。此外,获得性EGFR T790M突变组的脑转移发生率显著高于原发突变组:分别发生于21.05%和44.31%的原发性和获得性T790M突变患者(p=0.022)。原发EGFR突变组(30.00%,6/20)和获得性EGFR突变组(29.20%,34/137)的TP53突变率相似,如表3所示。两组患者在年龄、性别、吸烟史、组织学类型、TNM分期等方面差异均无统计学意义。
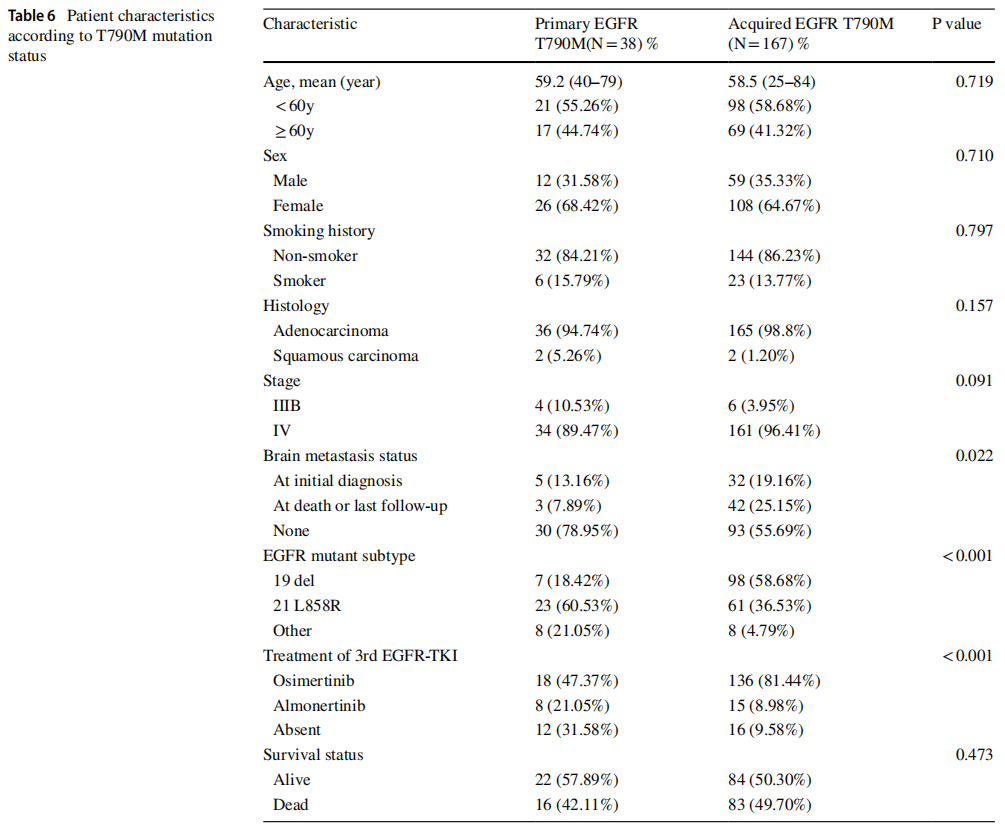
表6
原发性EGFR T790M突变患者的OS比获得性突变患者更差(中位OS:33个月vs. 48个月,p=0.030,图3A)。PFS(p=0.340,如图3B所示)和TTF(p=0.124,如图3C所示)均未观察到差异。对于脑转移患者,获得性EGFR T790M突变患者比原发突变患者有更长的中位OS(中位OS:48个月vs. 33个月,p=0.572)。在EGFR T790M合并L858R突变组中,第三代EGFR-TKIs治疗原发性T790M患者的效果优于获得性突变患者(中位TTF:17个月vs. 9个月,p=0.009,图3D)。
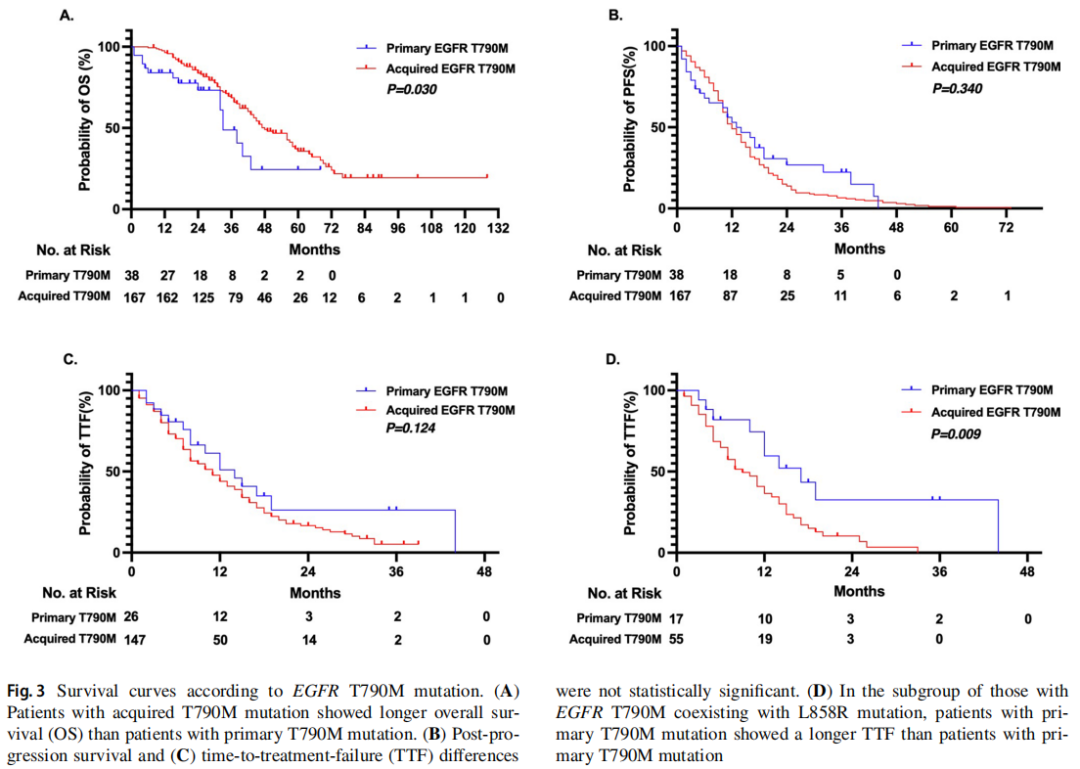
图3
讨 论
本队列显示原发性T790M突变率约为0.8%(38/4287),这与另一项研究的结果一致,即1.1%。虽然样本制备和测序中的人为错误可能导致假阳性,但有证据支持肿瘤组织中存在低比例的T790M突变细胞,可能形成早期EGFR T790M突变耐药克隆。
大量研究表明,突变的状态和分布随肿瘤进展和治疗计划的变化而变化。一项研究在EGFR-TKI治疗期间追踪了117例患者ctDNA中的T790M突变。数字PCR结果显示,T790M突变从疾病进展前的5.9%增加到疾病进展后的48.2%,提示T790M突变可能是治疗失败的早期指标,对化疗的反应也会发生变化。此外,另一项研究发现,TKI耐药肿瘤的耐药来源于两个来源:预先存在的T790M突变克隆和TKI治疗后获得耐药的初始阴性克隆。前者在接受EGFR抑制剂治疗时表现出较低的细胞凋亡率,凸显了T790M突变相关耐药的复杂性。这凸显了了解T790M突变的不同临床反应对提高治疗效果的重要性。
在另一项研究中,Hata等人通过培养TKI耐药患者的肿瘤细胞确定了两种来源的耐药克隆:(1)肿瘤组织中原T790M突变克隆导致耐药;(2)肿瘤组织中的EGFR T790M阴性克隆在TKI治疗后可能演变为获得性耐药克隆。当加入EGFR抑制剂(WZ4002)后,来自TKI耐药细胞的突变克隆表现出低水平的凋亡,而早期耐药克隆则表现出明显的凋亡水平。这进一步强调了T790M突变的时空异质性在肿瘤细胞耐药中的关键作用。因此,尽管携带原发性T790M突变的患者数量较少,但全面了解其临床特征和对药物治疗的反应对于改善预后至关重要。此外,深入研究耐药机制可能会带来重大突破。
本研究分析与先前关于原发性T790M突变的基线特征的发现一致,这些突变常见于女性、非吸烟者和腺癌患者。研究者发现原发性T790M突变常与其他传统EGFR突变亚型共存,如L858R和19del。含L858R的样本突变率明显高于含19del的样本。这一特征与获得性T790M突变形成鲜明对比,后者更容易伴随19 del。L858R和19del是EGFR突变中最常见的两种亚型,占所有EGFR突变的80%。两者对EGFR-TKIs均有应答,但它们具有不同的临床特征和预后,因此需要不同的治疗策略。
在He等人的一项荟萃分析中,结合了19项研究(4872例患者),并以无病生存期(DFS)为终点,比较L858R和19del突变患者的DFS。结果提示,携带19del突变的患者较携带L858R突变的患者DFS更低,但差异无统计学意义(HR=1.38,95%CI:0.76-2.52)。Wang等人对128例患者进行了回顾性研究,确定有19del的晚期肺腺癌患者在化疗后接受二线EGFR-TKIs治疗,在PFS和OS方面比那些有L858R突变的患者有更好的生存结局(中位PFS:8.1个月vs. 6.8个月,p=0.002;中位OS:17.6个月vs. 12.5个月,p=0.000)。在Gregory J. Riely的一项研究中,19del患者接受厄洛替尼或吉非替尼治疗的中位PFS和OS比L858R患者更长(P<0.01)。Hengrui Liang等人发现伴随突变与较差的治疗结果相关,L858R突变患者的TKI反应显著低于19 del患者。在探索了19 del和L858R的分子结构后,一些研究者提出,它们不同的TKI结合亲和力可能是它们对TKI治疗反应不同的原因。因此,将突变作为一个额外的“变量”可能会影响T790M突变的NSCLC患者的治疗和预后。
此外,Chen等人提出,大量未经治疗的NSCLC病例可能从一开始就存在T790M突变。随着第一代或第二代TKI药物消除敏感突变位点,耐药T790M克隆增殖直至成为优势克隆。因此,原发T790M突变介导的疾病进展阶段比获得性T790M突变介导的疾病进展阶段“更早”,导致原发突变的疾病进程“更快”。这可能解释了为何原发T790M突变患者的OS通常比获得性突变患者差。
T790M突变可能通过两种机制导致TKIs耐药。首先,可能是蛋氨酸比苏氨酸占据更多空间,改变了空间位阻,阻碍了TKI与EGFR的结合。其次,EGFR酪氨酸激酶的ATP亲和力增加,可能会阻止EGFR的激活信号被小分子药物(如TKIs)有效阻断,从而失去其抗肿瘤作用。奥希替尼是具有代表性的第三代EGFR-TKI,可特异性对抗T790M耐药和EGFR敏感突变。其结构以2-氨基嘧啶为骨架,抑制EGFR激酶的磷酸化和下游肿瘤信号通路的激活。通过将其不饱和丙烯酰链与EGFR激酶的ATP结合位点上的C797氨基酸半胱氨酸结合来实现。基于AURA和FLAURA研究结果,奥希替尼已成为晚期EGFR阳性NSCLC的新一线标准,并不断得到众多国际和国内临床实践指南的认可,在许多国家被批准用于一线治疗。
然而,由于原发性EGFR T790M突变率低,很少有研究对这些患者进行临床试验,NCCN NSCLC临床实践指南也没有明确规定一线治疗。本研究证实,奥希替尼对原发T790M突变仍然有效,对第三代EGFR-TKI的总体应答在原发T790M突变和获得性T790M突变之间无显著差异。值得注意的是,在L858R共突变的亚组分析中,与获得性突变患者相比,原发T790M突变患者对第三代EGFR-TKI的应答更好,且至治疗失败的时间更长(中位TTF:17个月vs. 9个月)。
肿瘤细胞因其基因组异质性而被认识,在某些情况下,基因组异质性可影响治疗反应和获得性耐药的发展。研究者认为,第一代和第二代EGFR-TKIs可能诱导EGFR上游或下游特定信号通路的沉默或刺激,或者改变某些蛋白质的表达,从而影响对奥希替尼的反应。根据研究者的发现,这些信号通路可能与L858R相关。同时携带获得性T790M和L858R突变的患者在添加基因突变时对第三代EGFR-TKI的反应较差。然而,这种联系的因果关系尚不清楚。需要进一步深入的基因分析和实验研究来验证这一点。
在本研究中,与原发突变患者相比,获得性EGFR T790M突变患者的脑转移发生率更高,中位总生存期(OS)更长。研究者推测这些观察结果与分子特征和第三代EGFR TKIs的治疗渗透密切相关。根据Sekine等人的研究,与L858R突变患者和野生型EGFR患者相比,19del突变患者更有可能发生多发、较小的脑转移。奥希替尼由于能够有效穿过血脑屏障并渗透脑组织,在延长EGFR T790M获得性突变伴脑转移患者的OS方面发挥了关键作用。这突显了奥希替尼作为中枢神经系统转移的一种有前景的治疗方法的潜力。
Hiroyuki等人认为,奥希替尼对EGFR外显子19缺失突变的脑转移患者比外显子21 L858R突变的患者更有利。与第21号外显子L858R突变相关的脑转移患者相比,第19号外显子缺失患者的无进展生存期(PFS)显著延长(中位PFS:8.3个月 vs. 1.8个月;log-rank P=0.032)。19缺失突变是获得性T790M突变患者的主要伴随突变,这可能是获得性T790M突变患者对第三代EGFR-TKI疗效反应较好的原因。
本研究有几个局限性。首先,数据是从一个中心收集的,这可能不能完全代表更广泛的人群。需要对携带EGFR T790M突变的患者进行更全面的研究。其次,由于临床基因检测的高度敏感性,研究者不能完全排除EGFR T790M原发性突变出现假阳性结果的可能性。第三,第三代EGFR-TKIs在中国上市较晚,因此,在本研究的早期,许多患者无法接受第三代EGFR-TKI治疗,即使检测到EGFR T790M突变。最后,这是一项回顾性研究,其潜在偏倚可能比前瞻性研究更大。尚需多中心、大样本的研究进一步验证。总的来说,需要收集更大的样本量,并进行数据库统计分析来确认。遗憾的是,这是一项描述性研究,潜在的机制尚未完全阐明。在未来的研究中,应在分子水平上获得和分析EGFR T790M原发突变患者的病理。
虽然患者均携带EGFR T790M突变,但不同时间发生的突变可导致不同的分子特征和预后。携带原发性EGFR T790M突变的患者接受奥希替尼治疗后表现出良好的应答。当T790M和L858R同时存在时,原发T790M突变患者较获得性T790M突变患者获益更多。未来需要从分子水平深入研究肿瘤细胞克隆增殖和信号转导机制,进一步研究肿瘤细胞的耐药机制。这将有望为NSCLC人群带来更多的治疗选择。
参考文献:
Zhou, Siqi et al. “Primary versus acquired epidermal growth factor receptor Thr790Met mutant non-small cell lung cancer: clinical features and prognoses.” Clinical & translational oncology : official publication of the Federation of Spanish Oncology Societies and of the National Cancer Institute of Mexico, 10.1007/s12094-023-03365-5. 8 Jan. 2024, doi:10.1007/s12094-023-03365-5

猜你喜欢
- 【Eur Respir J.】发育性肺疾病中肺动脉高压的跨学科共识-诊断评估
- 脓毒症的血乳酸水平:8个问题
- 腰痛发病率仅次于感冒,基层医生该如何应对?
- Ann Rheum Dis:Avacopan在接受利妥昔单抗治疗的ANCA相关血管炎患者中的疗效和安全性
- 香菇的香味从哪儿来
- Molecular Psychiatry:阿尔茨海默病早期预警信号,主观认知下降的独特分子特征及其预测价值
- 蓖麻子的功效与作用,这五个蓖麻子药用价值功效
- 24639份真实世界样本:NGS检测辅助髓系肿瘤的诊断、治疗指导和预后分层
- 不止抗衰!石榴里的“活性成分”有多强?常吃石榴,可能会带来这5个强大的益处
- 200首中医方剂组成、功效歌——方剂学各论
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)