首页 > 医疗资讯/ 正文
PD-L1阻断在广泛范围的恶性肿瘤中具有疗效,然而并非所有患者都能受益,而且相当一部分最初有反应的患者最终会出现复发。为了延长和扩大癌症免疫治疗的影响,一种方法是针对额外的免疫检查点,如TIGIT(也称为具有Ig和ITIM的T细胞免疫受体)。阿替利珠单抗(Atezolizumab)是一种针对PD-L1的单克隆抗体,已批准作为第一线单药治疗用于PD-L1表达高的转移性非小细胞肺癌(NSCLC)患者,以及作为辅助治疗用于切除后的II–IIIA期NSCLC患者。替瑞利尤单抗(Tiragolumab)是一种单克隆抗体,结合到TIGIT并防止其与高亲和力配体PVR(也称为CD155)以及其对受体CD226结合。
在CITYSCAPE随机第二期研究中,科学家们评估了在PD-L1阳性(肿瘤比例评分≥ 1%)非小细胞肺癌(NSCLC)患者中,第一线使用tiragolumab联合atezolizumab与单独使用atezolizumab治疗的效果。他们发现,联合治疗显示出更好的临床效果,客观缓解率为31%,而接受atezolizumab加安慰剂的患者为16%。此外,在意图治疗人群中,联合治疗还改善了无进展生存期和总生存期。在小鼠模型中,研究发现TIGIT和PD-1途径在机制上相互依赖,同时阻断TIGIT和PD-L1能够协同诱导抗肿瘤T细胞应答。针对TIGIT的疗法有多种可能的作用机制,包括Fc独立的受体-配体阻断、Fc依赖的TIGIT表达调节性T细胞的消耗和Fc依赖的髓样细胞调节。然而,目前尚不清楚哪种机制在临床TIGIT阻断中起关键作用,而抗TIGIT抗体的Fc结构域功能性一直是争论的焦点。
2024年2月28日,罗氏制药子公司基因泰克公司的Namrata S. Patil和Robert J. Johnston等人,发现在接受atezolizumab加tiragolumab治疗的患者中,高基线的肿瘤内巨噬细胞和调节性T细胞与更好的预后相关,而在单独接受atezolizumab治疗的患者中则不存在这种关联。血清样本分析显示,巨噬细胞活化与接受联合治疗的患者中的临床益处相关。在小鼠肿瘤模型中,tiragolumab替代抗体通过Fcγ受体(FcγR)激活肿瘤相关的巨噬细胞、单核细胞和树突状细胞,从而使CD8+ T细胞从一种疲劳的效应样态转变为更类似记忆的状态。这些结果揭示了TIGIT检查点抑制剂重塑免疫抑制性肿瘤微环境的作用机制,并暗示FcγR参与是抗TIGIT抗体开发中的重要考虑因素。该研究成果以“Anti-TIGIT antibody improves PD-L1 blockade through myeloid and Treg cells”为题,发表在Nature上。该论文共同第一作者是罗氏制药子公司基因泰克公司的Xiangnan Guan, Ruozhen Hu, Yoonha Choi, Shyam Srivats, Robert J. Johnston, Namrata S. Patil。

【Tiragolumab受益于肿瘤相关巨噬细胞和调节性T细胞】
在CITYSCAPE试验中,研究者对参与者的肿瘤样本进行了RNA测序分析,发现高水平的肿瘤相关巨噬细胞(TAMs)和调节性T细胞(Treg细胞)与tiragolumab加atezolizumab联合治疗的临床受益相关。与控制组相比,这种联合治疗显示出更好的客观缓解率(ORR)和生存期(OS)。进一步的免疫荧光染色分析证实了这些发现,并且Kaplan-Meier分析显示,增加的TAMs和Treg细胞与联合治疗的生存期改善相关。此外,研究人员还发现单核细胞,特别是CD16高非经典单核细胞,与tiragolumab加atezolizumab治疗组的生存有正相关性。这些发现表明tiragolumab加atezolizumab联合治疗的疗效与TAMs和肿瘤Treg细胞密切相关,除了典型的检查点抑制剂响应相关因素如CD8+效应性T细胞和PD-L1表达外,还存在其他机制。

图1 | 肿瘤内髓样细胞和调节性T细胞含量与在CITYSCAPE试验中联合治疗tiragolumab和atezolizumab后患者获益相关。
【血清中的髓样细胞蛋白与tiragolumab的益处相关】
在CITYSCAPE试验中,使用了长期收集的外周血清样本来识别与联合治疗相关的治疗信号。通过质谱技术对来自CITYSCAPE患者的血清样本进行了基线(第1周期第1天)和治疗后3周(第2周期第1天)的蛋白质组学分析。结果显示,接受tiragolumab加atezolizumab治疗的患者在治疗后3周的血清中,与基线相比,肿瘤相关巨噬细胞表达的蛋白质如MARCO、CSF-1R、CD163、CAMP、CD5L和APOC2/3/4的肽段显著增加,而接受安慰剂加atezolizumab治疗的患者则没有这种变化。进一步的分析表明,在治疗后3周,这些血清髓样细胞蛋白质的增加与更长的无进展生存期(PFS)和总生存期(OS)相关。血清可溶性CD163(sCD163)是单核细胞和组织巨噬细胞激活的已知标志物,与通过质谱法检测的CD163呈正相关。Kaplan-Meier生存分析显示,在sCD163水平增加的患者中,接受tiragolumab加atezolizumab联合治疗的患者的PFS和OS明显改善。这些结果表明,肿瘤相关巨噬细胞的激活可能是对联合治疗特异性反应的重要机制之一。

图2 | 用tiragolumab加atezolizumab治疗导致血清髓样蛋白增加。
【Tiragolumab激活外周单核细胞】
在tiragolumab与atezolizumab联合治疗的NSCLC(非小细胞肺癌)第1b期研究中,对来自患者的外周血单个核细胞(PBMCs)进行评估。利用单细胞RNA测序和CITE-seq技术,获得了406,296个免疫细胞的转录谱,并对其进行了注释。研究发现,在治疗后2周(C1D15),外周细胞的增殖增加,尤其是在非naive CD8+细胞和自然杀伤细胞(NK细胞)亚群中。然而,主要细胞类型在治疗期间的比例未发生改变,并且在每个时间点上,对于治疗反应者和非反应者之间也没有观察到比例的变化。与总CD4+ T细胞相比,循环调节性T细胞的比例在治疗过程中下降。此外,中间型单核细胞在C1D15时增加,而经典单核细胞在总单核细胞比例中似乎下降。基因集富集分析显示,在C1D15相对于基线(C1D1)的变化中,所有细胞类型都表现出广泛的干扰素(IFN)反应,然后在C2D1,响应似乎变得更加特异。在非naive CD8+和CD4+ T细胞、NK细胞和单核细胞中观察到增强的IFN信号传导,与以前对atezolizumab单药治疗的观察一致。此外,一些单核细胞中的新途径也被上调,包括氧化磷酸化途径和已被证明调节巨噬细胞极化的MYC靶向途径。这些数据表明,髓样细胞的激活是tiragolumab活性的重要组成部分。考虑到tiragolumab的活性Fc以及髓样细胞高水平的FcγR表达,我们进一步假设FcγR参与可能有助于该抗体的抗肿瘤疗效。
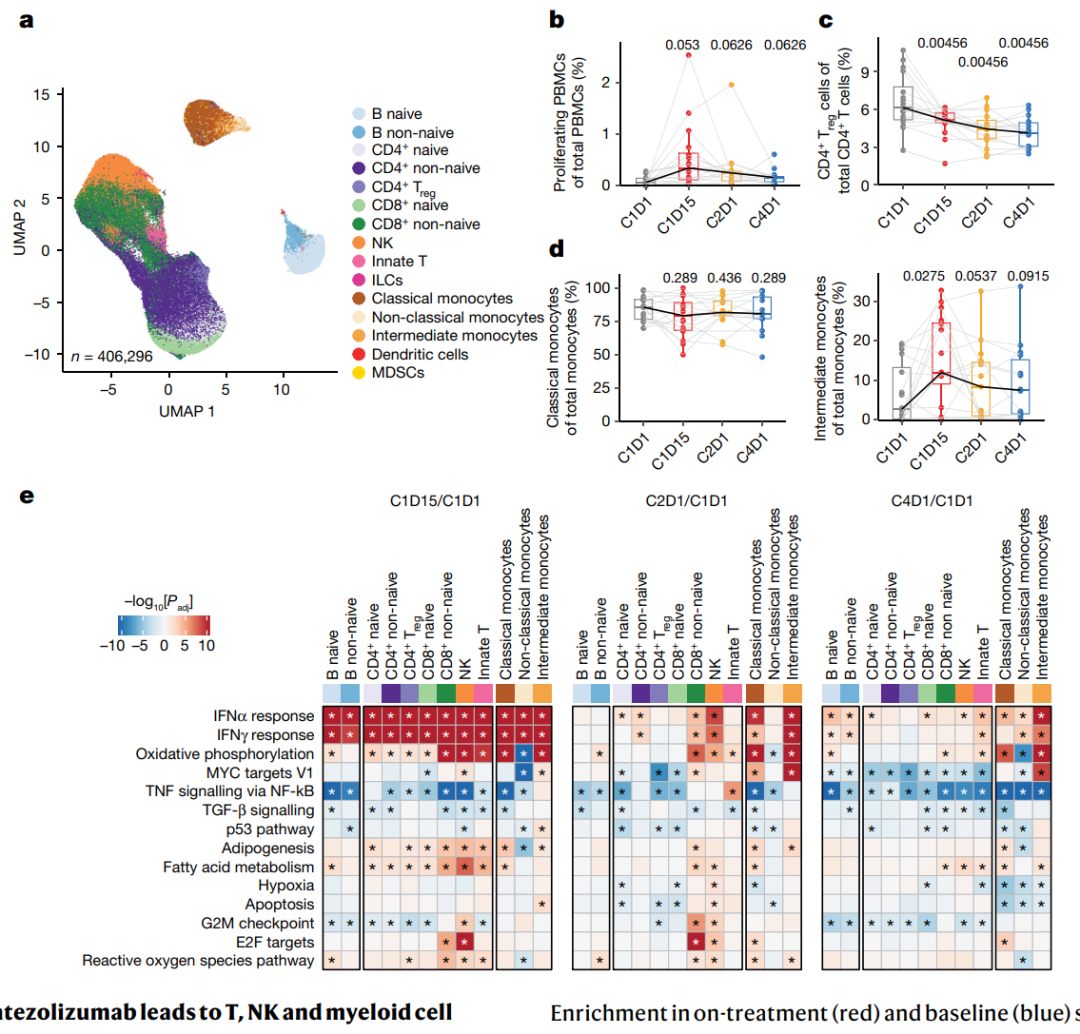
图3 | 在外周血单个核细胞中,tiragolumab加atezolizumab治疗导致T细胞、NK细胞和髓样细胞的激活。
【抗TIGIT通过Fcγ受体重塑肿瘤微环境】
接着,研究了抗TIGIT(抑制T细胞免疫球蛋白与ITIM的T细胞免疫球蛋白)在肿瘤微环境中的作用机制,特别关注了其与Fcγ受体的相互作用。研究使用小鼠模型进行了预临床实验,观察了抗TIGIT和Fc–FcγR相互作用对肿瘤浸润性白细胞的影响。通过单细胞RNA测序和CITE-seq技术,分析了肿瘤内外周血单核细胞(PBMCs)的转录谱,并发现抗TIGIT抗体能够激活肿瘤浸润的单核细胞。进一步,研究表明,活性的Fc和高水平的FcγR表达与这种抗体的抗肿瘤功效密切相关。
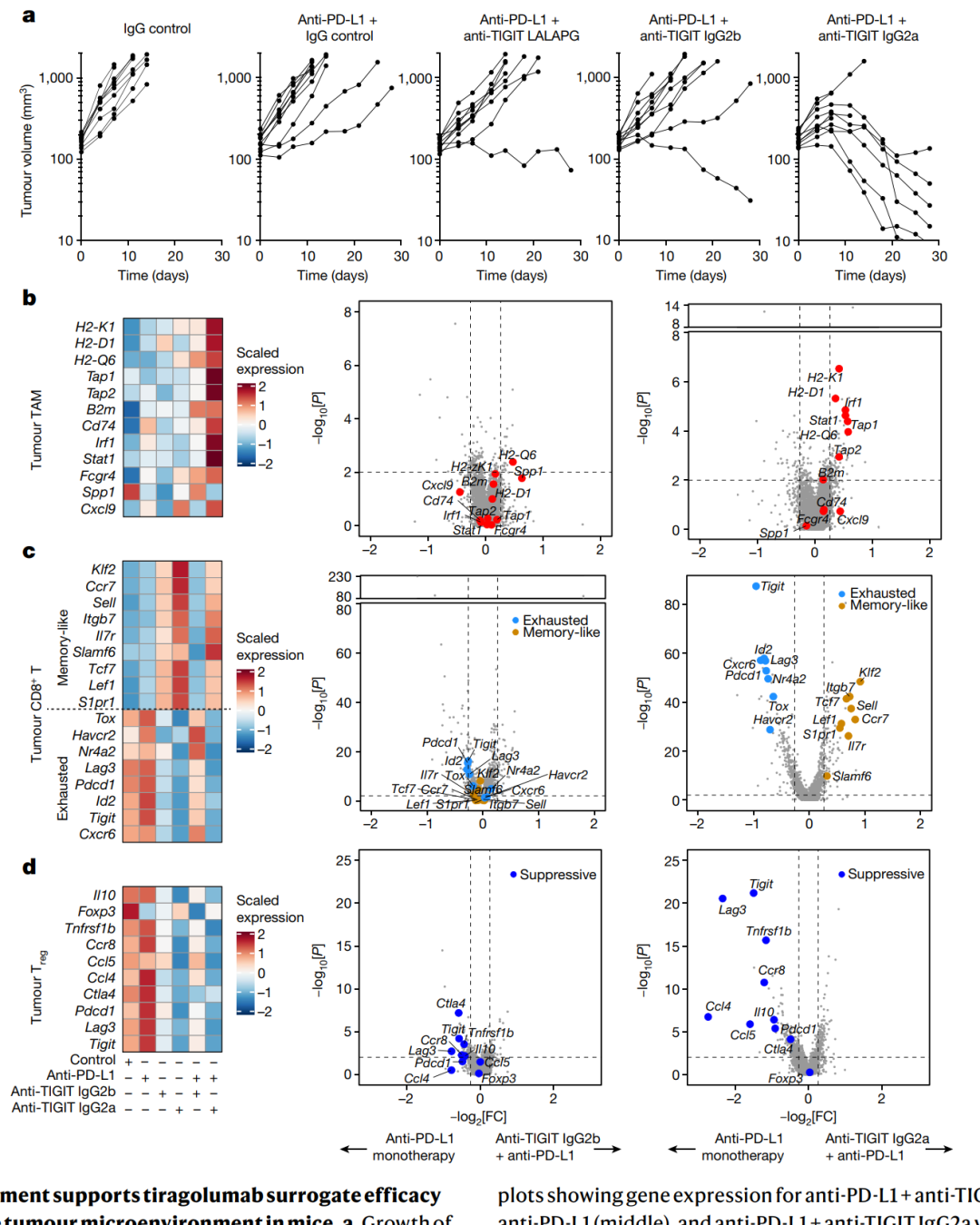
图4 | Fc受体的参与支持tiragolumab替代药的有效性,并能够重塑小鼠肿瘤微环境。
通过测序和流式细胞术的结果显示,Fc活性的抗TIGIT抗体能够激活肿瘤巨噬细胞、调节肿瘤CD8+和CD4+ T细胞,以及影响外周血非经典单核细胞的炎症反应。
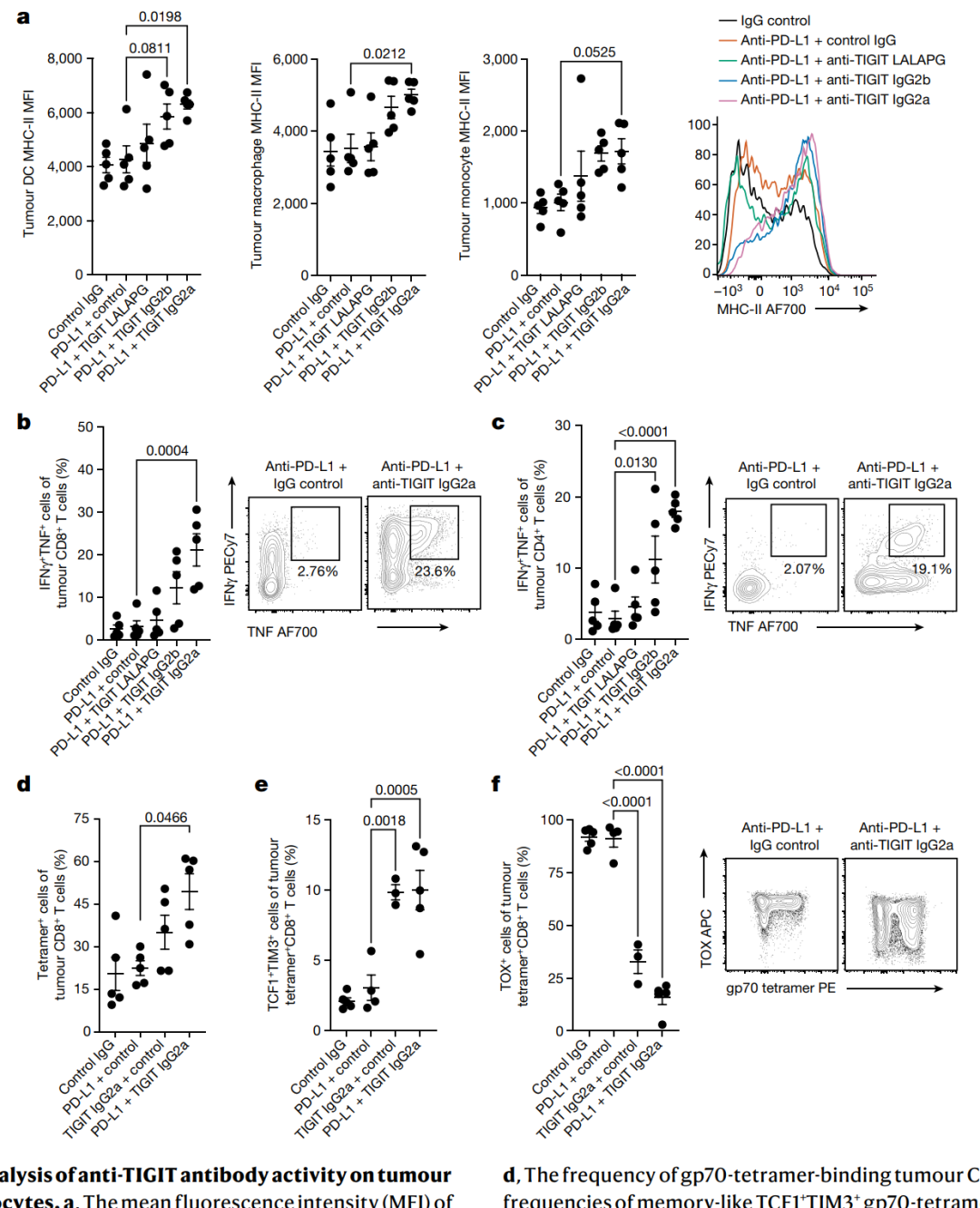
图5 | 对肿瘤髓样细胞和淋巴细胞进行抗TIGIT抗体活性的流式细胞术分析。
【抗TIGIT通过巨噬细胞调节CD8+ T细胞】
研究发现,抗TIGIT抗体对抗肿瘤T细胞反应的影响可能是通过巨噬细胞和其他髓系细胞介导的。为验证这一假设,研究人员比较了联合应用抗CSF-1R抗体的抗PD-L1+IgG2a抗TIGIT治疗与仅抗PD-L1+IgG2a抗TIGIT治疗的效果。抗CSF-1R抗体可功能性去除依赖于CSF-1R信号通路的巨噬细胞和其他髓系细胞,因此被视为一种减缓癌症免疫治疗耐药的策略。结果显示,联合应用抗PD-L1+抗TIGIT抗体的治疗能够减少肿瘤CD8+T细胞中与疲劳相关的基因表达,并增加记忆型基因表达,而添加抗CSF-1R治疗则在很大程度上逆转了这一效果,使其回归到疲劳效应状态。此外,对于肿瘤Treg细胞的影响则没有受到抗CSF-1R治疗的影响,这表明抗TIGIT对于肿瘤CD8+T细胞的记忆型基因程序的诱导是依赖于巨噬细胞和其他髓系细胞的。随后,研究人员进行了实验验证,结果显示,在与具有免疫抑制M2极化巨噬细胞的共培养中,atezolizumab和野生型tiragolumab(即Fc活性)的联合治疗相对于仅应用atezolizumab能够增强T细胞细胞因子IL-2和TNF的产生。而使用去糖化的tiragolumab则无法产生此效果,表明FcγR参与的重要性。这一结果进一步强调了巨噬细胞和FcγR的作用在抗TIGIT治疗中的重要性。
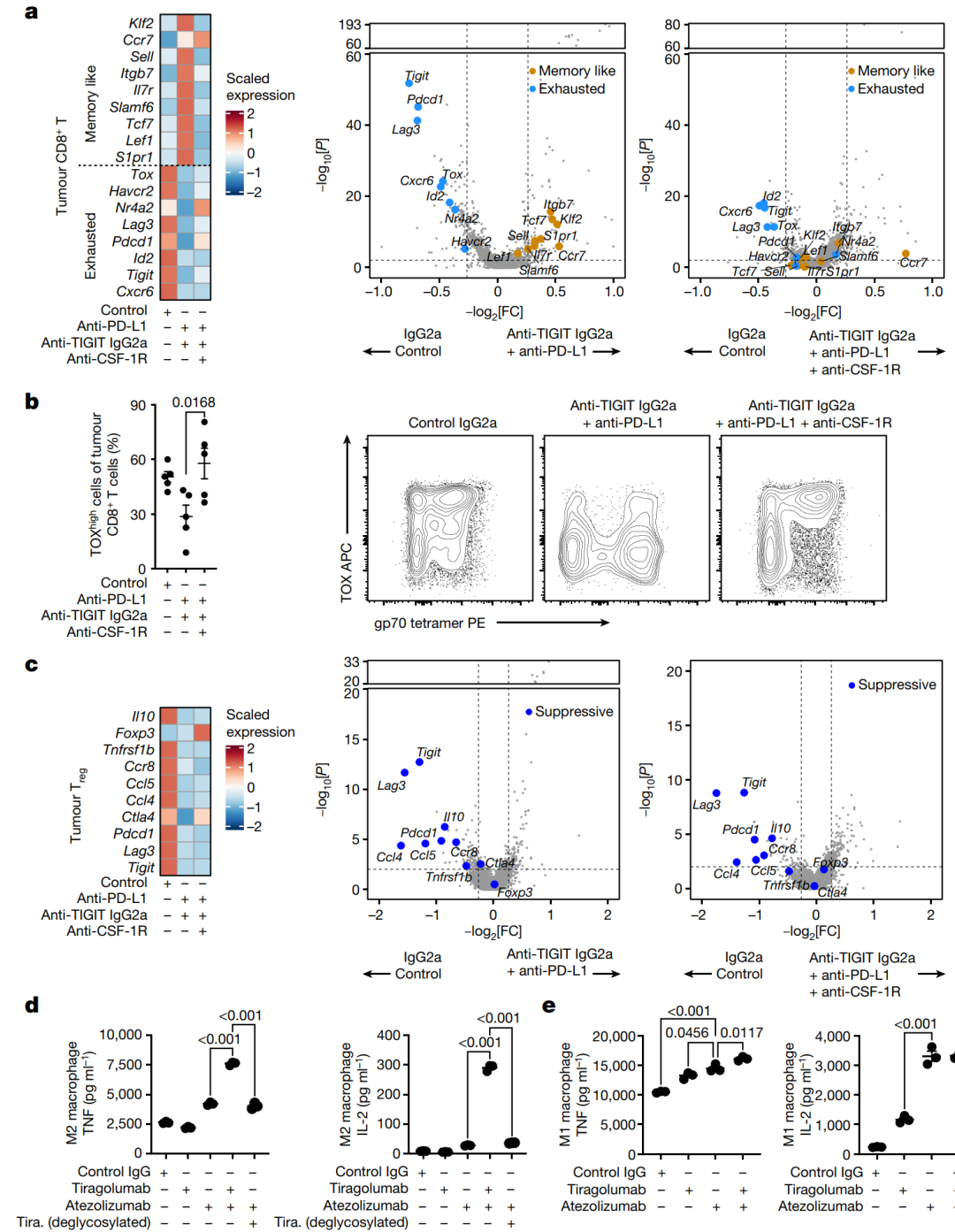
图6 | 在体内和体外,巨噬细胞通过Fc活性的抗TIGIT抗体调节CD8+ T细胞。
【小结】
总之,该研究发现,与典型的抑制性肿瘤肿瘤细胞相反,抗TIGIT抗体可以通过激活肿瘤相关的巨噬细胞和其他髓系细胞,从而增强CD8+ T细胞的抗肿瘤活性。这一机制需要抗体与激活性Fc受体的结合,显示了抗TIGIT抗体在肿瘤免疫治疗中的独特作用机制。研究结果还表明,抗TIGIT抗体可以诱导肿瘤CD8+ T细胞进入记忆样状态,并减少衰竭效应的基因表达。此外,研究还强调了巨噬细胞在调节肿瘤免疫反应中的重要性。总的来说,这些发现为抗TIGIT抗体的临床应用提供了新的机制基础,也提出了Fcγ受体在其治疗效应中的重要性,为进一步研究肿瘤免疫治疗提供了重要线索。
原文链接:
https://doi.org/10.1038/s41586-024-07121-9
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)