首页 > 医疗资讯/ 正文
幽门螺杆菌(Hp)是人类感染的最常见细菌之一,据估计全球约44亿人发生Hp感染[1],虽然大多数感染者为无症状,但持续性Hp感染已被证实与胃溃疡、萎缩性胃炎、胃癌等多种慢性进行性胃部疾病具有相关性[2-3]。
通过规范的三联或四联方案可根除Hp感染,进而降低胃癌发病率[4-5],但临床实践中存在抗生素不规范、不合理使用的现象,以致Hp耐药。监测Hp耐药情况一方面可指导临床用药,另一方面有助于减少耐药菌株产生,提高Hp根治率。本研究对近10年来北京大学人民医院消化科门诊患者胃黏膜活检标本分离出的Hp菌株进行体外药敏试验,分析其耐药现状及趋势,以期为临床合理选择抗生素提供依据。
1 材料与方法
1.1 一般材料
回顾性收集2011年5月—2021年12月北京大学人民医院消化科门诊患者胃黏膜活检标本分离的Hp菌株的药敏试验数据。
纳入标准:(1)标本为患者胃黏膜活检标本;(2)Hp经药敏试验培养阳性。排除标准:(1)同一患者多次胃镜检查留取的标本;(2)患者胃镜检查前2周内服用抗生素、质子泵抑制剂(PPI)、非甾体抗炎药。
本研究已通过北京大学人民医院伦理审查委员会审批(审批号:2023PHB168-001),并豁免患者知情同意。
1.2 研究方法
1.2.1 主要试剂与仪器
脑心浸液肉汤干粉、Karmali琼脂、添加剂(英国OXOID公司),新鲜无菌脱纤维绵羊血(北京双智科技有限公司),5%脱纤维羊血+MH琼脂培养基(美国BD 公司),克拉霉素、甲硝唑、左氧氟沙星、阿莫西林和四环素的药敏试验纸条(法国BioMérieux公司);质控菌株ATCC 43504(北京中源合聚生物科技有限公司);微需氧产气袋(法国BioMérieux 公司),三气培养箱(美国Nuaire公司)。
1.2.2 菌株分离培养及鉴定
参照《幽门螺杆菌感染的基础与临床》[6],采用无菌眼科镊将标本转移至匀浆器中并同时滴加转送液1~2 mL,研磨5~8次后接种至Hp选择培养基(Karmali培养基)并置于微需氧环境(5% O2、85% N2、10% CO2,相对湿度>95%)的培养箱中37 ℃孵育3~7 d。选取呈针尖样(直径1~2 mm)的透明菌落(革兰染色为阴性,尿素酶、触酶、氧化酶试验均为阳性)进行转种、纯化,鉴定为Hp菌株后将其混悬于含20%甘油的肉汤中,-70 ℃保存备用。
1.2.3 药敏试验
采用浓度梯度琼脂扩散法(Etest法)进行药敏试验。从生长菌株的平皿中选取孵育72 h的传代培养物,用生理盐水制备浊度为2.0麦氏标准的菌液;吸取100 μL稀释后的菌液置于血MH平皿中并在整个琼脂表面均匀涂抹3次,每次均将平皿旋转60°,晾干后将阿莫西林、甲硝唑、克拉霉素、左氧氟沙星、四环素Etest条贴于平皿中,35 ℃微需氧条件下培养3 d;读取抑菌圈与Etest条的相交处刻度即为该菌株的最低抑菌浓度(MIC),每批试剂均进行质控菌株检测。
1.2.4 结果判读
参照美国临床和实验室标准化协会(CLSI)M45-ED3[7]及欧洲抗菌药物敏感性试验委员会(EUCAST)[8]中的标准对常见抗菌药物,包括克拉霉素(MIC≤0.25 mg/L为“敏感”,0.5 mg/L为“中介”,≥1 mg/L为“耐药”)、甲硝唑(MIC≤8 mg/L为“敏感”,>8 mg/L为“耐药”)、左氧氟沙星(MIC≤1 mg/L为“敏感”,>1 mg/L为“耐药”)、阿莫西林(MIC≤0.125 mg/L为“敏感”,>0.125 mg/L为“耐药”)、四环素(MIC≤1 mg/L为“敏感”,>1 mg/L为“耐药”),进行耐药性判断并计算菌株敏感率、耐药率及双重(同时对两种药物耐药)/多重耐药率(同时对两种以上药物耐药)。
1.3 统计学处理
采用WHONET 5.6软件进行药敏数据分析,采用SPSS 26.0软件进行统计学分析。菌株敏感率、中介率、耐药率等计数资料以百分数表示,组间比较采用卡方检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 菌株检出情况
共纳入分离自402份胃黏膜标本(120例患者)且培养阳性的Hp 120株,培养阳性率为29.85%。120例患者中,男性53例,女性67例;平均年龄49岁(范围:18~76岁);临床诊断为Hp感染45例(37.5%)、慢性胃炎46例(38.33%),原因待查29例(24.17%)。
2.2 体外药敏试验结果
5种抗菌药物中,Hp对甲硝唑、克拉霉素的耐药性较强,MIC50分别为256 mg/L、8 mg/L,MIC90均>256 mg/L。120株Hp对甲硝唑、克拉霉素、左氧氟沙星、阿莫西林和四环素的耐药率分别为75.0%、72.5%、45.8%、12.5%和4.2%(表1)。
表1 Hp对5种抗菌药物的体外药敏试验结果(n=120)
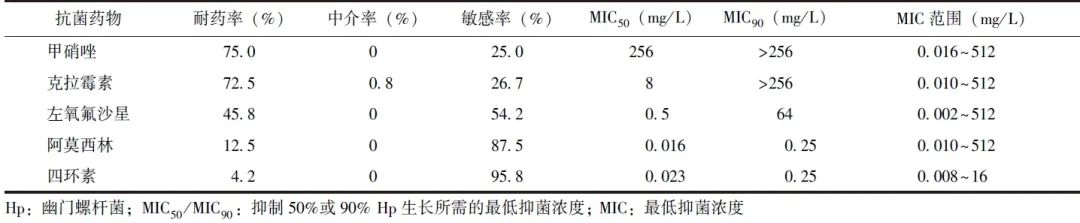
2.2.1 Hp耐药率与患者年龄的关联性
Hp对克拉霉素、阿莫西林的耐药率受患者年龄的影响不明显;随患者年龄增加,Hp对甲硝唑、左氧氟沙星的耐药率整体呈逐渐升高趋势,对四环素的耐药率呈逐渐降低趋势,见图1。
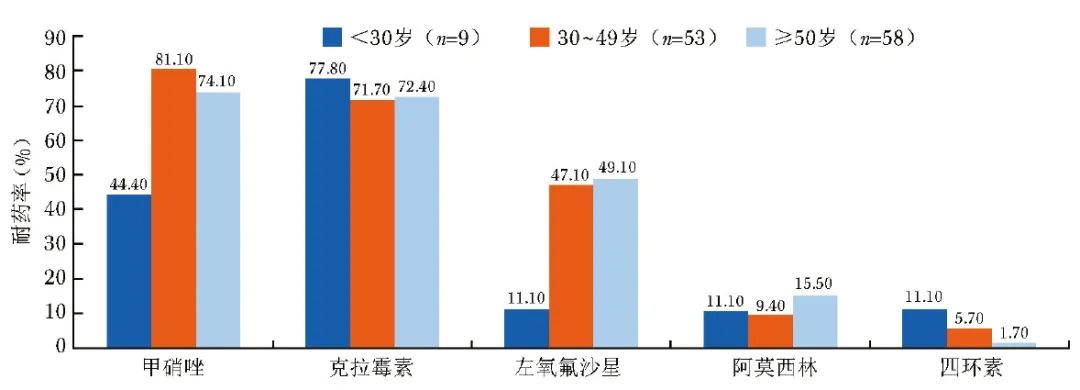
图1 不同年龄段Hp感染患者对5种抗菌药物的耐药率
Hp:同表1
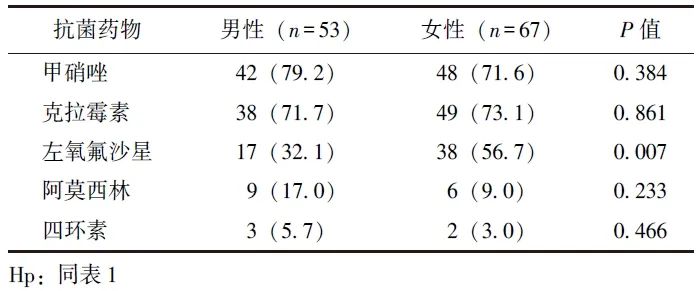
2.2.2 Hp耐药率与患者性别的关联性
男性Hp感染患者对左氧氟沙星的耐药率低于女性(P=0.007),不同性别Hp感染患者对甲硝唑、克拉霉素、阿莫西林、四环素的耐药率均无统计学差异(P均>0.05),见表2。
表2 不同性别Hp感染患者对5种抗菌药物的耐药情况比较[n(%)]
2.2.3 Hp耐药率与时间的关联性
随时间推移,Hp对克拉霉素耐药率整体呈逐渐升高的趋势,对左氧氟沙星的耐药率呈先增加后降低的趋势,对甲硝唑的耐药率呈波动之势且整体偏高,对阿莫西林、四环素的耐药率受时间变化的影响相对不明显且整体偏低(图2)。
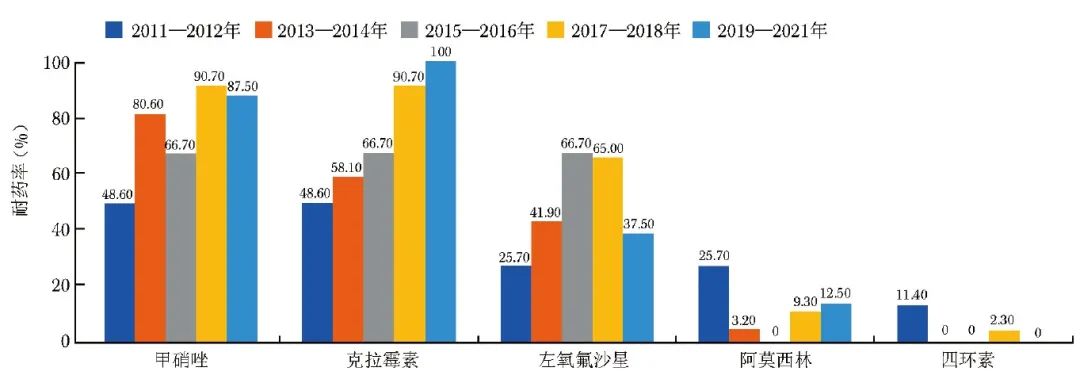
图2 2011—2021年Hp对5种抗菌药物耐药率趋势图
Hp:同表1
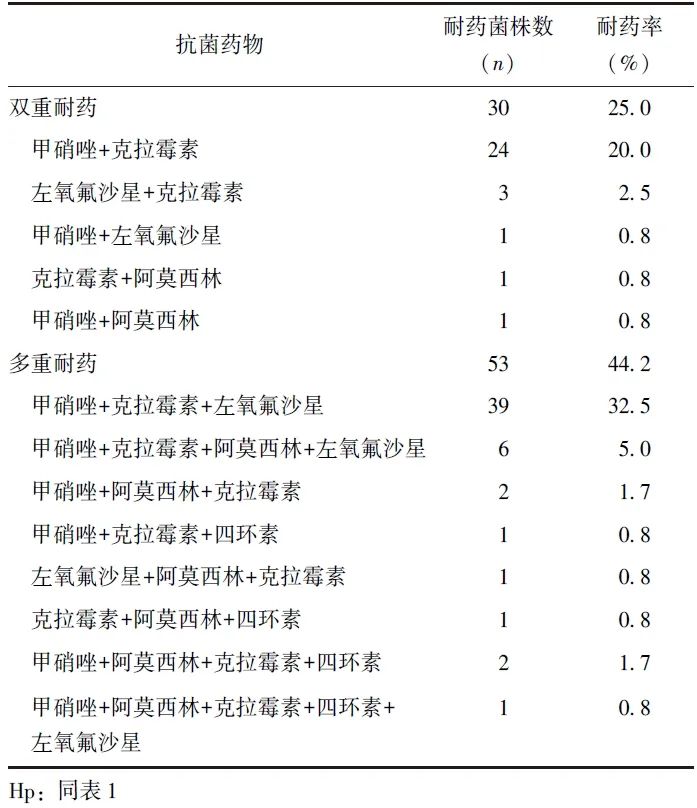
2.3 双重/多重耐药情况
未发现对5种抗菌药物同时耐药的Hp菌株。双重耐药中,以甲硝唑与克拉霉素同时耐药最为常见(20.0%),其次为左氧氟沙星与克拉霉素(2.5%)同时耐药,四环素与其他抗菌药物的双重耐药均较少见。多重耐药中,以甲硝唑+克拉霉素+左氧氟沙星同时耐药最为常见(32.5%),其他形式的多重耐药均相对少见,见表3。
表3 Hp对5种抗菌药物双重/多重耐药结果展示(n=120)
3 讨论
本研究对北京大学人民医院分离培养的120株Hp的耐药性进行了初步评估。体外药敏试验结果显示,Hp对甲硝唑、克拉霉素、左氧氟沙星、阿莫西林和四环素的耐药率分别为75.0%、72.5%、45.8%、12.5%和4.2%;双重耐药率为25.0%,其中以甲硝唑与克拉霉素同时耐药最为常见(20.0%);多重耐药率为44.2%,其中以甲硝唑+克拉霉素+左氧氟沙星同时耐药最为常见(32.5%)。Hp对5种抗菌药物的耐药性与患者年龄、性别及时间变化具有一定关联性。
Hp分离培养是诊断Hp感染的金标准,但由于其需要采集活检标本,因此该方法并非临床诊断Hp感染的常规手段。此外,菌株的分离和培养耗时较久,且培养结果受多种因素的影响。
文献[9-10]报道,实验室专业人员技能、活检样本中的细菌载量、胃炎程度、饮酒、溃疡出血、使用抗生素、标本质量、微生物菌群、转运的时间和温度、空气暴露时间等因素均可在一定程度上影响菌群培养结果,进而导致Hp培养阳性率存在差异。本研究402份胃黏膜活检标本共培养阳性Hp 120株,培养阳性率为29.85%,与既往针对上海地区的研究结果近似(26.0%)[11]。
克拉霉素、甲硝唑、左氧氟沙星、阿莫西林和四环素均为根治Hp感染的常用抗生素,而抗生素耐药是导致根治失败的主要原因,故研究Hp耐药情况一方面有助于在治疗前制定给药方案,另一方面可在治疗效果不理想时指导给药方案的调整。
近年来国内外多位学者针对Hp的耐药性进行了调查研究,但结果存在异质性。Bluemel等[12]针对1851例Hp感染且未接受治疗的患者开展调查,结果显示Hp对克拉霉素(11.3%)、左氧氟沙星(13.4%)的耐药率相对较高,对四环素的耐药率较低(2.5%)。
Cosme等[13]针对2013—2017年西班牙Hp感染患者的研究表明,Hp对左氧氟沙星、甲硝唑、克拉霉素的耐药率分别为19.3%、17.9%和30.7%,未发现对阿莫西林、四环素耐药菌株。
Gao等[14]开展的研究调查了2000—2009年北京地区接受胃镜检查患者的Hp耐药性,结果显示患者对甲硝唑(63.9%)、左氧氟沙星(50.3%)、克拉霉素(37.2%)的耐药率较高,对阿莫西林(0.3%)、四环素(1.2%)的耐药率较低。
一项针对南京地区2017—2019年Hp耐药性的研究得到了相近结果,Hp对甲硝唑的耐药率最高(84.78%),其次为克拉霉素(42.53%)、左氧氟沙星(25.95%),对阿莫西林(3.80%)、四环素的耐药率较低(1.08%)[15]。
本研究对北京大学人民医院近10年来分离的120株Hp耐药性进行了统计,结果显示Hp对甲硝唑、克拉霉素、左氧氟沙星、阿莫西林和四环素的耐药率分别为75.0%、72.5%、45.8%、12.5%和4.2%,其耐药率排序与针对北京地区的最新研究结果相符(甲硝唑、克拉霉素、左氧氟沙星、阿莫西林和四环素初次耐药率分别为68.0%、55.2%、49.7%、0.7%、0)[16]。
本研究Hp对克拉霉素耐药率随时间推移整体呈逐渐升高的趋势且甲硝唑耐药率虽呈波动之势但整体偏高,可能与Hp感染后初次治疗时多采用三联方案,克拉霉素、甲硝唑是三联方案的常用药物且甲硝唑常用于牙周炎的治疗,近年来临床应用逐渐广泛相关。
本研究Hp对左氧氟沙星的耐药率呈先升高后降低的趋势,可能原因:研究时间段内后期样本量较小,导致了数据偏移。
此外,与针对北京地区的早期报道比较后发现[14],本研究Hp对甲硝唑、克拉霉素、左氧氟沙星、阿莫西林和四环素的耐药率均有不同程度升高,可能与随着Hp耐药性的增强,再次进行根治性治疗时二次耐药率显著升高有关[16],亦从侧面反映了Hp对抗菌药物耐药现象的严峻性。
国外报道显示,高龄与左氧氟沙星耐药率增加具有一定相关性[12]。本研究中,随患者年龄增加,Hp对甲硝唑、左氧氟沙星的耐药率整体呈逐渐升高趋势,对四环素的耐药率呈逐渐降低趋势,可能原因:甲硝唑和左氧氟沙星除用于根治Hp感染外,尚可用于其他治疗,如牙周炎和女性泌尿系统感染,随着患者年龄增长,抗生素暴露的机会增多,故耐药率增高;而四环素毒的副作用较大,临床使用较少,随抗生素暴露后时间延长耐药性逐渐降低。
本研究发现,女性Hp感染患者对左氧氟沙星的耐药率显著高于男性患者,可能与女性患者泌尿生殖系统感染率较高,而左氧氟沙星广泛应用于泌尿生殖系统及呼吸道感染的治疗密切相关。
随着Hp耐药率的升高,双重/多重耐药菌已非少见,其中以对克拉霉素、甲硝唑与其他药物同时耐药为主。针对河北地区Hp感染人群耐药性的研究显示,甲硝唑与克拉霉素的双重耐药率最高,为20.6%(32/155)[17],在四川Hp感染人群中,双重耐药最多见于克拉霉素和左氧氟沙星同时耐药(26.75%)[18];在福建省闽东地区、贵州省贵阳地区人群中则均为甲硝唑和左氧氟沙星双重耐药率最高(16.9%、11.97%)[19-20]。
上述结果提示,双重耐药Hp菌株的类型在各地区人群中存在差异,可能与不同区域的临床用药习惯不同有关。本研究结果显示,双重耐药率为25.0%,其中甲硝唑与克拉霉素双重耐药率达到了20.0%;在多重耐药的分析中,甲硝唑+克拉霉素+左氧氟沙星同时耐药最为常见(32.5%),与针对北京地区8年数据回顾性分析的研究结果一致(甲硝唑+克拉霉素+左氧氟沙星同时耐药率为48.8%)[16],提示Hp对此3种药物的耐药问题已十分严重,亟待调整Hp根治疗法的用药方案。
《第五次全国幽门螺杆菌感染处理共识报告》[21]指出,对于克拉霉素和甲硝唑双重耐药率>15%的地区,经验治疗不推荐含克拉霉素和甲硝唑的非铋剂四联疗法,可视情况采用PPI+铋剂+2种抗菌药物的Hp根除方案。
此外,鉴于克拉霉素、甲硝唑、左氧氟沙星多重耐药现象较普遍,必要时可采用含伏诺哌嗪的三联疗法、五联疗法、大剂量双重疗法及中医药疗法,但此类方案的疗效及其安全性仍需验证。
本研究局限性:(1)样本量较小且为回顾性研究,结果可能受多种因素干扰;(2)研究标本均来自于北京大学人民医院行胃镜检查的患者,结果外推需谨慎。
综上所述,北京大学人民医院分离的Hp菌株对甲硝唑、克拉霉素及左氧氟沙星的耐药率较高,且多重耐药现象严重,应引起临床高度重视。在临床开展Hp根治疗法时,本研究结果可能对抗菌药物的合理选择和科学管理具有指导作用,必要时需进行药敏试验,以辅助用药方案的制订,提高治疗效果,减少耐药菌株产生。
参考文献
[1]de Brito BB, da Silva FAF, Soares AS,et al. Pathogenesis and clinical management of Helicobacter pylori gastric infection[J]. World J Gastroenterol,2019,25: 5578-5589.
[2]Gravina AG, Zagari RM, Musis CD, et al. Helicobacter pylori and extragastric diseases: A review[J]. World J Gastroenterol, 2018,24: 3204-3221.
[3]Fischbach W, Malfertheiner P. Helicobacter pylori infection[J]. Dtsch Arztebl Int, 2018,115: 429-436.
[4]Smyth EC, Nilsson M, Grabsch HI,et al.Gastric cancer[J]. Lancet,2020,396: 635-648.
[5]胡伏莲,周殿元.幽门螺杆菌感染的基础与临床(修订版)[M].北京:中国科学技术出版社,2002:240-249.
[6]胡伏莲.幽门螺杆菌感染的基础与临床[M].北京:中国科学技术出版社,2009.
[7]Clinical and Laboratory Standards Institute. Methods for Antimicrobial Dilution and Disk Susceptibility Testing of Infrequently Isolated or Fastidious Bacteria[S].3rd ed.CLSI guideline M45.Wayne,Hp:Clinical and Laboratory Standards Institute,2016.
[8]European Committee on Antimicrobial Susceptibility Testing. Breakpoint tables for interpretation of MICs and zone diameters. Version 13.0[EB/OL].(2023-01-01)[2023-02-08]. http://www.eucast.org.
[9]李红,杨天阔,申亚琳,等.幽门螺杆菌药敏检测方法研究进展[J].中华医学杂志,2020,100:2393-2396.
[10]Wang YK, Kuo FC, Liu CJ, et al. Diagnosis of Helicobacter pylori infection: Current options and developments[J]. World J Gastroenterol, 2015,21:11221-11235.
[11]胡玢婕,赵付菊,柴子岚,等.上海地区幽门螺杆菌的检出率及耐药性分析[J].中国感染与化疗杂志,2016,16:346-352.
[12]Bluemel B,Goelz H,Goldmann B,et al. Antimicrobial resistance of Helicobacter pylori in Germany, 2015 to 2018[J]. Clin Microbiol Infect, 2020, 26:235-239.
[13]Cosme A,Torrente Iranzo S,Montes Ros M,et al. Helicobacter pylori antimicrobial resistance during a 5-year period (2013—2017) in northern Spain and its relationship with the eradication therapies[J]. Helicobacter, 2018,24:e12557.
[14]Gao W, Cheng H, Hu F,et al.The Evolution of Helico-bacter pylori Antibiotics Resistance Over 10 Years in Beijing, China[J]. Helicobacter,2010,15:460-466.
[15]姜宗丹,张振玉,王志,等.南京地区幽门螺杆菌耐药现状及近 5 年变化趋势[J].胃肠病学和肝病学杂志,2020,29:168-171.
[16]Li SY, Li J, Dong XH,et al. The effect of previous eradication failure on antibiotic resistance of Helicobacter pylori: A retrospective study over 8 years in Beijing[J]. Helicobacter,2021,26:e12804.
[17]孟霞,刘改芳,吴婧,等.河北地区幽门螺杆菌临床分离株的耐药性分析[J].中华医学杂志,2016,96:270-272.
[18]刘军.699株幽门螺杆菌对常用抗菌药物的耐药情况分析[J].中国医院用药评价与分析,2018,18:274-279.
[19]夏宁宁,黄丽静,吴以龙,等.福建省闽东地区幽门螺杆菌感染及 耐药性分析[J].临床内科杂志,2021,38:738-741.
[20]吴芳草,王琼,朱键,等.贵阳地区351株幽门螺杆菌药物敏感性及pj6Ip 1多样性分析[J].中国人兽共患病学报,2019,35:7587-593.
[21]中华医学会消化病学分会幽门螺杆菌和消化性溃疡学组,第五次全国幽门螺杆菌感染处理共识报告[J].胃肠病学,2017,22:346-360.
猜你喜欢
- 腓总神经卡压:从解剖到预防一文讲解
- 减肥成功哪些食物一定要吃
- 脸上长痘痘如何消除,六个小妙招祛痘简单快捷
- 减肥的福音,这3个食物怎么吃都不发胖
- 从一组数字看卫生健康科技创新“新进步”
- J Immunother Cancer:基线体重指数(BMI)与晚期非小细胞肺癌(NSCLC)一线免疫联合化疗治疗预后的关系
- Trends Pharmacol Sci 综述︱西安儿童医院与复旦大学附属中山医院团队聚焦铜稳态和铜死亡在心血管疾病中的治疗
- 复旦大学李聪团队Biomaterials综述:术中定位脑胶质瘤边界-追踪癌细胞分子足迹
- 大寒迎年待新春(解码二十四节气)
- JAMA Netw Open:美国剖宫产后试产服务全国可及性分析
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)