首页 > 医疗资讯/ 正文
 线粒体是细胞内的中心枢纽,协调人体健康所需的各种代谢反应。线粒体通过其氧化磷酸化(OXPHOS)系统提供大部分细胞能量,该系统需要核基因组和线粒体基因组编码的基因的协调表达。此前已有报道称,多种癌细胞的生长和耐药癌症干细胞的存在高度依赖于氧化磷酸化(OXPHOS)。因此,靶向线粒体DNA(mtDNA)转录可能是抑制癌细胞生长的重要策略。近日,中国药科大学姚和权、徐进宜、姚鸿团队报道了一类新型线粒体RNA转录酶(POLRMT)小分子抑制剂的最新研究进展,该分子具有良好成药性与安全性,可通过口服途径实现抑制肿瘤生长。该研究成果发表于国际药物化学领域顶尖期刊Journal of Medicinal Chemistry(DOI: 10.1021/acs.jmedchem.3c00058)。
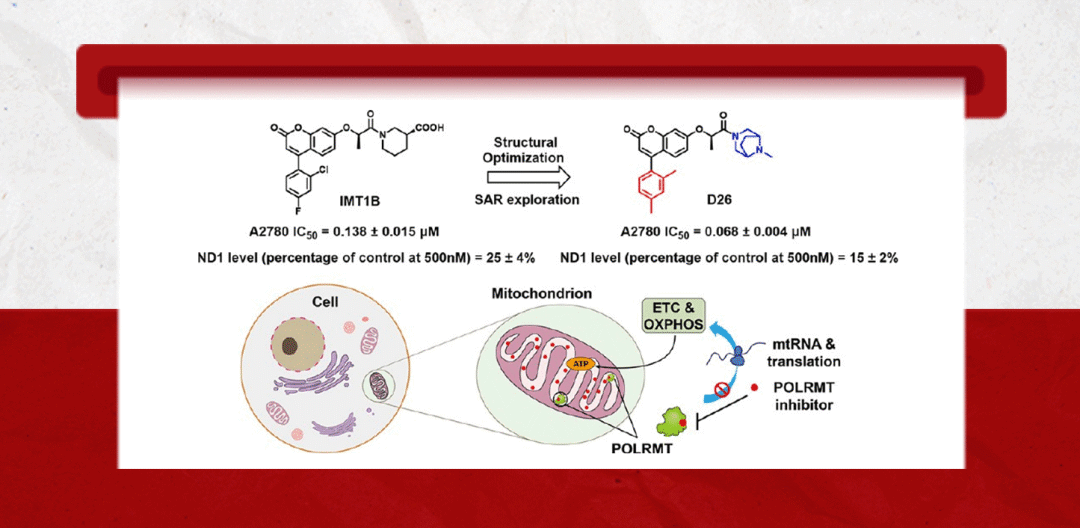
POLRMT是以mtDNA为模板的转录酶,因此在OXPHOS中起到主导地位。通过抑制POLRMT的转录活性,就可以影响新的线粒体生成以及抑制线粒体的功能。研究人员首先以Nature(DOI: 10.1038/s41586-020-03048-z)报道的POLRMT抑制剂IMT1B为先导物,利用骨架跃迁与生物电子等排等合理药物设计策略以及全面的构效关系讨论发现了强效化合物D22,优化PK后得到优选化合物D26。D26剂量依赖性的下调A2780细胞线粒体转录的水平且在撤药后其转录水平能较快恢复(图1)。用D26处理后,由mtDNA编码的呼吸链复合体Ⅰ、Ⅲ、Ⅳ中的亚基NDUFB8、UQCRC2和COXI的蛋白表达水平显著降低(图2);而对细胞核编码的复合体II和ATP合酶的F1亚复合物的亚单位(SDHB和ATP5A)的表达无影响(图2)。
线粒体是细胞内的中心枢纽,协调人体健康所需的各种代谢反应。线粒体通过其氧化磷酸化(OXPHOS)系统提供大部分细胞能量,该系统需要核基因组和线粒体基因组编码的基因的协调表达。此前已有报道称,多种癌细胞的生长和耐药癌症干细胞的存在高度依赖于氧化磷酸化(OXPHOS)。因此,靶向线粒体DNA(mtDNA)转录可能是抑制癌细胞生长的重要策略。近日,中国药科大学姚和权、徐进宜、姚鸿团队报道了一类新型线粒体RNA转录酶(POLRMT)小分子抑制剂的最新研究进展,该分子具有良好成药性与安全性,可通过口服途径实现抑制肿瘤生长。该研究成果发表于国际药物化学领域顶尖期刊Journal of Medicinal Chemistry(DOI: 10.1021/acs.jmedchem.3c00058)。
POLRMT是以mtDNA为模板的转录酶,因此在OXPHOS中起到主导地位。通过抑制POLRMT的转录活性,就可以影响新的线粒体生成以及抑制线粒体的功能。研究人员首先以Nature(DOI: 10.1038/s41586-020-03048-z)报道的POLRMT抑制剂IMT1B为先导物,利用骨架跃迁与生物电子等排等合理药物设计策略以及全面的构效关系讨论发现了强效化合物D22,优化PK后得到优选化合物D26。D26剂量依赖性的下调A2780细胞线粒体转录的水平且在撤药后其转录水平能较快恢复(图1)。用D26处理后,由mtDNA编码的呼吸链复合体Ⅰ、Ⅲ、Ⅳ中的亚基NDUFB8、UQCRC2和COXI的蛋白表达水平显著降低(图2);而对细胞核编码的复合体II和ATP合酶的F1亚复合物的亚单位(SDHB和ATP5A)的表达无影响(图2)。
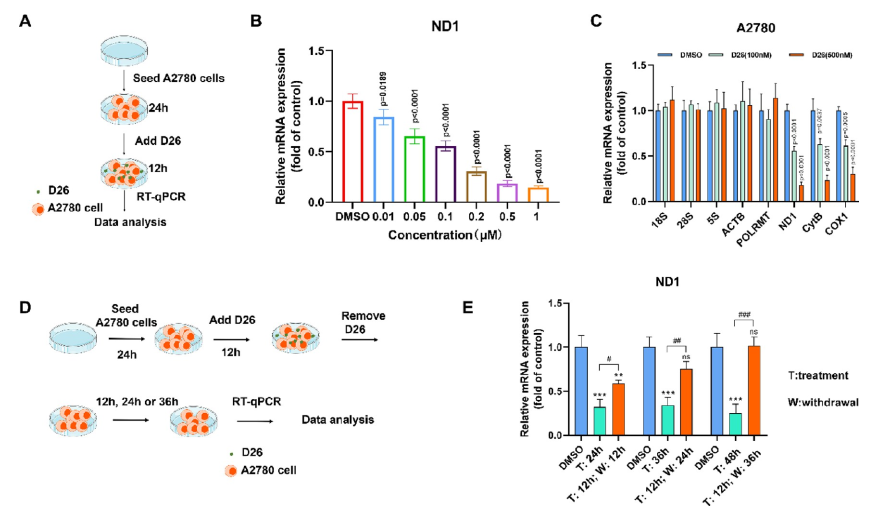
图1. D26降低线粒体相关基因的表达水平
(来源:J. Med. Chem.)
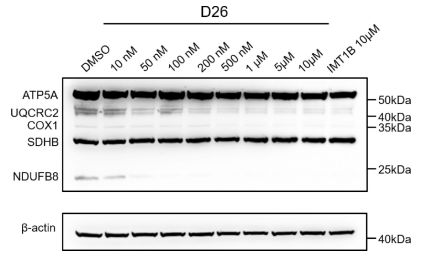
图2. D26处理后OXPHOS蛋白水平的免疫印迹分析
(来源:J. Med. Chem.)
研究人员随后通过细胞周期、凋亡、线粒体膜电位检测、ROS生成等试验考察其作用机制。发现D26能阻滞癌细胞于G1期(图3),但不诱导细胞凋亡(图3)、线粒体膜电位(图4)与ROS(图4)生成基本无变化。研究人员推测该抑制剂仅通过抑制癌细胞增殖而不诱导细胞死亡或增加细胞凋亡率。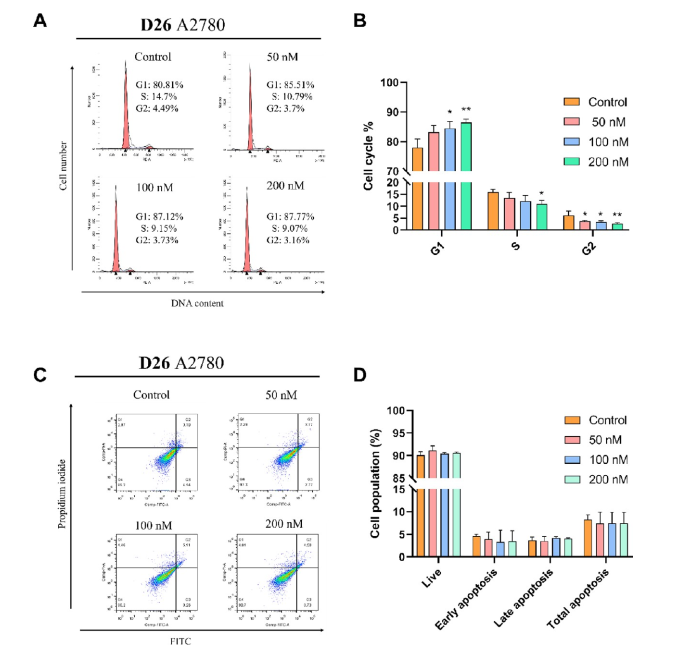
图3. D26的细胞周期与凋亡分析
(来源:J. Med. Chem.)
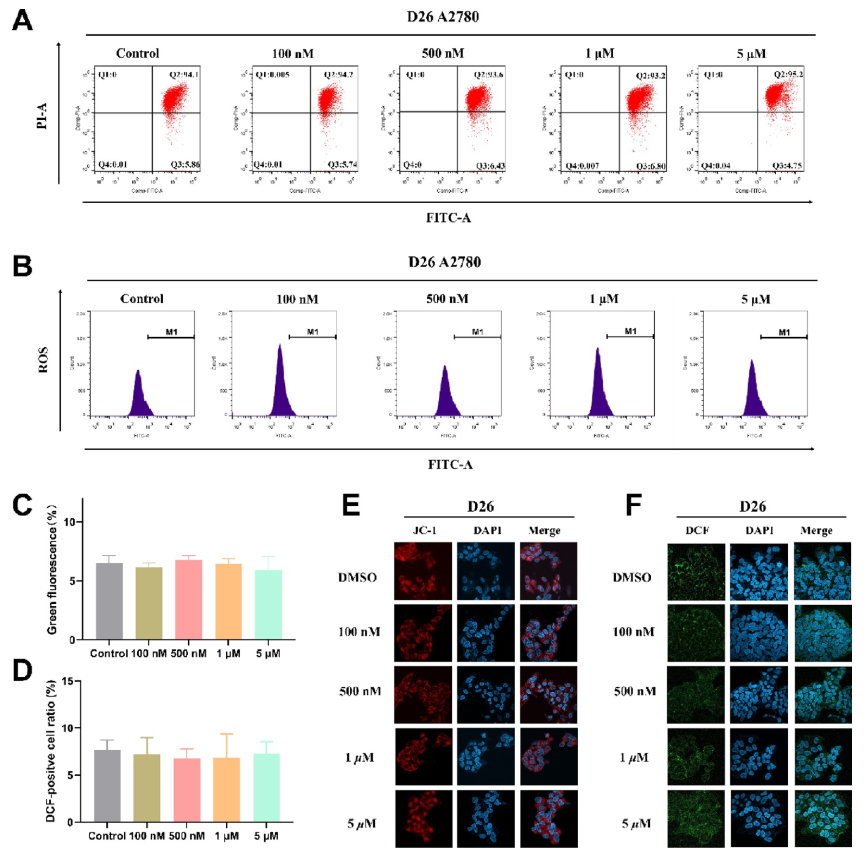
图4. D26处理后的的线粒体膜电位与ROS变化
(来源:J. Med. Chem.)
进一步研究表明,D26具有良好的成药性,在水溶性研究中,其溶解性相较于IMT1B提升35倍。随后研究人员进一步利用A2780荷瘤小鼠肿瘤模型考察D26的抗肿瘤效果。D26可以显著且剂量依赖性地减小肿瘤体积。给药27天后,D26以50 mg/kg的剂量使肿瘤重量降低54.82%,与IMT1B(100 mg/kg)组的56.75%相当(图5)。当D26的剂量增加到100 mg/kg时,肿瘤重量下降率达到68.66%。在分子水平上,用D26治疗的小鼠降低了肿瘤中的线粒体转录水平,在D26治疗组中对分化组织(心脏和肝脏)中的线粒体转录几乎没有影响(图5)。此外,用D26治疗降低了肿瘤中的呼吸链亚基水平(图5)。这些结果表明D26通过降低mtDNA转录水平使其在体内具有有效的抗肿瘤活性,并且具有很好的安全性。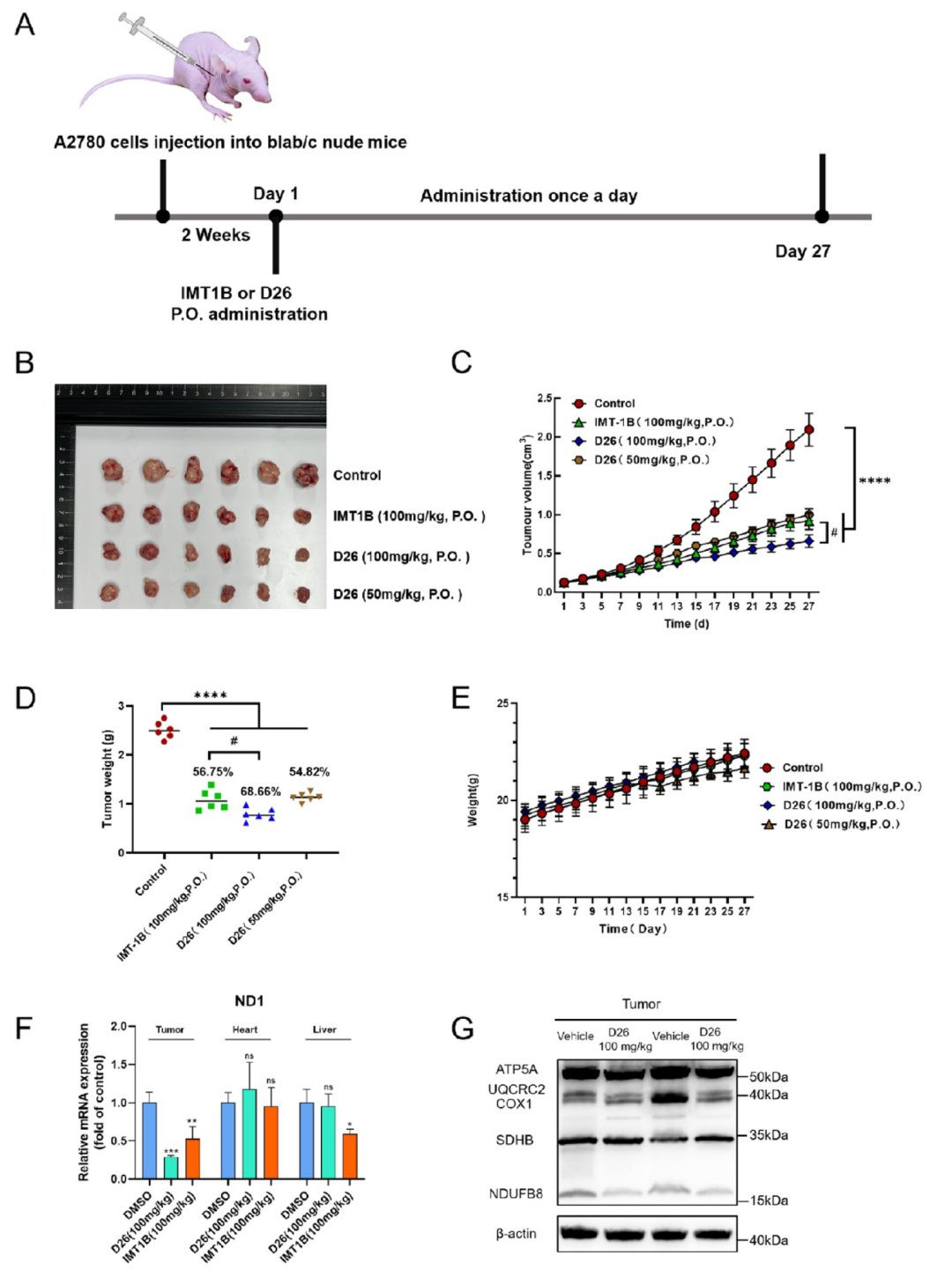
图5. D26显著抑制肿瘤生长
(来源:J. Med. Chem.)
总之,作者针对线粒体转录过程,设计并发现了新型口服POLRMT抑制剂D26。其具有靶标活性好、类药性佳、安全性高、抗肿瘤活性优异等优势,具有作为新型抗肿瘤药物进一步开发的潜力,为POLRMT抑制剂的开发提供了的思路与参考。该论文第一作者为中国药科大学博士研究生李新楠,通讯作者分别为中国药科大学药学院姚和权教授、徐进宜教授、姚鸿副研究员。该研究得到了国家自然科学基金面上项目和“双一流”中央高校基本科研业务费专项资金(中国药科大学)等项目的资助。
教授简介
 姚和权:博士,中国药科大学药学院院长、药学院药物化学系教授,博导。现任中国药科大学药学院院长,兼任江苏省青联委员,江苏省青年科学家联合会执委。分别于1998年和2001年在中国药科大学获学士学位和硕士学位,2004年博士毕业于中科院上海有机化学研究所,同年赴美国斯坦福大学大学进行博士后研究,2008年1月任中国药科大学药学院药物化学专业教授。入选2009年度教育部新世纪优秀人才支持计划,获2010年度教育部霍英东基金(基础性研究课题)资助,作为骨干成员入选2011年度教育部创新团队。已主持“十一五”、“十三五”重大新药创制国家科技重大专项、国家自然科学基金面上项目、青年项目、江苏省高等学校优秀科技创新团队等国家及省部级研究项目和人才项目10余项。迄今已在J. Am. Chem. Soc、Nat Commun、Angew Chem Int Ed、PNAS、Sci Adv、Acs Catal、J Med Chem等国际知名刊物上发表SCI论文120余篇,论文总被引次数超过4500次。
研究方向:
1. 活性天然产物的全合成、结构修饰和生物学评价研究:
针对具有强生物活性的天然产物如生物碱类、环状萜类,开展活性天然产物的全合成、结构修饰与生物学评价及基于活性天然产物模板的创新药物研究。
2.以有机化学为基础,以复杂活性天然分子、活性先导化合物以及现有药物的高效、绿色合成为目标,开展活性分子合成导向的不对称催化反应方法学研究。
课题组网址:http://yjsy.cpu.edu.cn/4a/8d/c7670a84621/page.htm
姚和权:博士,中国药科大学药学院院长、药学院药物化学系教授,博导。现任中国药科大学药学院院长,兼任江苏省青联委员,江苏省青年科学家联合会执委。分别于1998年和2001年在中国药科大学获学士学位和硕士学位,2004年博士毕业于中科院上海有机化学研究所,同年赴美国斯坦福大学大学进行博士后研究,2008年1月任中国药科大学药学院药物化学专业教授。入选2009年度教育部新世纪优秀人才支持计划,获2010年度教育部霍英东基金(基础性研究课题)资助,作为骨干成员入选2011年度教育部创新团队。已主持“十一五”、“十三五”重大新药创制国家科技重大专项、国家自然科学基金面上项目、青年项目、江苏省高等学校优秀科技创新团队等国家及省部级研究项目和人才项目10余项。迄今已在J. Am. Chem. Soc、Nat Commun、Angew Chem Int Ed、PNAS、Sci Adv、Acs Catal、J Med Chem等国际知名刊物上发表SCI论文120余篇,论文总被引次数超过4500次。
研究方向:
1. 活性天然产物的全合成、结构修饰和生物学评价研究:
针对具有强生物活性的天然产物如生物碱类、环状萜类,开展活性天然产物的全合成、结构修饰与生物学评价及基于活性天然产物模板的创新药物研究。
2.以有机化学为基础,以复杂活性天然分子、活性先导化合物以及现有药物的高效、绿色合成为目标,开展活性分子合成导向的不对称催化反应方法学研究。
课题组网址:http://yjsy.cpu.edu.cn/4a/8d/c7670a84621/page.htm
 徐进宜:药学博士,中国药科大学药学院药物化学系教授,博导。1986年毕业于中国药科大学,留校任教30余年,一直工作在教学科研第一线,先后讲授了药物化学、药物合成反应、药物分子设计、药学英语、专业英语等课程。协助指导和独立指导过博士、硕士研究生80余名。在国内外期刊发表论文120多篇,其中SCI论文90余篇;申请国内外发明专利30多项,授权20项;参编著作12部。曾经获得“教书育人”优秀教师奖;教育部优秀青年教师;国家科技部优秀论文二等奖;广东省科学技术奖励一等奖;中国药科大学先进科技工作者等荣誉。
曾担任国家科技进步奖、国家863计划评审专家、国家自然科学基金评审专家、农业部兽药审评、江苏省新药审评专家;担任了Journal of Medicinal Chemistry、Current Medicinal Chemistry、European Journal of Medicinal Chemistry、Bioorganic & Medicinal Chemistry等国际杂志特约审稿人。
研究方向:
1. 活性天然产物的合成、结构优化与生物活性研究:基于具有生物活性天然产物的结构,研究其可能的作用机制及合成方法,发现具有活性的最简化学结构,并针对其成药性进行结构优化研究(硕士招生方向)。
2. 针对重大疾病的创新药物研究:对严重危害人类健康的重大疾病,根据其相关的生理、生化知识,开展药物分子的创新设计、合成和成药性优化研究(博士招生方向)。
课题组网址:http://yjsy.cpu.edu.cn/0f/f9/c6398a69625/page.htm
徐进宜:药学博士,中国药科大学药学院药物化学系教授,博导。1986年毕业于中国药科大学,留校任教30余年,一直工作在教学科研第一线,先后讲授了药物化学、药物合成反应、药物分子设计、药学英语、专业英语等课程。协助指导和独立指导过博士、硕士研究生80余名。在国内外期刊发表论文120多篇,其中SCI论文90余篇;申请国内外发明专利30多项,授权20项;参编著作12部。曾经获得“教书育人”优秀教师奖;教育部优秀青年教师;国家科技部优秀论文二等奖;广东省科学技术奖励一等奖;中国药科大学先进科技工作者等荣誉。
曾担任国家科技进步奖、国家863计划评审专家、国家自然科学基金评审专家、农业部兽药审评、江苏省新药审评专家;担任了Journal of Medicinal Chemistry、Current Medicinal Chemistry、European Journal of Medicinal Chemistry、Bioorganic & Medicinal Chemistry等国际杂志特约审稿人。
研究方向:
1. 活性天然产物的合成、结构优化与生物活性研究:基于具有生物活性天然产物的结构,研究其可能的作用机制及合成方法,发现具有活性的最简化学结构,并针对其成药性进行结构优化研究(硕士招生方向)。
2. 针对重大疾病的创新药物研究:对严重危害人类健康的重大疾病,根据其相关的生理、生化知识,开展药物分子的创新设计、合成和成药性优化研究(博士招生方向)。
课题组网址:http://yjsy.cpu.edu.cn/0f/f9/c6398a69625/page.htm

姚鸿,1989年10月生,药学博士,副研究员,硕士生导师。2013年本科毕业于中国药科大学基础药学理科基地班,2018年获中国药科大学药物化学博士学位,同年留校于药学院药物化学系担任师资博士后,2021年晋升为副研究员。以第一或通讯作者身份在Angew Chem Int Ed、J Med Chem、Acta Pharm Sin B、Eur J Med Chem、Chem Commun 等国际知名刊物上发表SCI论文20余篇,申请发明专利10余项。
研究方向: (1) 基于靶点的小分子药物设计 (2) 活性天然产物的结构改造与修饰 (3) 肽类药物设计 课题组网址:https://yjszs.cpu.edu.cn/64/14/c10978a156692/page.htm
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)