首页 > 医疗资讯/ 正文
雷帕霉素靶蛋白(target of rapamycin,TOR)是一种丝氨酸/苏氨酸蛋白激酶,先后在酵母和哺乳动物中被发现,被统称为mTOR。mTOR包括mTORC1和mTORC2,前者对雷帕霉素敏感,经磷脂酰肌醇3-激酶(phosphatidylinositide 3-kinases,PI3K)/蛋白激酶B(protein kinase B,PKB,又称AKT)/mTOR、人第10号染色体缺失的磷酸酶及张力蛋白同源的基因(phosphatase and tensin homolog deleted on chromosome ten,PTEN)/AKT/mTOR、AMP激活蛋白激酶(AMP-activated protein kinase,AMPK)/mTOR、mTOR/核转录因子-κB(nuclear transcription factor-κB,NF-κB)等信号通路参与细胞生长、增殖、凋亡、能量代谢和自噬的调节,后者对雷帕霉素不敏感,主要调节细胞骨架重组和细胞存活[ 1 , 2 , 3 ]。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路可促进肠道炎症反应,与炎症性肠病(inflammatory bowel disease,IBD)发病机制息息相关,例如参与免疫细胞分化、自噬和组织恢复的调节,并且研究表明IBD患者的肠黏膜组织中mTOR信号通路上调[ 4 , 5 , 6 , 7 , 8 , 9 , 10 , 11 ]。雷帕霉素作为mTOR抑制剂,可通过阻断mTOR信号通路治疗相关疾病。为更好地理解雷帕霉素在IBD中的应用前景,本文从雷帕霉素的作用机制、临床应用以及治疗IBD的现状进行综述。
一、雷帕霉素的作用机制
雷帕霉素作为一种大环内酯类药物,最初是从Streptomyces hygroscopicus代谢物中分离出来的,主要作为抗真菌药物使用。后来发现雷帕霉素具有免疫抑制、抗肿瘤、神经保护、神经再生和延长寿命等作用。如 图1 所示,雷帕霉素可通过与胞内受体FK506结合蛋白12(FK506 binding protein 12 kDa,FKBP12)结合形成FKBP12-雷帕霉素复合体,再与mTOR的FRB结构域结合从而抑制其下游靶蛋白反应,如抑制NF-κB通路、激活自噬相关蛋白、影响脂质和蛋白合成以及糖酵解等[ 12 ]。
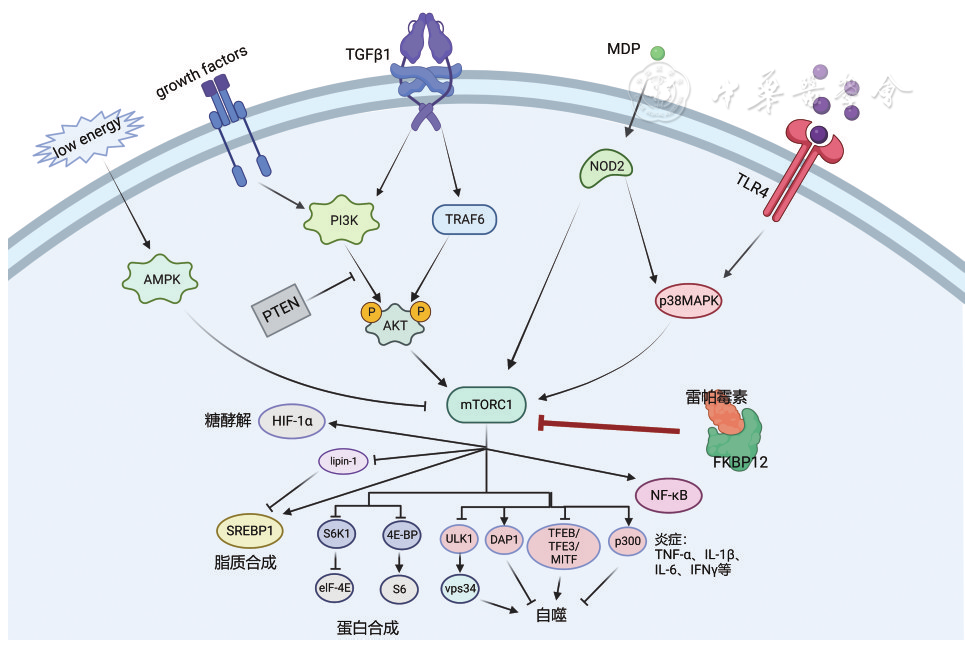
图1 雷帕霉素-FKBP12复合体阻断mTOR信号通路机制图(绘制于BioRender.com)
二、雷帕霉素在临床中的应用
1.器官移植:1999年美国食品药品管理局批准将雷帕霉素作为免疫抑制剂用于肾移植抗排异治疗。此后,雷帕霉素或其衍生物也应用于心脏、肝脏、肺、胰腺等器官移植受者,能有效抑制排斥反应[ 13 , 14 , 15 ]。研究发现,把器官移植的免疫抑制方案从经典药物尤其是钙调磷酸酶抑制剂改为mTOR抑制剂,可显著降低新发恶性肿瘤和既往恶性肿瘤复发的发生率[ 16 ]。
2.肿瘤:癌细胞增殖所需的营养及能量要求极高,mTOR通路在细胞增殖以及能力代谢过程中发挥重要作用,且较多癌症患者中的mTORC1的激活增加,使得mTOR抑制剂治疗癌症成为可能[ 17 ]。研究表明,雷帕霉素衍生物如替西罗莫司和依维莫司已在临床上用于治疗晚期肾细胞癌,依维莫司还用于治疗胰腺神经内分泌肿瘤和晚期乳腺癌[ 18 ]。此外,还有许多临床试验在评估雷帕霉素衍生物治疗其他癌症 18 ]。总的来说,雷帕霉素衍生物抗癌效果主要体现在实体瘤方面。
3.自身免疫性疾病:自身免疫性疾病是由遗传易感性和环境因素导致机体产生自身抗原和抗体,造成慢性炎症、组织破坏和器官损伤的一种系统性疾病。mTOR在免疫反应中有重要作用,参与多种免疫细胞的功能调节,因此有可能成为治疗自身免疫性疾病的靶标之一。既往研究表明,雷帕霉素及其衍生物对多种自身免疫性疾病在临床试验中显示出治疗效果,包括系统性红斑狼疮(systemic lupus erythematosus,SLE)、类风湿关节炎、系统性硬化症、多内分泌病肠病X连锁综合征等[ 6 , 19 , 20 , 21 , 22 ]。一项单臂、开放标签1/2期临床试验结果显示,雷帕霉素可减轻SLE疾病活动程度,SLE疾病活动指数从入组时的10.2分下降到治疗12个月后的4.8分,大不列颠群岛狼疮评估组指数从入组时的28.4分下降到治疗12个月后的17.4分,并且控制疾病活动所需的泼尼松龙剂量从23.7 mg降至7.2 mg[ 19 ]。另外,雷帕霉素或其衍生物在自身免疫性干眼病、自身免疫性泪腺炎、重症肌无力等疾病的动物模型中也显示出治疗效果[ 23 , 24 , 25 ]。
三、雷帕霉素在IBD的应用
mTOR作为自噬的关键分子,对于维持肠道稳态、生态调节、免疫反应等至关重要,与IBD的发生发展息息相关[ 26 ]。而雷帕霉素作为经典的mTOR抑制剂,具备的多种活性以及在器官抑制、肿瘤和多种自身免疫性疾病上体现出来的治疗效果激发众多研究者对雷帕霉素在IBD应用的兴趣。
目前不少动物研究提示雷帕霉素及其衍生物对葡聚糖硫酸钠(DSS)、2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzene sulfonic acid,TNBS)或脂多糖诱导的小鼠肠炎具有治疗作用[ 5 , 27 , 28 ]。在肠道纤维化方面,雷帕霉素可以通过抑制单核吞噬细胞中的C-X3-C基序配体1(C-X3-C motif chemokine 1,CX3Cr1)+mTOR/自噬和上调白细胞介素(interleukin,IL)-23/IL-22轴来减少TNBS诱导的小鼠肠道纤维化[ 29 ]。雷帕霉素及其衍生物能够抑制转化生长因子-β(transforming growth factor-β,TGF-β)信号转导激活mTORC1,从而调节炎症过程[ 1 ]。同时,TGF-β与Smad通路、上皮-间充质转化息息相关,故其在肠道纤维化过程中发挥着重要作用。
目前雷帕霉素治疗IBD的临床研究较少,相关研究提示雷帕霉素治疗难治性和狭窄型IBD有较好的效果( 表1 )。Massey等[ 30 ]首次报道1例重度难治性克罗恩病(Crohn′s disese,CD)患者,该患者对硫唑嘌呤、甲氨蝶呤和英夫利西单克隆抗体等治疗均失应答,使用雷帕霉素治疗6个月,药物血清谷浓度维持在5 ng/ml,症状明显改善,Harvey-Bradshaw指数从13分降至3分,C-反应蛋白从79 mg/L降至2 mg/L,内镜下表现也显著改善。另外,Mutalib等[ 31 ]一项回顾性研究纳入14例接受雷帕霉素治疗的难治性IBD患者,包括11例溃疡性结肠炎(ulcerative colitis,UC)和3例CD;其中5例UC患者实现黏膜愈合,2例临床应答;所有CD患者均进入临床缓解期,其中2例实现黏膜愈合。CD相关的纤维化狭窄目前也是IBD治疗中的一个难点。一项试点研究纳入15例狭窄型CD患者,给予2 mg/d雷帕霉素和短期肠内营养治疗,结肠受累的患者同时接受5-氨基水杨酸治疗,结果显示5例上消化道狭窄患者均在6个月内实现临床应答,而7例下消化道狭窄患者均未应答(≥6个月),无死亡及严重机会感染事件发生,考虑雷帕霉素可能对上消化道狭窄型CD有效,但对下消化道无效[ 32 ]。但一项依维莫司、硫唑嘌呤和安慰剂维持中重度CD缓解的多中心随机双盲试验提示,依维莫司维持缓解率仅为22%,低于硫唑嘌呤组(38.3%)和安慰剂组(28.8%)[ 33 ]。上述研究的用药方案、目的以及目标人群不一致,研究结论也不同,这提示雷帕霉素对部分IBD患者是有效的,但适宜的患者群体、用药方案和使用时机也有待进一步确认。
表1 雷帕霉素及其衍生物治疗炎症性肠病的临床研究
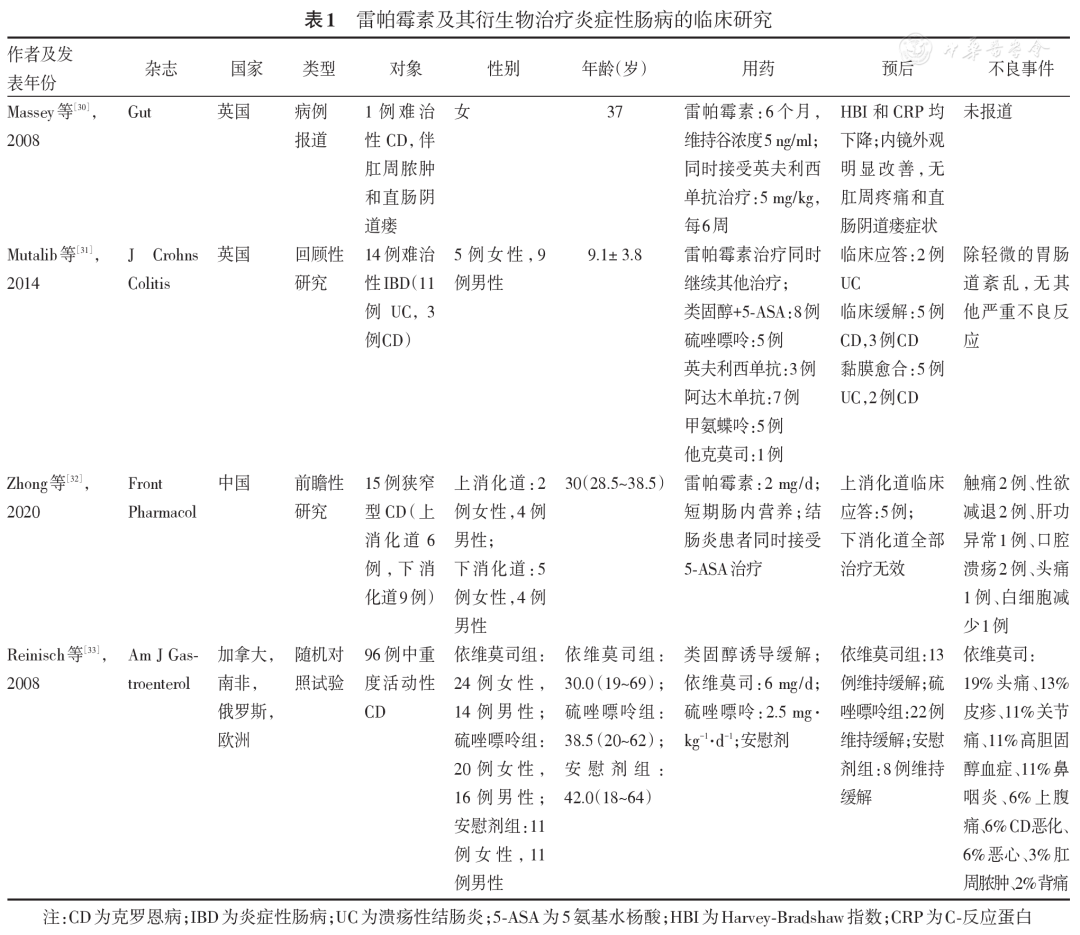
雷帕霉素的常见不良反应主要包括血小板减少、贫血、白细胞减少、发热、感染、高血压、代谢紊乱、头痛、腹痛、消化系统异常等。Mutalib等[ 31 ]研究仅观察到轻微的胃肠道紊乱,没有其他严重不良反应发生。我国学者的试点研究中,6例患者出现不良反应,主要包括2例出现性欲减退(13.3%)、1例肝酶异常(6.7%)、2例口腔溃疡(13.3%)、1例头痛(6.7%)、3例皮疹(13.3%)、1例白细胞减少(6.7%)、3例其他不适(13.3%),无严重感染或死亡病例[ 32 ]。总的来说,与服用雷帕霉素相关的不良事件呈剂量和(或)浓度依赖性,不良反应的发生率随血药谷浓度的升高而升高。因此在雷帕霉素治疗过程中应定期检测不良事件相关的指标以及药物谷浓度。
四、展望
目前体外实验和动物实验均提示雷帕霉素及其衍生物在治疗IBD方面具有一定的潜力,但临床证据较少。因此,雷帕霉素及其衍生物在IBD中的目标人群、使用时机和用药方案值得更进一步的探索和研究。目标人群的探索包括适用的类型如狭窄型、难治性IBD或是有特殊基因突变的IBD。使用时机和用药方案包括疾病活动程度、单独用药或联合用药,从而为临床治疗IBD提供更多的方法和依据。
参考文献:
向冰洁,张淇,张敏,等. 雷帕霉素在炎症性肠病中的应用前景[J]. 中华炎性肠病杂志,2023,07(03):297-300.DOI:10.3760/cma.j.cn101480-20220815-00127
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)