首页 > 医疗资讯/ 正文
目的:回顾当前心源性休克(CS)患者的治疗方法。
数据来源:我们回顾了有关CS的重要医学文献。
研究选择:我们纳入了专业协会的科学陈述和验证CS患者结局的临床研究,重点是随机临床试验。
数据提取:我们提取了有关CS治疗的重要研究结果和科学陈述建议。
数据整合:专业协会的建议与评估研究相结合。
结论:尽管采用标准治疗,CS导致的短期死亡率仍超过 30%。虽然急性心肌梗死(AMI) 一直是大多数有关CS研究的焦点,但心力衰竭相关的CS在许多中心现已占据了主导地位。CS可以表现为多种不同严重程度的休克,包括持续存在低灌注但血压仍正常的患者。心血管造影和介入协会的休克分期标准,是根据休克严重程度对CS患者或有CS风险的患者进行分类,从而预测死亡率的。CS 群体包括了由心室功能、血流动力学特征、生物标志物和其他临床变量定义的异质表型组合。将休克严重程度与有着不可改变的死亡危险因素的CS表型相结合,可以指导临床决策和预测预后。识别和治疗CS的病因对于成功救治患者至关重要,包括早期对 AMI 的罪犯血管进行血运重建。调整血管升压药和正性肌力药物以恢复动脉压和全身灌注是CS初始药物治疗的基石。临时机械循环支持 (MCS) 适用于经过评估筛选的患者,作为恢复、决策、长期MCS或心脏移植的桥接手段。随机对照试验尚未能证明常规使用临时MCS可以提高 CS 患者的生存率。因此,应采用基于多学科团队的方法,根据休克的严重程度、表型和撤出策略,根据每位CS患者的需求定制个体化的血流动力学支持方案。
关键词: 急性心肌梗死;心源性休克;心衰;机械循环支持;休克
心源性休克 (CS) 是心血管疾病导致循环衰竭、灌注不足和终末器官功能障碍的最终共同途径。随着时间的推移,成年CS患者的短期死亡率有所下降,但在住院期间仍超过30%,并在30天后增加到40-50%。需要早期识别和有效治疗CS,以防止休克恶化,最终导致死亡。CS的治疗在很大程度上仍由专家共识推动,因为几乎没有足够有力的随机临床试验 (RCT) 证明CS患者的生存率与标准治疗相比有所改善。在CS患者中进行随机对照试验的困难很多,包括:难以获得患方的同意、对两组治疗平衡方面的顾虑、疾病异质性以及不同中心和国家之间缺乏标准化治疗。因此,重新评估当前CS相关研究的目标、并执行这些研究是很有必要的。本文总结了当前CS 的治疗,基于2022年重症监护临床研究者研讨会上举行的文献综述和讨论,该研讨会是国际CS专家的聚会,重点是批判性地评估当前的CS治疗策略、正在进行的试验、并为未来的随机对照试验的设计提出建议。
CS 的流行病学、定义和分类
CS 的流行病学变化
一直以来,急性心肌梗死 (AMI) 都是CS最常见的病因,几乎所有已发表的CS随机对照试验都专门招募急性心梗相关的心源性休克(AMI-CS)患者,很少有针对其他病因的CS患者的随机对照试验。非AMI 原因导致的CS现在可能在一些中心占据了主导地位,因为非AMI原因导致的CS相对增加,包括新发的或慢性心肌病伴失代偿性心力衰竭 (HF) 的患者。流行病学的变化对治疗和随机对照试验都有影响,因为AMI-CS 和 心衰相关的心源性休克(HF-CS) 患者具有不同的病理生理学、临床表现和治疗方法。新发 HF-CS的患者(例如:急性心肌炎或新诊断的心肌病)可能与慢性心肌病引起的 HF-CS 患者存在更深一层的差异,后者由于长期适应而能够耐受较差的心功能和较低的心输出量。
CS 定义的演变
广义的CS就是由于低心输出量导致的组织和器官低灌注,这可能是由于心肌功能障碍或梗阻性原因(例如:心包填塞)引起的,需要进行特定的干预。CS 的传统临床定义和研究定义包括三联征:低血压(例如:收缩压 < 90 mm Hg)、低心输出量(尽管有足够的前负荷),以及低灌注(例如:乳酸升高、四肢发冷或花斑、精神状态改变、少尿)。部分CS患者由于代偿机制的保护,早期可能不存在低血压;这些患者被称为血压正常的CS。由于心输出量低而出现低血压,但无低灌注的患者被归类为临界休克(图.1)。临界休克患者的预后优于血压正常的CS 患者,而血压正常的CS患者的预后又优于低血压的CS患者,这凸显了早期识别和逆转低灌注,是促进及时稳定病情的机会。最近的研究强调低灌注(特别是血乳酸水平升高)在决定预后方面的重要性,而不是血压或血流动力学。
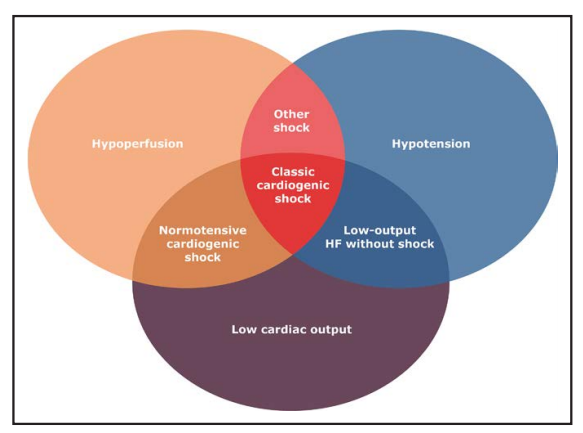
图1. 概念模型显示不同血流动力学受累状态之间的互相重叠。休克的定义是存在灌注不足;大多数(但不是全部)患者也会出现低血压。不符合休克标准的血流动力学不稳定患者被标记为临界休克。
CS的分类
CS 中的严重程度分期 鉴于临床实践中可能遇到的CS各种严重程度、且范围较宽,心血管造影和介入协会 (SCAI) 制定了休克分期的标准,该分期方法为急性心血管疾病患者定义了逐渐升级的CS严重程度,共五期(标记为 A 到 E),包括AMI 或失代偿性心力衰竭(图2) 。血流动力学稳定的急性心血管疾病患者被分为 SCAI 休克A期(“有风险”),血流动力学不稳定且无低灌注的患者分为SCAI休克B 期(“开始”或临界休克),那些存在低灌注除了液体复苏以外,还需要其它干预措施的患者被诊断存在休克(SCAI 休克分期的 C、D 和 E期)。SCAI 休克分期为临床交流和研究中的 CS 特征提供了有用的工具。验证研究一致证明 SCAI休克分期与预后相关,每个较高的 SCAI 休克阶段死亡率都会逐渐升高。修订后的 SCAI休克分期强调了每个SCAI休克阶段中都存在的CS严重程度和死亡风险范围。在临界休克(SCAI 休克 B 期)和轻度或血压正常的CS(SCAI 休克 C期)患者中观察到的死亡风险并非微不足道,这恰恰强调了在疾病过程中及早识别CS的重要性。
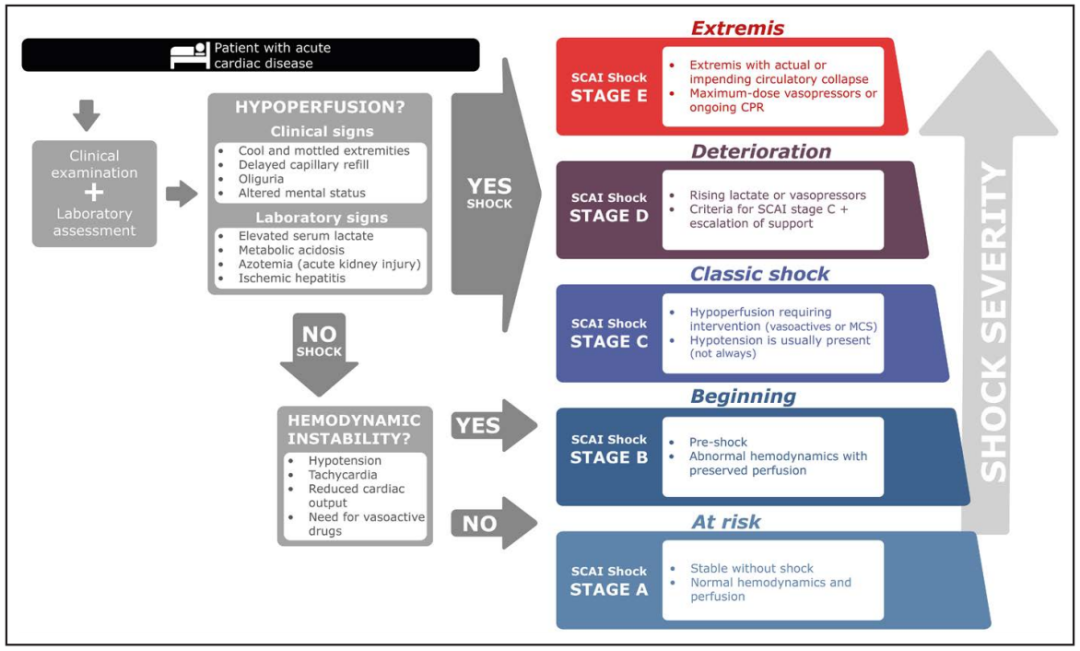
图2.血管造影和介入学会(SCAI)制定的休克分期。
CS的表型 CS 是一种血流动力学多样化的疾病,包括了不同类型的心功能、充盈压、外周血管张力和心输出量。右心(RV)或双心室功能障碍和充血的患者,休克严重程度更高,器官衰竭更多,并且预后更差。三分之一的患者可能不存在充血(“冷又干”)。CS 的病因,特别是AMI,获得成功的血运重建,会影响临床表现和临床病程。AMI 和 CS 可诱导促炎介质的释放,引起全身炎症反应,从而引发微循环受损、血管舒张不当和进一步的器官功能障碍。由伴或不伴感染的全身炎症引起的混合血管舒张性CS与更严重的休克程度、更多的器官衰竭和更差的预后相关。多达 30-50% 的 CS患者伴有心脏骤停 (CA),这与心肌功能障碍、全身缺血再灌注损伤、全身炎症和较高的死亡率相关。CS 的末期特点是严重乳酸性酸中毒和多器官衰竭,最近被称为“血液代谢”或“心脏代谢”休克,与右心室充血、休克严重程度增加、及较差的预后相关。
CS的预后
修订后的 SCAI 休克分期详细阐述了一个三轴模型,使个体CS患者的临床决策和预后所需的核心领域概念化:休克严重程度、表型和危险调节因素。CS 严重程度的整体评估综合了许多因素,而不仅仅是简单地定义SCAI休克分期(如图. 3)。CS的分型虽然相互关联,但与CS 的严重程度不同,可以使用超声心动图、有创血流动力学、病因学、实验室研究或其他临床变量(如图.3)来定义。风险修正因素是影响各种 CS严重程度的独立、不可改变的死亡危险因素,最值得注意的是高龄和昏迷的心跳骤停。在 SCAI 休克分级的背景下,已经确定了许多潜在的风险调节因素,包括血流动力学参数(例如,右房压)、超声心动图指标(例如,右心功能障碍)、实验室生物标志物(例如,血液代谢 CS)和临床特征(例如,休克恶化的趋势)。CA 后昏迷的患者存在不可逆的缺氧性脑损伤,即使休克逆转,也可能无法获得良好的预后。已确定的 CS患者死亡危险因素已编入综合风险评分中(例如,心源性休克中的主动脉球囊反搏[IABP-SHOCK II]评分和CS评分),与 SCAI 休克分期相结合可增强风险分层。
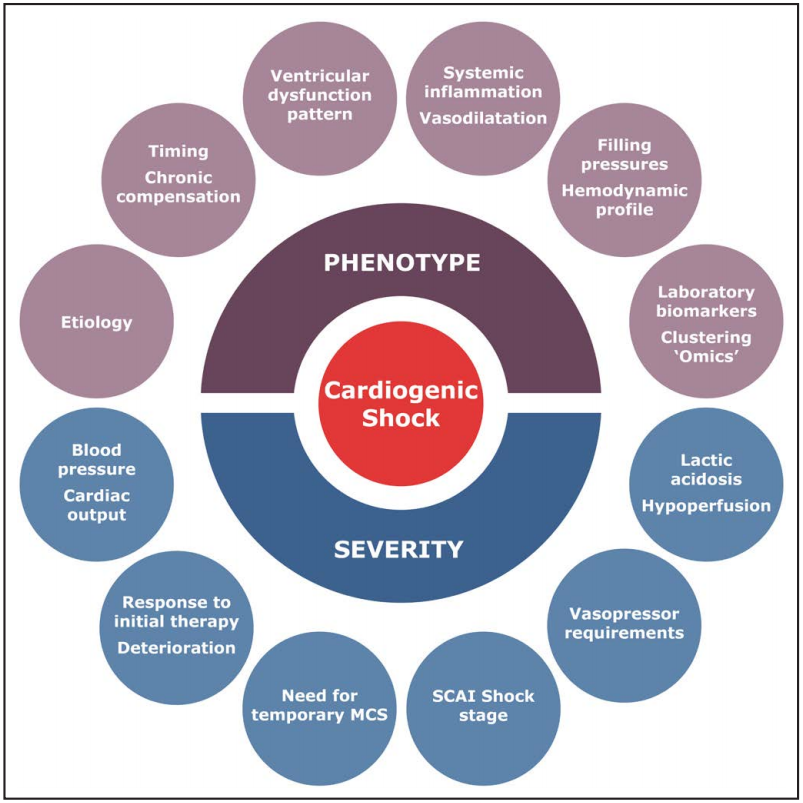
图3. 评估心源性休克患者的严重程度和表型时应考虑的因素。下半部分是休克严重程度的因素,上半部分是不同于休克表型因素。
当前的CS常规治疗
早期识别和评估
CS患者起始治疗的中心目标是对原发病因的早期识别并确定和治疗。心电图和床旁心脏超声有助于筛查心肌缺血、左心/右心功能障碍和结构性心脏病。有创血流动力学监测非常有价值,首先使用动脉导管进行精确血压测量,然后使用中心静脉导管施用血管活性药物并测量充盈压和静脉血氧饱和度。肺动脉导管监测可以提供丰富的信息,特别是对于休克表型不确定的患者和严重 CS 或对初始治疗反应不佳的患者,直接测量心输出量和全身血管阻力可以促进血管活性药物的滴定。对于已存在CS的疑似 AMI 或未确诊的心肌病患者,应尽早行冠状动脉造影。对于 AMI-CS 患者,随机对照试验表明,早期成功地对罪犯血管恢复血运重建可改善长期生存,而非罪犯血管血运重建的治疗都应推迟让路。根据已发表的随机对照试验,对 CS 患者的循证干预措施见表1。图4以 SCAI 休克分期为指导的管理框架图。
表1. 基于随机临床试验的心源性休克患者循证干预
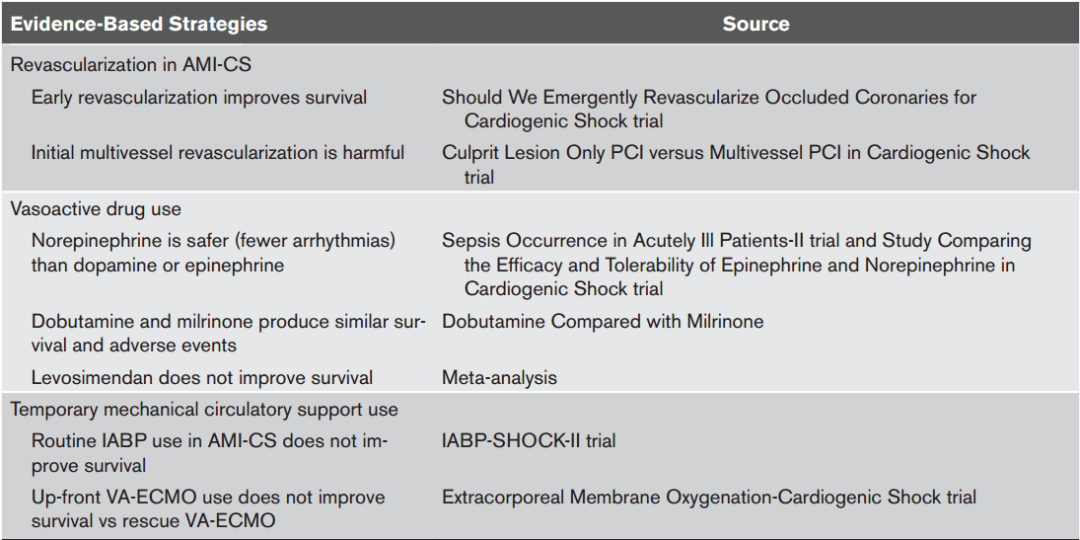
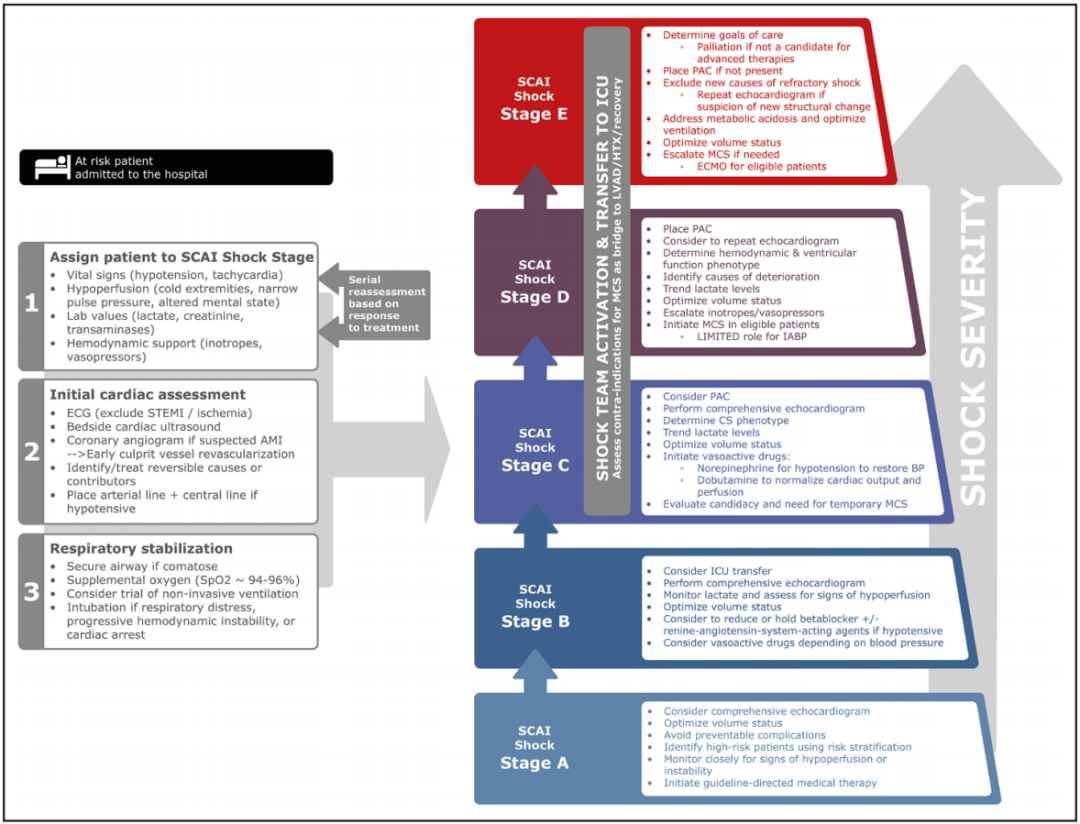
图4.根据SCAI的休克分期制定的心源性休克患者或高危患者的管理流程。流程代表了作者们基于迄今为止最佳可用证据达成的共识,并认识到决策应根据患者特定因素进行定制。AMI =急性心肌梗死,BP =血压,ECG =心电图,ECMO =体外膜氧合,HTX =心脏移植,IABP =主动脉内球囊泵,LVAD =左心室辅助装置,MCS =机械循环支持,PAC =肺动脉导管,Spo2 =脉搏血氧仪,STEMI = ST段抬高型心肌梗死。
初始呼吸支持和血流动力学的稳定
建议给予氧疗,维持动脉血氧饱和度90%以上。持续气道正压通气的无创通气可减少呼吸做功,改善肺水肿;经鼻导管高流量氧疗可能有用,特别是在患者不接受气道正压通气时。当需要有创机械通气时,可以考虑限制潮气量和驱动压的肺保护性通气策略,虽然还缺乏证据支持。尽管正压通气可以改善左心负荷状况并减轻肺水肿,但必须认识到正压通气可能会因容量状态和右心功能问题使血流动力学恶化。
没有充血体征的 CS 患者可能会从保守的液体策略(例如 250 mL晶体静滴超过 15-30 分钟)中受益;如果出现充血,则需要利尿治疗。通常应暂停使用 β 受体阻滞剂和其他降血压治疗,直至 CS 缓解(表现为没有持续低灌注或升压药物需求)。对于血压正常的CS,可考虑血管扩张剂试验(例如:静脉用硝普钠或硝酸甘油),因为这类患者全身血管阻力(左心后负荷)通常较高。尽管证据有限,升压药和正性肌力药物治疗仍然是 CS 患者初始血流动力学支持的标准。去甲肾上腺素通常是伴有 CS 的低血压患者首选的一线血管升压药,与多巴胺或肾上腺素相比,具有更高的安全性(特别是减少了心律失常发生)。CS 患者的最佳血压目标仍有待确定,可能因患者而异,我们要认识到平均动脉压低于 65 mm Hg 与较差的预后相关。根据其他休克类型人群的推断,建议目标收缩压≥ 90 mmHg,平均动脉压≥ 65 mmHg。使用升压药后,一旦动脉压恢复,可以加用正性肌力药,通过改善心输出量来恢复灌注;这通常会提升动脉压使得升压药可能减停用药。最近一项影响力有限的随机对照试验表明,多巴酚丁胺和米力农在异质CS人群中具有相似的结局和安全性,其中有三分之一受试者患有AMI-CS。值得注意的是,多巴酚丁胺具有起效快和失效快的作用,并且产生血管舒张性低血压的可能较小。去甲肾上腺素和多巴酚丁胺的组合对许多 CS 患者有用,已认识到 CS 的某些病因和表型,可能对不同药物有更好的反应。加压素可增加左心后负荷并降低心指数,适用于以右心为主的 CS或具有足够心指数的混合血管舒张 CS(例如,
心脏术后的CS)。血管升压药和正性肌力药的毒性很常见,包括过度血管收缩加重低灌注、心动过速导致心肌缺血和快速心律失常。
临时机械循环支持
血管升压药需要量越大,CS患者死亡率就越高,这可能反映了随着休克严重程度升高,药物引起的不良反应的风险就增加。当血管活性药物无效或有毒性时,临时机械循环支持(MCS)装置可以提供额外的血流动力学支持。IABP由于其成本低、易于植入和并发症风险相对较低,在许多国家仍然是最常用的临时MCS装置。由于IABP未能提高AMI-CS患者的生存率,因此不推荐在这种情况下常规使用。IABP降低左室后负荷,因此推测它可能对HF-CS患者有用,特别是在休克严重程度较低的患者。IABP仍然适用于AMI发生机械并发症时,包括乳头状肌断裂或室间隔破裂。经皮左心室辅助装置(pLVADs)比IABP提供更大的血流动力学支持,但尚未证明其能提高生存率,并可能增加出血、血栓栓塞和肢体缺血等并发症的风险。经皮右心室辅助装置(pRVSD)可单独使用(用于孤立性右心衰竭)或与pLVAD联合使用(用于双心室衰竭),但尚未在随机对照试验中进行验证。VA-ECMO是唯一可以提供强大的双心室心脏支持和肺支持的临时MCS设备,可用于严重或难治性CS (SCAI休克D期和E期),包括持续CA患者。然而,最近的ECMO-CS试验,把早期VA-ECMO与初始药物治疗加挽救性VA-ECMO(39%)相比,结果显示并未能提高生存率。VA-ECMO可增加左室后负荷,可能导致左室舒张末压升高、左室扩张和主动脉瓣开度受损。因此,在VA-ECMO期间提供LV卸载(“排血”)可能很重要,可以通过联合IABP或pLVAD等替代方案来实现。考虑到随机对照试验并没有显示任何MCS装置在CS患者中可改善预后,尽管在一些患者中有潜在的获益,但在未经加以筛选的CS患者中不推荐常规使用MCS装置。
现有的证据不足以确定哪些患者可能从临时的MCS中受益,并且许多极高风险的患者即使接受了强有力的MCS,其预后也表现不佳。但进展到休克晚期,再予以MCS可能也不足以挽救患者。在获得足够的证据之前,由多学科休克小组使用结构化的评估方法和标准化的治疗方案(基于有创血流动力学数据)进行评估似乎是严重CS个体化治疗的最佳方法。仍然需要进一步研究,以了解休克小组反应要素中(如:有创血流动力学评估,快速实施和升级临床MCS,多学科协调,标准流程)哪一条是使患者获益的。
我们选择临时MCS患者的一般原则与SCAI休克分期三轴模型一致。使用了血管活性药物仍不能得到充分血流动力学支持的患者(或出现血管活性药物毒性的患者)更需要临时MCS,并且最好在确定符合条件后立即开始MCS。应使用的MCS类型由CS表型决定,特别是存在右室与左室功能障碍、和呼吸衰竭的患者,根据这些表现选用pRVAD/pLVAD或VA-ECMO。最后,患者是否适合临时MCS,还应考虑到于他们不可改变的风险因素(如:年龄、合并症、脑损伤、器官衰竭)的总体影响,这些因素最终不仅决定了他们的预后,也决定了他们是否适合接受目标治疗。临时MCS只能在有明确撤出策略的情况下使用,作为短期内恢复、安装长期MCS装置或心脏移植的桥接过渡手段;对于经筛选确定的患者,可以考虑过渡到决策/候选策略。许多CS患者(特别是急性、慢性HF-CS)心功能已无法恢复,需要永久的MCS或心脏移植。应尽早评估患者是否适合安装永久MCS或接受心脏移植,目的是为可能有适应证接受这些治疗的患者进行终末器官功能保护。心脏不能恢复且不适合进行永久MCS或移植的CS患者预后不佳,早期姑息治疗可能是明智的。
以右室为主的CS
孤立性右心衰或以右心为主的心衰所引起的CS,治疗时必须考虑肺动脉高压及其病因,以及正压通气对右心的有害影响。改善使肺血管阻力升高的因素(如:缺氧、高碳酸血症、酸中毒、气道高压)是必要的,如果可能,应避免气管插管;高流量鼻导管给氧可提供氧合支持,且没有额外增加气道正压。右心前预负荷不足,会影响心脏每搏量,但右心室充注压升高(如:RAP > 15-20mm Hg)会使右心功能恶化,导致肾脏和肝脏功能障碍。维持平均动脉压高于平均肺动脉压是可取的,米力农或血管加压素可能比儿茶酚胺对右心后负荷具有更有利的作用。选择性肺血管扩张剂(吸入或全身)的使用,可根据右心衰的原因来选择,特别是在没有肺淤血或导致低氧的肺病存在时,因肺动脉高压所导致的右心衰。在没有严重肺动脉高压的情况下,pRVADs通常用于难治性右心衰为主的CS,而VA-ECMO更适合肺动脉高压或双心室CS。对于因右心梗死而发生CS的患者,液体负荷状态和多巴酚丁胺是有用的,吸入一氧化氮和pRVAD可用于难治性病例;完全性心脏传导阻滞导致的房室电同步性丧失可损害血流动力学,可通过安装房室序贯起搏(即:DDD起搏模式)加以改善。
未来的CS研究方向
目前,有许多针对CS患者的随机对照试验正在进行,并将扩大证据基础,包括一些旨在比较先进的临时MCS装置(例如,Impella和VA-ECMO)与最佳药物治疗的研究,其建议的样本量超过了使用这些装置的已发表的随机对照试验中入组的患者总数。整合休克的表型和休克的严重程度分类,对未来的研究至关重要,以降低CS群体的异质性,并深入了解其病理生理机制,从而在特定亚组中产生新的治疗策略。实施更加一致的治疗标准,包括多学科休克小组和基于证据的CS方案,有可能提高随机对照试验在临床实践中的普遍性,但需要额外的严格调查来确定每个建议要素的有效性和安全性。在设计随机对照试验时,鼓励政府和监管部门的参与,以及听取患者权益保护方的意见。由于初诊时疾病的严重程度不同,使得知情同意往往被延迟或推迟,因此,在确定患者纳入治疗组或对照组时,必须让患方参与并告知在必要时有可能会用到知情同意书中的应急手段,这很关键。适应性试验,兼顾到了患者的表现和临床演变的动态变化,可能对这一人群有用。除了生存率之外,鼓励纳入以患者为中心的重要预后指标,例如:无器官衰竭的存活天数等。
结论
尽管采用现代治疗,CS患者仍有很高的死亡率。无论选择何种血流动力学支持策略,为了避免进展为终末器官衰竭和难治性CS,必须尽可能迅速和完全地逆转低灌注状态。在CS人群中观察到的显著异质性,对CS患者治疗一刀切的方法是不可取的。休克严重程度分期、结合多学科团队策略可以实现个体化治疗。了解与特定CS表型相关的病理生理学和生物标志物模式的进展可以进一步促进个体化医疗。未来的研究不仅需要确定CS特定治疗的安全性和有效性,还需要确定哪些患者最有可能从某些治疗(如:临时性MCS)中受益。最后,CS研究应该在休克表型和严重程度以及研究结果方面进行协调,以实现通用性。
要点
问:心源性休克(CS)患者的最佳治疗方法是什么?
研究结果:很少有随机试验表明,CS患者,特别是那些没有急性心肌梗死(AMI)的,接受试验治疗后的生存率有明显改善。
意义:当前,CS的治疗需要由多学科团队指导下的个体化治疗,整合休克严重程度、表型和风险校正。逆转起始病因是至关重要的(特别是AMI患者的早期血运重建),根据患者的需要,结合血管活性药物和临时机械循环支持来恢复全身灌注,同时最大限度地减少可预防的并发症。
- 上一篇:腹腔镜手术缝合的19个常见问题解答!
- 下一篇:心源性休克分期
猜你喜欢
- Nat Cardiovasc Res 天津医科大学艾玎/韩姹教授团队揭示孕期营养过剩影响子代动脉粥样硬化的表观遗传机制
- 糖尿病遗传「重女轻男」?北大研究发现:妈妈有糖尿病,孩子患病风险高 2.55 倍!
- 反流性食管炎真的会自愈吗?
- 菜花烧香菇的做法-家常味烧菜谱
- CGP论著|超重/肥胖合并代谢异常的女性乳腺癌发病风险更高
- 省中医药局 省文化和旅游厅 省卫生健康委 省林业局关于贵州省中医药健康旅游示范区(基地、项目)(第一批) 评审结果的公示
- 吃个面的功夫,被邻桌医生看出来脑子里长肿瘤!
- 每次月经都会引发偏头痛为月经性偏头痛
- 【今日分享】从护理视角对《中国老年糖尿病诊疗指南(2024年版)》解读与思考
- 算我求你了!放过你的眼睛吧网瘾少年
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)