首页 > 医疗资讯/ 正文
丁型肝炎是由丁型肝炎病毒(HDV)与乙型肝炎病毒(HBV)合并感染(两种病毒同时感染人体)或者HDV感染已经携带HBV的患者引起的病毒性肝脏疾病。相对于HBV单独感染,HDV和HBV共同感染会显著加快疾病向肝硬化和肝癌等重症发展的进程,因此丁型肝炎被认为是最严重的病毒性肝炎[1]。尽管危害很大,但丁型肝炎的诊断相对于乙型肝炎而言进展非常缓慢。由于大量检测空白的存在和感染呈现显著的地域差异,关于HDV感染的总感染人数存在争议[2],部分Meta分析[3-5]估计全球有1 200万~7 200万HDV感染者。我国丁型肝炎诊断的数据也很少。
近年来,随着相关研究的进展包括药物研发的突破等,丁型肝炎的危害逐渐受到关注,为丁型肝炎的治愈带来了曙光[6]。亚太肝病学会[7]和欧洲肝病学会[8]均建议对所有HBsAg阳性的个体进行丁型肝炎检测,然而目前只有极少数人接受了相应的检测,诊断缺口巨大,问题亟待解决。丁型肝炎的筛查通常首先检测血清中的抗-HD抗体包括IgG和IgM,然后对阳性者再进行HDV RNA的验证。除了筛查之外,抗-HD抗体尤其是IgM也是丁型肝炎疾病状态的一项重要指标。因此有必要对抗-HD抗体检测的方法进行认真分析。
1、HDV抗原的特征和抗体的诊断意义
HDV的基因组为单链环形反义RNA,仅约1 680个核苷酸(图1)。HDV的基因组仅有一个开放阅读框编码195个氨基酸的丁型肝炎小抗原(S-HDAg)。在病毒复制过程中,部分病毒基因组的开放阅读框的终止密码子UAG可以被人体的RNA编辑酶ADAR1修饰变成色氨酸密码子UGG,进而导致表达的蛋白延长19个氨基酸,该蛋白被称为丁型肝炎大抗原(L-HDAg)。S-HDAg是病毒基因组复制所必需的,而L-HDAg通过与HBV的囊膜蛋白相互作用介导病毒粒子的组装和释放[9-10]。目前发现的HDV共分为8个基因型,其中Ⅰ型HDV(HDV1)为全球分布,其他基因型都呈现明显的地域分布,我国主要流行的基因型为HDV1[11-12]。
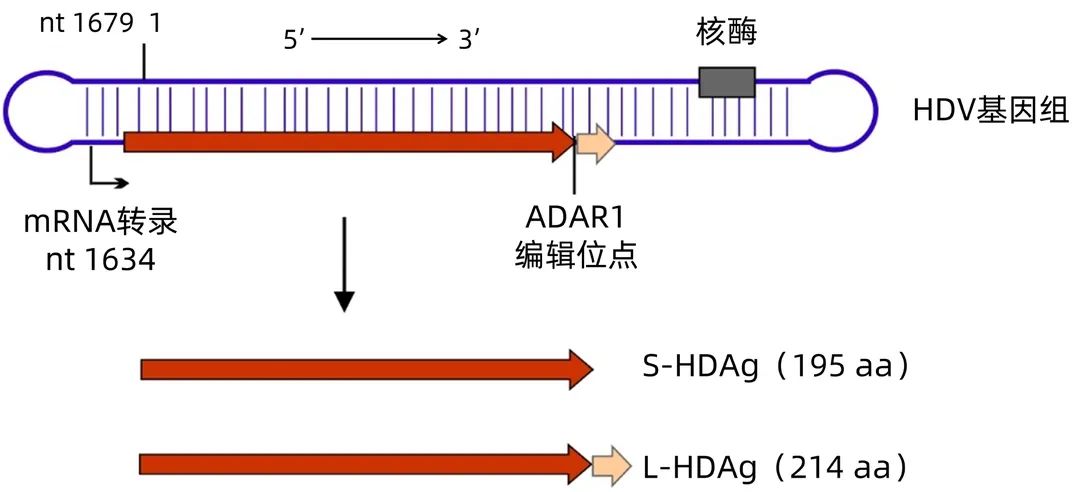
图1 HDV基因组与抗原
丁型肝炎可大致分为急性感染期和慢性感染期两个阶段。HDV和HBV合并感染情况下,两种病毒在急性感染之后通常均被清除,只有少数(<5%)会发展成为慢性感染。然而,HDV重叠感染HBV阳性患者发展成为慢性感染的概率很高(>90%)[13-14]。人体被HDV感染后主要产生抗-HD IgM和抗-HD IgG两类抗体。同时,由于HBV复制产生了表面抗原、核心抗原等HBV抗原,人体也可能相应地产生对应的各种HBV抗体。感染各个阶段人体血液中各种HDV和HBV抗体的状态汇总于表1。HDV进入人体后通常有数周甚至更长的潜伏期,然后开始大量复制。抗-HD IgM大约在HDV大量复制2周后出现并快速升高。
在急性感染期,患者血液中抗-HD IgM含量较高;急性感染后期,随着HDV被清除或转为慢性感染,抗-HD IgM水平通常会快速下降,因此抗-HD IgM常被作为急性感染的指标。尽管如此,抗-HD IgM在部分慢性感染者中也能检测到,通常与病毒活跃程度和肝损伤呈正相关[15-17]。
因此,判定HDV急性感染不能仅依赖于抗-HD IgM,还应该结合其他指标,如抗-HBc IgM、抗-HD IgG、肝损伤指标丙氨酸氨基转移酶等。抗-HD IgG出现晚于抗-HD IgM数周,在血液中的浓度可以达到很高水平,而且持续时间很长。因此,抗-HD IgG常被作为HDV感染已经度过急性期的指标。然而,抗-HD IgG在病毒被清除之后仍能维持很长时间,故仅抗-HD IgG阳性无法确定是现症感染还是既往感染已经清除病毒,需要利用HDV RNA以明确。丁型肝炎的初步筛查需要同时检测抗-HD IgM和抗-HD IgG,鉴于此,利用抗-HD总抗体最为合适。但在临床中也常分别检测抗-HD IgM和抗-HD IgG用于丁型肝炎的筛查。

2、HDV抗体检测的主要方法
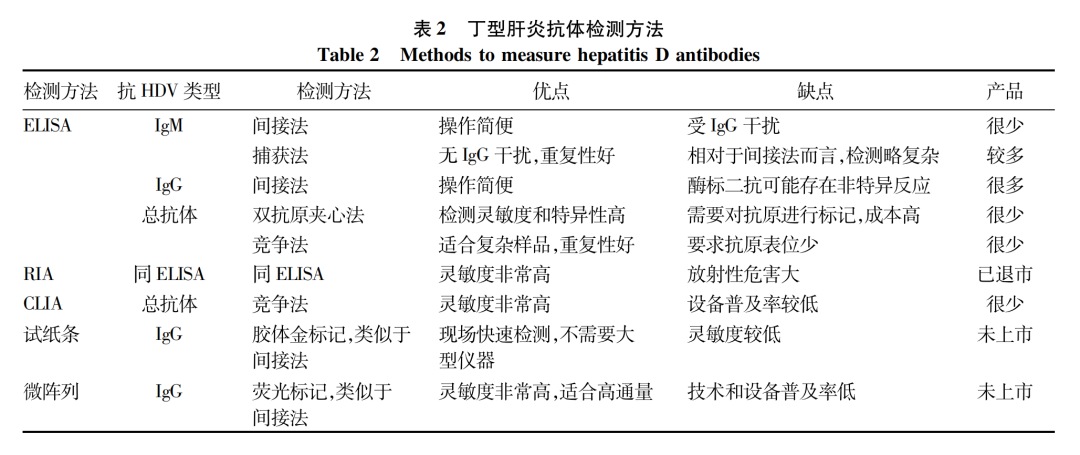
到目前为止,国内外已经有数家企业和研发机构开发出了HDV抗体检测产品,其中大部分为酶联免疫吸附分析(ELISA)试剂盒,此外还包括早期产品放射免疫分析(RIA)试剂、新一代产品化学发光免疫分析( CLIA)试剂盒,以及尚未上市的胶体金检测试纸条和免疫荧光微阵列等。HDV抗体检测的主要方法汇总于表2,具体如下。
2.1 ELISA检测法
ELISA包括免疫分析系统和信号检测系统。免疫分析系统是将酶(如辣根过氧化物酶)作为标志物,直接标记在抗原或抗体上,经过抗原与抗体反应形成抗原-抗体复合物;信号检测系统是在免疫反应结束后,加入底物(如3, 3′, 5, 5′-四甲基联苯胺)进行酶促反应产生可见的颜色变化。通过酶标仪测定样品与对照的颜色差异,并根据测定结果进行定性判断或结合标准品计算待检测物的浓度。ELISA是目前最常用的抗体检测方法。根据抗体类型和实验目的的不同,ELISA检测抗体的方法又被分为间接法、竞争法、捕获法等多种类型。在实验操作上主要包括酶标板包被、样品孵育、酶标记、加入底物显色以及信号检测等步骤。
2.1.1 抗-HD IgM ELISA检测
目前商品化检测抗-HD IgM的ELISA试剂盒主要采用间接法和捕获法两种。间接法ELISA采用HDV抗原包被酶标板,然后与样品孵育捕获抗-HD IgM,最后用酶偶联的抗人IgM抗体进行信号检测。但该方法的样品中可能含有大量的抗-HD IgG也能够与HDV抗原结合,此竞争性结合可能会导致抗-HD IgM的检测结果不准确。因此,采用间接法ELISA检测抗-HD IgM时通常需要对样本进行稀释或者采用吸附法预先去除IgG。与间接法ELISA不同,捕获法ELISA用抗人IgM μ链抗体包被酶标板,首先捕获血清中的所有IgM,然后再先后加入HDV抗原和酶偶联的抗HDV特异性抗体用于信号检测。捕获法ELISA排除了抗-HD IgG的干扰,结果更加可靠。因此,捕获法ELISA是目前检测抗-HD IgM最常用的方法。
2.1.2 抗-HD IgG检测
抗-HD IgG的ELISA检测试剂盒是目前市场上供应最多的丁型肝炎抗体检测产品。其检测方法基本上全部为间接法ELISA,主要包括:采用HDV抗原包被酶标板,然后与样品孵育捕获抗-HD IgG,最后用酶偶联的抗人IgG抗体进行信号检测。虽然该方法理论上也存在抗-HD IgM竞争性与HDV抗原结合的问题,但通常情况下抗-HD IgG阳性的血清中,该抗体的浓度远高于抗-HD IgM。因此抗-HD IgM的干扰造成的影响不大。
2.1.3 抗-HD总抗体检测
相对于抗-HD IgM和抗-HD IgG而言,抗-HD总抗体更加适合于丁型肝炎的初步筛查。尽管如此,目前市场上抗-HD总抗体检测试剂盒很少。抗-HD总抗体的ELISA检测方法主要分为竞争法和双抗原夹心法两种。竞争法ELISA的主要步骤包括:采用HDV抗原包被酶标板,然后与样品孵育捕获抗-HD IgM和抗-HD IgG,最后加入酶偶联的抗HDV多克隆抗体,结合尚未被样品中的抗体占据的HDV抗原并进行信号检测。双抗原夹心法ELISA也采用HDV抗原包被酶标板并与样品孵育捕获抗-HD总抗体,最后用酶偶联的HDV抗原进行标记和信号检测。相对于上述抗-HD IgM和抗-HD IgG的ELISA检测,抗-HD总抗体的两种检测方法均较为复杂,这可能是目前市场上抗-HD总抗体检测试剂盒较少的一个原因。
2.2 其他检测方法
2.2.1 RIA检测法
与ELISA类似,RIA也包括免疫分析系统和信号检测系统,两者的主要区别在于RIA是以放射性同位素为标志物,以同位素的放射性强度作为检测信号。RIA检测法建立于1960年,其检测灵敏度和准确性都很高。RIA曾是检测HDV抗体的主要方法,这些方法大多数建立于1980—1990年[18-19],例如Abbott公司的丁型肝炎抗体检测试剂盒[20]。但由于同位素对人体危害较大,检测过程复杂耗时,后来逐渐被ELISA替代[21-23]。基于笔者的检索,目前市场上已经没有商品化的HDV抗体RIA检测试剂盒供应。然而这不排除仍有少数检测机构和实验室在使用自制的RIA检测试剂进行HDV抗体检测。
2.2.2 CLIA检测法
CLIA同样也包括免疫分析和信号检测两个系统。其免疫分析系统与ELISA和RIA类似,但CLIA的信号检测系统中采用的是鲁米诺等发光底物。底物经氧化或酶促反应后会发射光子,发光强度利用发光信号测量仪器进行检测。根据化学发光标志物与发光强度的关系,进行定性或定量分析。由于CLIA的检测灵敏度远高于ELISA,很多ELISA产品正在被CLIA产品替代,在HDV抗体检测领域亦是如此。上述HDV抗体ELISA检测试剂盒理论上均可开发出对应的CLIA检测试剂盒。但是,由于化学发光诊断技术起步较晚,而且产品一般是试剂和仪器一体化的封闭系统,因此技术壁垒较高,产品的更新换代无法在短时间内实现。基于笔者所掌握的信息,目前市场上只有Diasorin和Dia.Pro Diagnostic Bioprobes Srl两家企业提供HDV抗体CLIA检测产品[24],而且均为基于竞争法的总抗体检测试剂盒。两家均为长期从事丁型肝炎检测试剂生产和研发的意大利企业。意大利在丁型肝炎诊断领域的领先发展可能与该国的HDV感染率较高(相对于其他欧洲发达国家)以及HDV的发现者意大利科学家Rizzetto博士的推动有关。Diasorin公司在推出抗-HD总抗体CLIA检测产品之后,已经停售相应的ELISA产品。而Dia.Pro Diagnostic Bioprobes Srl公司则目前还同时提供ELISA和CLIA产品。
2.2.3 胶体金试纸条
ELISA和CLIA利用酶标板等多孔板可以同时检测多个样本,但是这两种方法对检测设备有较高要求,需要在实验室中完成。试纸条检测则不需要大型仪器,并且检测时间短,非常适合在偏远和不发达的地区进行现场检测或者在样品数量比较少的情况下进行快速检测。德国海德堡大学Urban教授团队在2021年首次报道了HDV抗体检测试纸条[25]。该试纸条的设计采用的是经典的胶体金标记方法:首先将纯化的重组HDV抗原(检测条带)和抗-羊抗体(对照条带)分别喷涂固定在膜上,在膜的前方放置吸附有胶体金标记的羊抗人IgG的滤纸条。加入样本(稀释的血清)之后,样本通过胶体金滤纸与金标记抗体一起流向检测膜。如果样品中含有HDV特异性抗体,那么抗体与金标记二抗将在HDV抗原处富集形成可见的条带,多余的金标记二抗进一步流经抗-羊抗体时被捕获形成对照条带。以ELISA检测结果作为对照,该检测试纸条可以检测出94.6%阳性样本,具有相当高的阳性样本检出率。而且,试纸条未检测出的假阴性样本其ELISA检测信号也很弱,这些样本很可能来自已经清除HDV的患者。Urban教授团队与牛俊奇教授团队合作,利用该试纸条对我国和德国共5千多份样本进行了检测,发现丁型肝炎存在显著的热点分布[26]。目前该试纸条尚未上市。
2.2.4 微阵列定量检测
微阵列检测方法具有所需实验材料少、灵敏,以及易于实现高通量检测等优点。在HDV抗体检测方面,上海交通大学的陈晓华团队与美国斯坦福大学Glenn团队合作,在2017年报道了一种基于荧光的高通量定量微阵列抗体捕获(Q-MAC)技术[27]。其原理是将重组HDV抗原以圆点形式固定在金膜上制作成微阵列,加入样本之后HDV抗原捕获抗体,然后再加入IRDye800荧光标记驴抗人IgG二抗,最后利用Licor Odyssey扫描仪进行荧光信号检测。平行比较实验显示,该方法的检测灵敏度远高于ELISA和免疫印迹,而且可以实现抗体定量。虽然该方法仅检测了抗-HD IgG,但用同样的策略开发出抗-HD IgM和抗-HD总抗体应该也具有可行性。与上述抗-HD IgG检测试纸条一样,目前Q-MAC产品也尚未上市。
3、丁型肝炎抗体检测面临的几个重要问题
3.1 不同HDV基因型的序列差异对抗体检测的影响
如上所述,HDV共有8个基因型。由于HDV1为全球分布,影响最广,所以几乎所有的HDV抗体检测产品都利用HDV1的抗原来捕获抗体[18, 28](抗-HD IgG检测试纸条除外,见下文)。关于不同HDV基因型的抗原与抗体交叉反应能力的研究很少。从生物信息学方面而言,HDV不同基因型的基因组序列差异可以达到40%[11-12],然而HDV抗原的蛋白质序列水平差异要小很多。Wang等[29]利用针对HDV1型的患者血清和单克隆抗体能够检测所有HDV基因型的抗原,包括免疫荧光和免疫印迹试验,并且信号强度没有明显区别。这说明HDV不同基因型的抗原表位可能相当保守。尽管如此,该研究使用的抗体很可能是过量的,不排除当使用更低浓度的抗体时可以观察到因交叉反应能力差异造成的信号强度不同。上述胶体金试纸条检测方法使用了一种所谓的“保守”HDV抗原,即首先对8个基因型的HDV抗原序列进行比对,获得保守序列,然后通过人工合成的方式获得该“保守”抗原的编码DNA[25]。该试纸条可以成功检测到多种HDV基因型感染的患者血清中的抗体。但其主要是定性分析,准确测定该“保守”抗原与不同基因型HDV抗体的交叉反应能力则需要更多的平行比较试验。除了利用完整的HDV抗原之外,部分检测试剂利用含有HDV抗原表位的肽段来进行抗体检测[30]。这种检测方法可能对基因变异更加敏感,需要充分考虑抗原表位的保守性,并且通常需要同时采用多个表位的肽段来避免假阴性的出现。总之,不同HDV基因型的抗原与抗体之间具有较强的交叉反应能力,但是抗原的序列差异对不同HDV基因型的抗体检测,尤其定量检测的确切影响还有待更深入的研究。
3.2 HDV抗体的定量检测
以上提到的HDV抗体检测产品,除了基于荧光的微阵列检测外,几乎全部只能用于定性检测。这可能是由于目前丁型肝炎抗体检测的主要目的是筛查,而定性检测试剂已经能够满足筛查的需求。尽管如此,抗体定量检测的重要性仍不容忽视。如前所述,除了急性感染期外,抗-HD IgM在部分慢性丁型肝炎患者血清中也能检测到,而且抗体浓度与疾病的严重程度相关。因此,抗-HD IgM的定量检测具有重要意义。另一方面,随着丁型肝炎治疗的展开,抗体的定量检测对监控病情和药物治疗效果很可能也是非常必要的。研究者们或许能够从乙型肝炎抗体检测的发展历程中学习到经验,例如“乙肝五项”中的抗体检测经历了从定性到定量检测的过程。HDV抗体检测可能也会经历类似的过程。
3.3 标准品与检测试剂的评估
由于目前HDV抗体检测产品主要用于定性检测,所以仅包含阴性对照和阳性对照,不包含标准品。已有多项研究[20-24, 31]对不同的丁型肝炎抗体检测试剂进了平行比较,结果发现这些试剂盒在检测灵敏度等方面存在很大的差异。缺乏统一的标准品导致不同检测产品和方法之间的比较和评价存在很大困难。HDV现症感染时,HDV抗体的水平通常比较高,抗体定性检测结果的一致性很高[17-18]。但是无法排除某些感染者体内抗体水平较低,或者药物治疗导致抗体水平降低等情况。在这些情况下,检测产品的灵敏度和特异度对结果的判断可能会有很大的影响。另一方面,随着HDV抗体定量检测需求的增加,标准品和评价指标的重要性会越来越大。世界卫生组织在2013年建立了第一份HDV基因组RNA的标准品[32],该标准品取自HDV1型患者血清,HDV的效价制订为575 000 IU/mL。该标准品为HDV基因组RNA的定量提供了统一的参考。然而目前尚没有一套完整的丁型肝炎抗体标准品。建立一套完整统一的丁型肝炎抗体标准品,将有利于抗体定量检测产品的开发和评估,而且有利于对不同研究所获得的数据进行横向比较,因此具有重要意义。
4、展望
HDV抗体检测对丁型肝炎的诊断至关重要。抗-HD总抗体、抗-HD IgG、抗-HD IgM分别具有不同的临床诊断意义,均应该受到重视。虽然目前相关的检测手段都有了一定的发展,而且市场上有应用的产品供应,但是仍存在很多重要的不足之处,包括:缺乏对不同HDV基因型的抗体检测能力的测定;总抗体检测产品较少,难以满足大规模筛选的需求;定量检测产品缺乏;基于CLIA等高灵敏度检测方法的产品有待开发;缺乏统一的标准品、操作指南和评价指标等。此外,作为丁型肝炎的另一项关键指标,HDV RNA的检测也存在很多问题[32-33]。
近年来随着对丁型肝炎认识的深入,科研和医疗产业机构都在不断推动丁型肝炎检测试剂的开发和应用。新型冠状病毒肺炎暴发以来,病毒诊断行业在技术和产业规模方面取得了重大的发展。这些发展必然会对丁型肝炎诊断产品的开发和升级起到巨大的推动作用。丁型肝炎领域的相关专家和从业人员应加大教育宣传,达成共识,针对以上亟待解决的问题,推动丁型肝炎检测的产品开发、升级和应用,并最终为丁型肝炎的防治提供支持。
全文下载:
张振锋. 丁型肝炎抗体检测方法比较分析[J]. 临床肝胆病杂志, 2023, 39(4): 751-757.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)