首页 > 医疗资讯/ 正文

一年一度的全球肿瘤学盛会——第59届2023年美国临床肿瘤学会(ASCO 2023)年会定于美国芝加哥当地时间2023年6月2日~6日正式拉开帷幕,包括 200 个口头报告研究(Oral abstract)、2000 +壁报展示(Poster session)、46 场临床科学研讨会(Clinical Science Symposium)等!
结直肠癌领域也将迎来多项重磅研究进展。梅斯医学将于会议前后持续更新相关内容,一起来看吧!
摘要号:3501
讲者:Kanwal Pratap Singh Raghav
T-DXd用于HER2过表达/扩增(HER2+)转移性结直肠癌(mCRC)患者的治疗:一项多中心、随机、Ⅱ期DESTINY-CRC02研究
研究背景
在DESTINY-CRC01试验中,T-DXd (6.4 mg/kg,Q3W)在HER2+ mCRC患者中显示出抗肿瘤活性(Siena et al Lancet Oncol. 2021)。本研究我们将报告DESTINY-CRC02 (NCT04744831)的初步结果,该研究进一步评估了T-DXd(5.4和6.4 mg/ kg)在HER2+ mCRC患者的疗效和安全性。临床试验信息:NCT04744831。
研究方法
本研究一项多中心二期研究,研究对象均为同机构确认的HER2+(免疫组织化学[IHC] 3+或IHC 2+/原位杂交[ISH]+) mCRC患者。纳入标准:具有RAS野生型(wt)或突变型(m) mCRC的患者;既往接受过标准治疗的患者;既往接受抗her2治疗的患者。
第一阶段,将80名患者按1:1随机分配到5.4 (n = 40)或6.4 (n = 40) mg/kg T-DXd Q3W;
第二阶段,另外42名患者接受5.4 mg/kg的T-DXd;
主要终点:通过BICR确定客观缓解率(cORR);
次要终点:包括反应持续时间(DoR)、无进展生存期(PFS)、总生存期(OS)和安全性。
研究结果
该数据截止日期(2022年11月1日)。
5.4和6.4 mg/kg T-DXd组绝大多数患者HER2 IHC 3+(78.0%和85.0%),RAS wt患者(82.9%和85.0%),治疗中位数分别为3和4个治疗线;
5.4 mg/kg组的cORR为37.8% (95% CI, 27.3-49.2%), 6.4 mg/kg组的cORR为27.5% (95% CI, 14.6-43.9%)(两组均部分缓解);
关键疗效数据见下表:
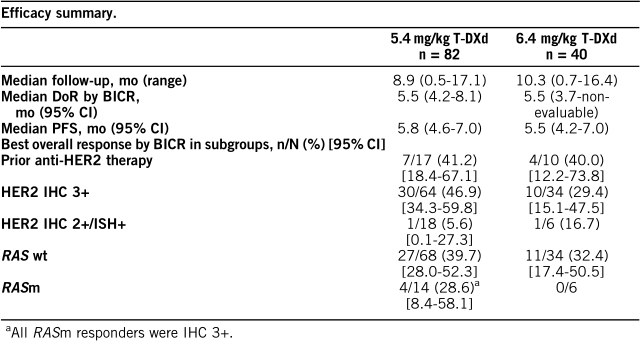
在5.4和6.4 mg/kg T-DXd组中,分别有41/83名患者(49.4%)和23/39名患者(59.0%)观察到3级治疗不良事件(ae);分别有20/83(24.1%)和12/39(30.8%)患者出现严重不良反应;分别有7/83(8.4%)和5/39患者(12.8%)发生相关间质性肺病;大多数不良事件均为1/2级(6.4 mg/kg组1例5级)。
结论
T-DXd在5.4和6.4 mg/kg剂量的HER2+ mCRC患者中显示出抗肿瘤活性。
在5.4 mg/kg T-DXd和既往接受过抗her2治疗的患者中,无论RAS突变状态如何,均观察到抗肿瘤疗效。
总的来说,安全性与已知的T-DXd的安全性一致,并倾向于5.4 mg/kg的剂量。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)