首页 > 医疗资讯/ 正文
自组装分子药物结合了小分子化疗的简单制备和药物-纳米颗粒偶联物的肿瘤靶向特性。然而,它们需要一种超分子相互作用,才能在生物的复杂环境中生存下来。
2023年5月11日,大连理工大学孙文和莱顿大学Sylvestre Bonnet共同通讯在Nature Chemistry在线发表了题为“In vivo metallophilic self-assembly of a light-activated anticancer drug”的研究论文,该研究报告了环金属化钯配合物依靠之间的亲金属相互作用在活小鼠中产生超分子纳米结构,在皮肤黑色素瘤肿瘤模型中具有较长的循环时间(超过12小时)和有效的肿瘤积累率(高达每克注射剂量的10.2%)。
由于自组装钯络合物产生的I型光动力学效应,绿光激活导致有效的肿瘤破坏,正如在体外被照射后高达96倍的细胞毒性增加所证明的那样。该项工作表明,亲金属相互作用非常适合在体内产生稳定的超分子纳米治疗药物,具有特殊的肿瘤靶向特性。

治疗癌症是现代医学最艰巨的挑战之一,而化疗占据了癌症治疗的第一线。许多化疗药物都是定义明确的小分子,通常会导致非特异性递送、快速血液清除和在肿瘤中的低积聚,从而对癌症患者产生严重的副作用。为了克服这些限制,它们被结合到肿瘤靶向纳米载体上,无论是共价的还是超分子的,这原则上增强了药物对肿瘤的递送。然而,许多纳米载体表现出相对较低的载药能力(通常为20%),而由此产生的肿瘤积聚仍然低得令人失望:最近的研究表明,最终进入实体肿瘤的纳米制剂药物剂量的中位数为0.7%。此外,实现药物-纳米颗粒偶联物的可重复性制备往往具有挑战性,这限制了纳米药物的临床应用。
药物自给药系统(DSDSs)可以解决这一问题。它们由小分子药物组成,无需专用纳米载体的帮助即可自组装成纳米结构。这些系统结合了易于制备的小分子和纳米偶联物的肿瘤靶向特性,实现了高载药效率。它们还需要在复杂的生物环境中维持的超分子力量。迄今为止提出的DSDSs依赖于疏水力、氢键和/或金属配位的组合。所谓亲金属相互作用是另一种发生在d8或d10金属中心之间的超分子相互作用。它在光电子学和材料科学中因其改变金属化合物的光物理和光化学性质的能力而闻名。它也被提议用于生物应用,但仅在体外进行了演示。
DSDSs的一个主要优点是其高载药能力,因为纳米颗粒主要由药物分子组成。然而,对于传统的DSDSs,如此高的载药能力可能会对肝脏或肾脏等血液过滤器官产生高毒性,因为每个纳米颗粒会将许多有毒分子带入细胞。光激活的DSDSs解决了这一问题,因为自组装药物只有在光照射后才会产生毒性。由于肝脏处于黑暗中,肝脏对DSDSs的高摄取不是问题,只要肝脏清除发生。因此,与传统的DSDSs相比,光激活具有显着的优势。
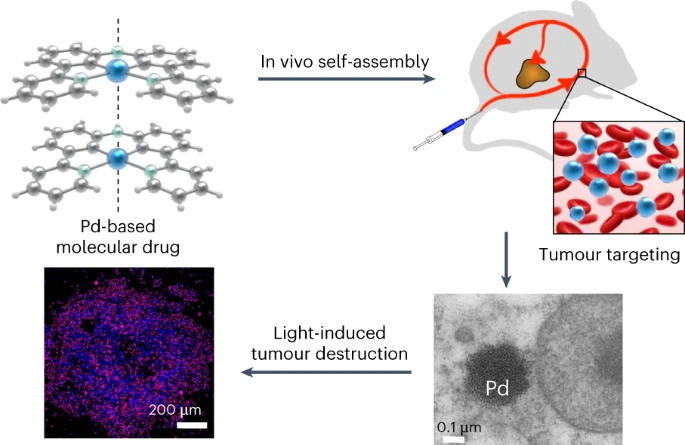
PdL在体内自组装成纳米颗粒,实现在肿瘤部位的富集(图源自Nature Chemistry )
光激活的DSDSs也可以从PDT的角度进行分析。当然,PDT治疗提供了一种对患者友好的化疗替代方案,具有抑制肿瘤增殖的潜力,同时通过选择性光照射肿瘤组织将副作用降到最低。然而,健康组织中吸收的光敏剂分子也会导致患者不希望的光敏性(例如,皮肤)——这是Photofrin PDT的典型副作用。因此,必须将光敏剂高效地递送到肿瘤组织中。许多报告表明,纳米颗粒能够增加分子药物的肿瘤积累,包括PDT光敏剂。然而,经典药物递送纳米系统的平均载药量低(通常为20% wt%)和肿瘤积累效率低(中位数为0.7% ID),表明在PDT的背景下,迫切需要开发新的药物递送纳米偶联物。
该研究设计的PdL的药物具有很好传递特性,包括长循环时间(12小时)和在肿瘤组织中良好的积累水平(高达10.2% ID/g)。从光化学角度讲,与卟啉不同,PdL复合物在聚集状态下保持良好的光动力学性质,即使在缺氧的肿瘤微环境中也是如此。有了这些结果,该研究得出结论,亲金属相互作用可以潜在地用于构建具有改善肿瘤积聚的高性能超分子纳米载体,并且与PdL等复合物观察到的Pd⋯Pd相互作用可以产生光动力系统,在缺氧下保持其光毒性。该研究用光激活的DSDS证明了亲金属相互作用在活小鼠的血液循环中存活,自组装纳米颗粒在人类皮肤黑色素瘤异种移植中显示出出色的肿瘤靶向和光治疗特性。
原文链接:
https://www.nature.com/articles/s41557-023-01199-w
猜你喜欢
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)