首页 > 医疗资讯/ 正文
帕金森病(PD),作为全球第二大神经退行性疾病,正随着人口老龄化成为严峻的公共卫生挑战。其发病机制极为复杂,而其中,由小胶质细胞激活引发的慢性神经炎症,被公认是导致大脑黑质区多巴胺能神经元死亡的关键推手。然而,治疗帕金森病面临着一个巨大的障碍——血脑屏障。这道“铜墙铁壁”在保护大脑的同时,也阻止了大多数抗炎药物进入病灶,使得许多在体外有效的疗法在体内效果大打折扣。

面对这一困境,纳米技术带来了新的曙光。近期,一项发表于Chinese Medicine的研究,成功开发出一种名为 DCM@Nar-NCs 的仿生纳米递送系统,它如同一枚“生物导弹”,不仅能精准穿越血脑屏障,还能直击神经炎症核心,在帕金森病模型中展现出卓越的治疗潜力。
精巧设计:打造穿越屏障的“特洛伊木马”
研究团队的策略堪称精妙。他们首先将天然抗炎化合物柚皮素 制成尺寸均一(小于50纳米)的纳米晶体,这极大地提高了药物的溶解性。随后,他们从分化后的HL-60细胞(一种可模仿中性粒细胞的模型)中提取细胞膜,并将其包裹在柚皮素纳米晶体外层,最终形成了具有核壳结构的DCM@Nar-NCs。
这套“仿生外衣”是其成功的关键。中性粒细胞的细胞膜上天然表达着LFA-1蛋白,它能与脑血管内皮细胞表面高表达的ICAM-1蛋白 特异性结合。借助这重“身份认证”,DCM@Nar-NCs得以通过受体介导的转运机制,光明正大地穿越血脑屏障,并凭借其炎症趋化特性,精准富集在大脑的神经炎症部位。
高效递送:从体外验证到活体成像的铁证
为了验证其穿越屏障的能力,研究人员构建了体外血脑屏障模型。结果令人振奋:DCM@Nar-NCs的穿透效率是游离药物的近7倍,并且在整个过程中没有破坏屏障的完整性。在活体小鼠实验中,静脉注射后6小时,其在大脑中的荧光信号强度达到峰值,是游离对照组的4倍以上,并且在24小时后仍能检测到强烈信号,证明了其卓越的脑靶向性和滞留能力。
药代动力学数据进一步证实了其优势:与游离柚皮素相比,DCM@Nar-NCs将药物在血浆和大脑中的半衰期、峰值浓度和药物暴露量 提升了数倍至数十倍,真正实现了高效、持久的脑内药物递送。
双重机制:神经保护与抗炎协同发力
抵达战场后,DCM@Nar-NCs展现出“双管齐下”的治疗效果。一方面,它在帕金森病细胞模型中,显著逆转了线粒体功能障碍,恢复了能量代谢,减少了活性氧的堆积,从而有效防止了多巴胺能神经元的凋亡。另一方面,它在小胶质细胞中,成功地将促炎的M1表型“再教育”为抗炎的M2表型——显著降低了IL-1β、IL-6、TNF-α等炎症因子的释放,同时提升了IL-4、IL-10、CD206等修复性因子的表达,从根源上遏制了神经炎症的恶性循环。
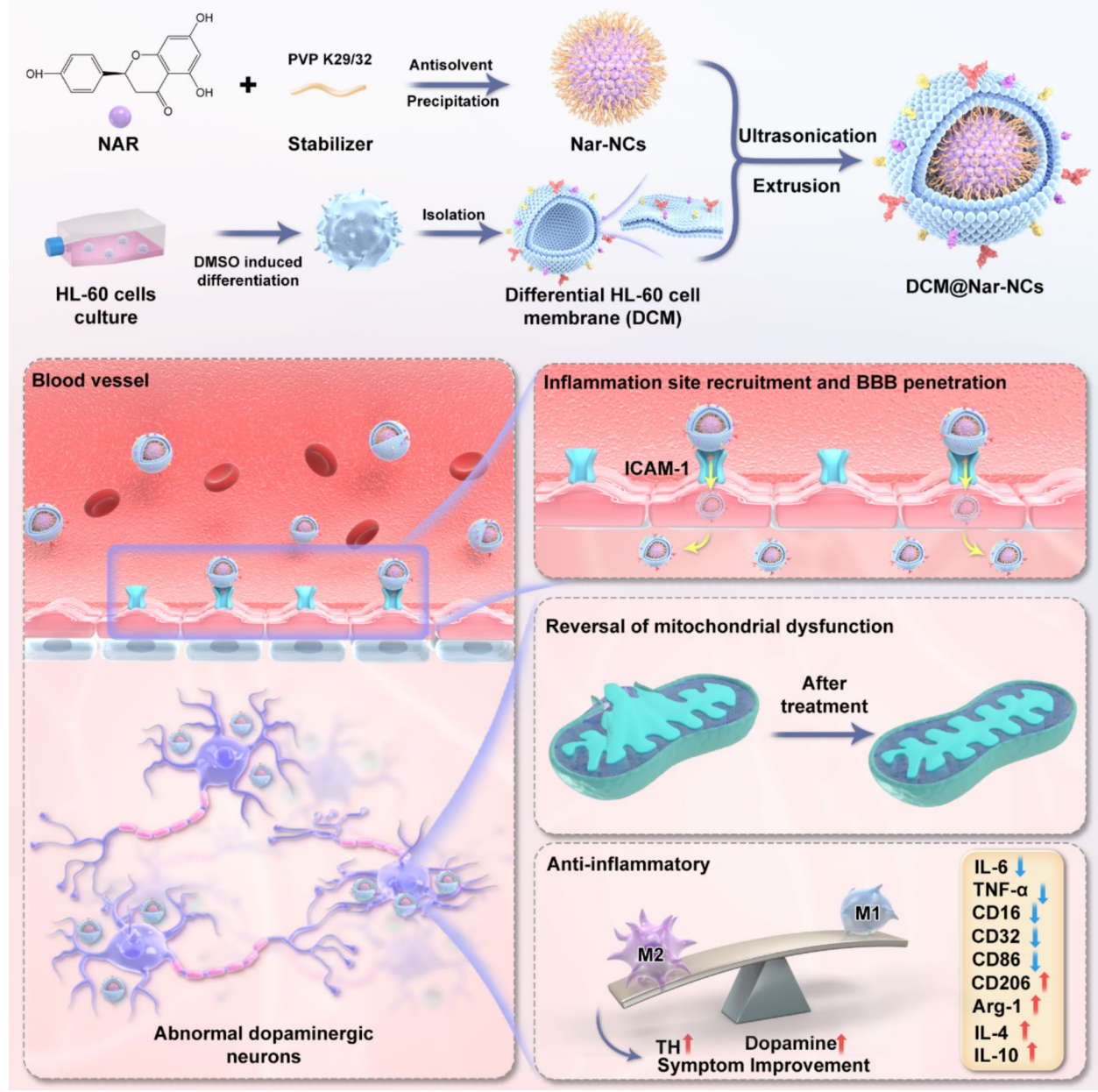
图:DCM@Nar-NCs 的合成及其在PD治疗中的应用
行为逆转:运动与认知功能的全面改善
理论的成效最终需要在活体行为上得到验证。在MPTP诱导的帕金森病小鼠模型中,接受DCM@Nar-NCs治疗的小鼠展现出了近乎全面的功能恢复。
运动功能:在转杆测试中,它们跌落次数减少,在杆上停留时间延长;在杆测试中,转身和下杆时间显著缩短;步态分析显示其步长和协调性恢复正常。
认知与情绪:在莫里斯水迷宫中,它们更快地找到隐藏平台,空间学习记忆能力增强;在新物体识别测试中,表现出更强的探索新奇事物的兴趣;在悬尾实验中,挣扎时间延长,抑郁样行为得到缓解。
这些行为的改善,其背后是坚实的病理学基础:小鼠大脑黑质区多巴胺能神经元数量显著回升,纹状体中多巴胺及其代谢物水平恢复常态,脑组织中的氧化应激水平大幅下降,线粒体结构和髓鞘也得到了有效保护。
安全可靠:临床转化的坚实基石
对于任何新型疗法,安全性都是重中之重。研究对经DCM@Nar-NCs治疗的小鼠进行了全面的生物相容性评估。血液生化、血常规以及主要器官的组织病理学分析结果均显示,该纳米系统未对肝、肾、心、肺等造成可观察到的毒性损伤,展现了其良好的安全性和临床转化潜力。
综上,这项研究不仅成功构建了一个高效、安全的脑靶向纳米递送平台,更在帕金森病的治疗理念上实现了整合——将跨越血脑屏障、调控神经炎症、保护神经元三大功能融为一体。DCM@Nar-NCs代表了一种极具前景的帕金森病治疗新策略,它超越了对症治疗,直指疾病进展的核心环节。
当然,研究者也指出,未来仍需在更多帕金森病模型(如α-突触核蛋白转基因模型)中验证其普适性,并进一步阐明其详细的细胞内吞机制。但毫无疑问,这项工作是纳米医学对抗神经退行性疾病的一次漂亮出击,为数百万帕金森病患者带来了新的希望。未来,我们期待这一创新技术能够稳步走向临床,真正造福人类健康。
原始出处
Yin, X., Qiu, J., Cheng, G. et al. Biomimetic nanodelivery system with simultaneous blood–brain barrier-crossing and neuroprotective abilities for anti-parkinsonian therapy. Chin Med 20, 185 (2025). https://doi.org/10.1186/s13020-025-01239-2
本文相关学术信息由梅斯医学提供,基于自主研发的人工智能学术机器人完成翻译后邀请临床医师进行再次校对。如有内容上的不准确请留言给我们。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)