首页 > 医疗资讯/ 正文
肝细胞癌的局部消融治疗因其微创特性在临床应用中日益受到重视。高剂量率近距离放射治疗作为代表性技术,通过影像引导将放射源直接置入肿瘤区域,实现精准剂量投放的同时最大限度保护周边正常组织。与传统热消融技术相比,该方法能有效规避血管邻近区域的热沉降效应限制,对较大体积肿瘤也具有良好控制效果。然而临床观察发现,即使用这种精确治疗手段,肿瘤局部复发仍是影响远期疗效的主要制约因素。
近年来,研究表明细胞衰老现象可能在治疗抵抗机制中扮演关键角色——当细胞在辐射等因素作用下进入衰老状态时,虽然丧失增殖能力但仍保持代谢活性,并通过分泌多种生物活性物质形成衰老相关分泌表型。这种特殊的细胞状态不仅可通过自分泌作用维持自身衰老特性,还能通过旁分泌途径影响周围未受照射细胞,形成辐射诱导的旁观者效应,最终可能导致肿瘤再生和疾病进展。

为深入探究这一机制,研究团队构建了模拟临床条件的体外实验系统。他们选取三种具有不同p53基因状态的肝细胞癌细胞系:保持p53野生型的HepG2、携带Y220C位点突变的Huh7以及完全缺失p53的Hep3B细胞。通过短串联重复序列分析确保细胞株遗传背景的可靠性后,研究人员采用铱-192放射源对细胞进行单次7.5 Gy剂量照射,该参数设置参考了临床实践中肿瘤边缘区域常处于亚致死辐射水平的实际情况。照射过程在专门设计的培养器皿中进行,根据放射源强度调节照射时间至15-30分钟范围。在照射后不同时间节点(包括30分钟、90分钟、24小时、48小时、72小时和7天)收集细胞上清液制备条件培养基,同时设立未照射细胞的培养基作为对照。这些培养基被用于处理新培养的未受照射细胞,以观察辐射产生的间接效应。
在检测方法上,研究采用多维度实验方案全面评估细胞反应。通过BrdU掺入实验动态监测DNA合成状况,将细胞暴露于条件培养基24-72小时后定量分析核苷类似物掺入水平。采用人工计数方法在血球计数板上统计细胞数量变化,评估群体生长动态。为考察长期增殖潜能,研究人员进行克隆形成实验,将细胞低密度接种后在条件培养基中持续培养14天,期间第7天更换新鲜培养基确保营养供给,最终通过结晶紫染色计数超过50个细胞的集落数量。在分子表征层面,利用免疫组化技术定量分析细胞增殖标志物Ki-67的表达变化,在48小时至7天的时间范围内系统观察其动态演变。同时应用β-半乳糖苷酶染色试剂盒进行衰老特异性染色,显微镜下统计阳性细胞比例。在机制探索方面,采用基于邻近延伸分析技术的高通量蛋白质组学平台,对条件培养基中192种蛋白质进行系统筛查,重点解析衰老相关分泌表型组分的变化规律,并借助STRING数据库构建蛋白质相互作用网络。所有数据均采用Mann-Whitney非参数检验进行统计学分析。
实验结果揭示了一系列重要现象。当将照射后不同时间点收集的条件培养基作用于未受照射的HepG2细胞时,DNA合成呈现出先增强后抑制的动态变化。特别是在照射后90分钟收集的条件培养基诱导了最显著的BrdU掺入增加,在24小时和48小时分别达到0.264和0.246的峰值水平。然而这种早期DNA合成激活并未转化为实质性的细胞增殖,因为在72小时时BrdU阳性细胞比例明显回落。细胞计数结果与此吻合:HepG2细胞在条件培养基中培养48小时内数量保持稳定,但至72小时时下降约20%。值得注意的是,不同细胞系对条件培养基的反应存在显著差异:Huh7细胞表现出与HepG2相似的变化趋势,而Hep3B细胞反而呈现数量增长。这一现象提示p53状态可能在介导细胞反应中起决定性作用。
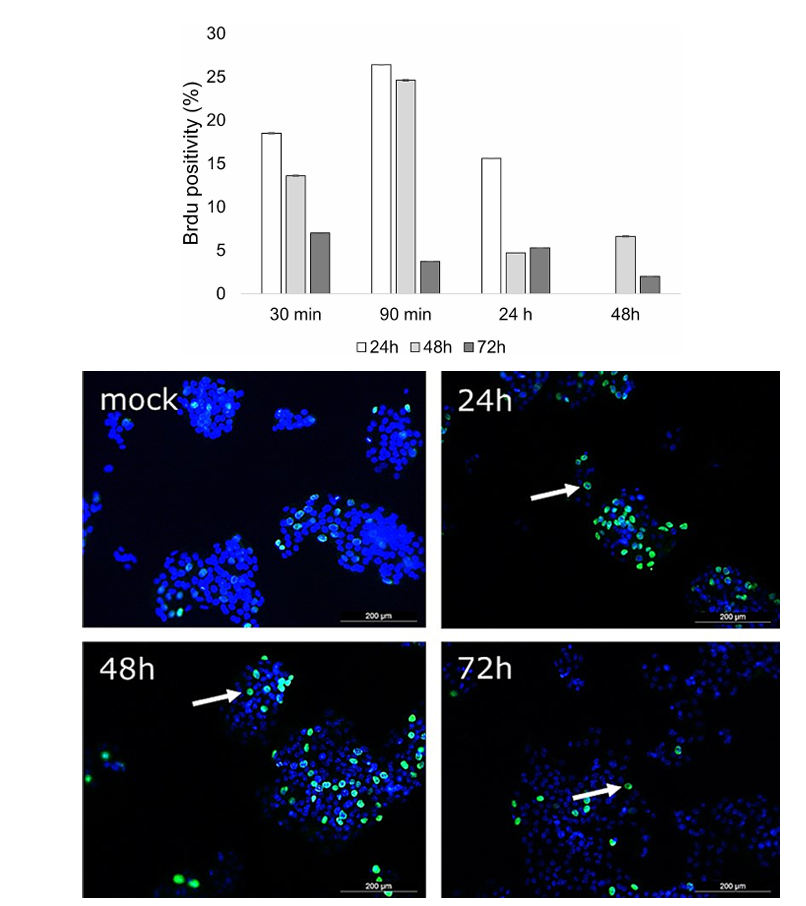
图1 肝癌细胞系中的BrdU掺入情况
为进一步验证该假设,研究人员设计了交叉实验。将HepG2来源的条件培养基作用于Hep3B细胞时,未观察到明显的反应变化;反之,Hep3B条件培养基也未能引发HepG2细胞的显著响应。这种细胞特异性反应模式表明条件培养基的作用机制可能与自分泌信号通路密切相关。Ki-67表达分析提供了更深入的证据:在条件培养基处理下,HepG2细胞的Ki-67阳性率从80%急剧下降至20%,而Hep3B细胞却显示出相反的上升趋势,在96小时时阳性率超过90%。克隆形成实验结果与此高度一致:HepG2细胞在条件培养基中的集落数量从对照组的1707个显著减少至631个,降幅达63%;而Hep3B细胞则从260个增加至436个,增幅为67%。这些数据共同证实条件培养基对细胞增殖的抑制作用严格依赖于p53信号通路的功能完整性。
蛋白质组学分析显示,照射后90分钟收集的条件培养基中29种蛋白质表达显著上调,其中15种被明确鉴定为衰老相关分泌表型核心组分,包括CCL4、MCP3、IL-8等关键调控因子。在衰老表征方面,β-半乳糖苷酶染色结果显示HepG2细胞在条件培养基中培养72小时后阳性率显著上升,而对照组细胞仅在7天后才出现轻微染色。与此形成鲜明对比的是,Hep3B细胞在两种培养基条件下均未表现出明显的衰老特征差异。特别值得注意的是,虽然条件培养基在照射后极早期即含有高水平的衰老相关分泌表型蛋白,但供体细胞自身直到48小时后才开始显现衰老迹象,这表明辐射可能直接触发分泌表型因子的释放,而不完全依赖于细胞衰老进程的启动。
当分析经条件培养基处理的幼稚细胞自身分泌组时,研究人员发现在48小时、72小时和96小时时间点分别检测到18、34和19种蛋白质表达上调。在72小时时间点,有9种蛋白质与原始条件培养基中的衰老相关分泌表型组分重叠。蛋白质相互作用网络分析表明,这些共同表达的蛋白质中六种与IL-1α存在强关联,而IL-1α已被确认为衰老相关分泌表型激活的关键调节因子。尤为重要的是,在照射后仅30分钟收集的培养基中就已检测到IL-1α表达水平的显著升高,这进一步证实辐射可在极早期阶段启动衰老相关分泌表型相关因子的分泌程序。
本研究通过建立体外实验模型,证实高剂量率近距离放射治疗不仅能对直接照射细胞产生作用,还可通过释放可溶性介质引发辐射诱导旁观者效应。这种效应表现为早期DNA合成的短暂激活,随后转为持续的细胞周期停滞和衰老状态。蛋白质组学数据明确显示条件培养基中富含衰老相关分泌表型蛋白,且这些因子能够诱导幼稚细胞产生自身的衰老相关分泌表型,形成可能维持衰老状态的自分泌循环。特别值得注意的是,这一过程显示出对p53通路的严格依赖性——p53功能正常的HepG2细胞表现出明显的增殖抑制和衰老诱导,而p53缺失的Hep3B细胞不仅无此反应,反而出现增殖增强现象。
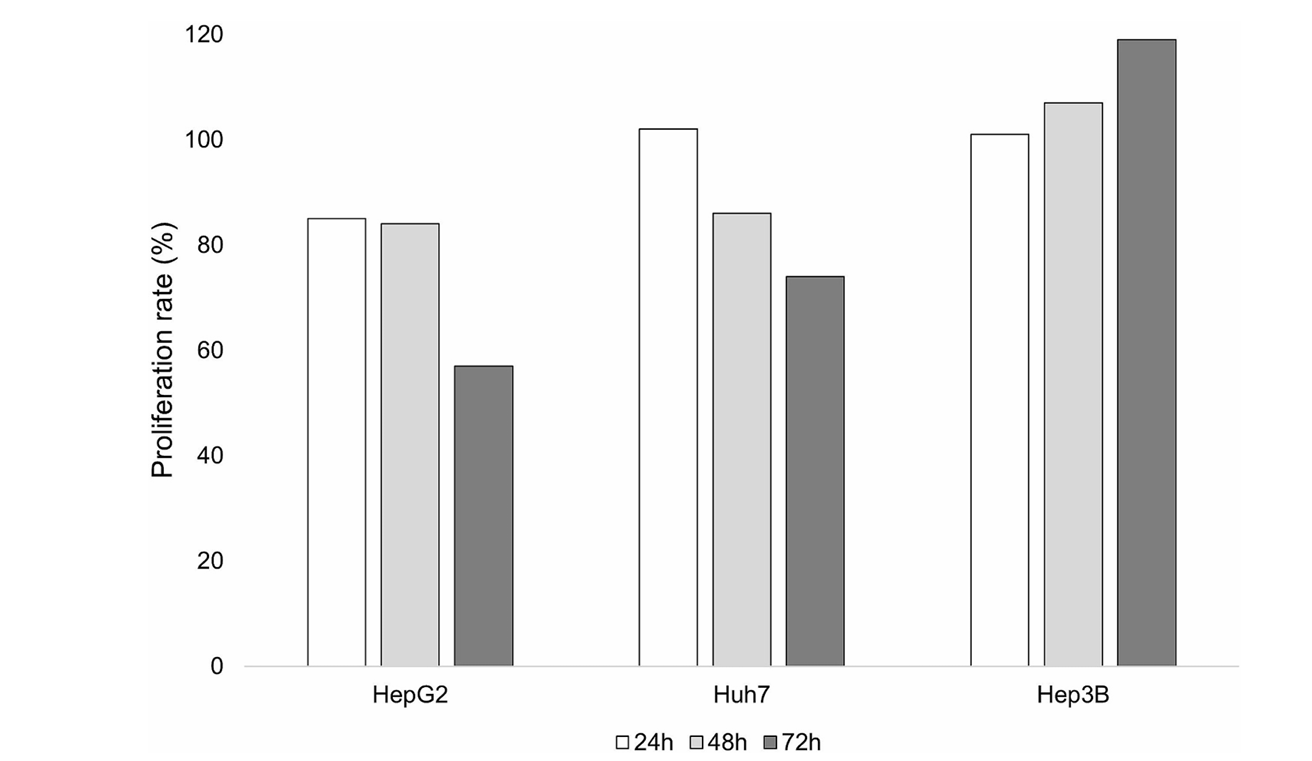
图2 暴露于条件培养基后肝癌细胞系的细胞数量测定
综上,这些发现对临床实践具有重要启示。虽然放射治疗能有效抑制肿瘤生长,但残留的衰老细胞及其分泌表型可能通过创造促炎微环境而促进肿瘤复发。因此,将靶向清除衰老细胞的senolytic疗法或抑制衰老相关分泌表型的senomorphic策略纳入现有治疗方案,可能成为提高肝细胞癌治疗效果的新途径。然而本研究仍存在一定局限性,如仅使用单一辐射剂量、局限于二维细胞培养模型以及肝细胞癌细胞系种类有限等。未来研究需要在更接近生理条件的三维培养和动物模型中验证这些发现,并探索不同辐射剂量和更多细胞类型的影响,以全面了解辐射诱导旁观者效应在肿瘤微环境中的复杂作用机制。
原始出处:
Naruhn J, Gröper MN, Öcal E, Salvermoser L, Hirner-Eppeneder H, Schäfer JN, Kazmierczak PM, Corradini S, Well J-C, Ricke J, Goldberg SN, Stechele M, Alunni-Fabbroni M. Conditioned medium from brachytherapy-irradiated hepatocellular carcinoma cells drives SASP-mediated senescence in naïve cellular counterparts. Radiotherapy and Oncology. 2025;211:111068.
本文相关学术信息由梅斯医学提供,基于自主研发的人工智能学术机器人完成翻译后邀请临床医师进行再次校对。如有内容上的不准确请留言给我们。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)