首页 > 医疗资讯/ 正文
虽然放疗联合免疫检查点阻断在非小细胞肺癌、黑色素瘤和结直肠癌等多种恶性肿瘤中取得了令人鼓舞的结果,但该联合疗法在脑胶质瘤治疗中的临床疗效仍不令人满意。其根本原因在于脑胶质瘤作为一种原发性脑部恶性肿瘤,复杂的血脑屏障阻碍了单抗的递送,尤其是向放疗靶区递送。
为此,西安交通大学吴昊研究员/李帅军助理研究员联合郑州大学食管癌国家重点实验室、生命科学学院院长于政权教授团队,合作开发了一种精准逐级递送纳米平台。该平台可借助P-选择素受放疗调控的时空表达特异性而高效跨过血脑屏障,并在肿瘤微酸环境中精准释放并靶向肿瘤,最终实现PD-L1单抗的层级递送。相关研究内容以“Hierarchical Precision Nanoplatform for Synergistic Radio-Immunotherapy in Glioblastoma via Controllable P-Selectin Targeting”为题,发表在《Advanced Functional Materials》。郑州大学青年教师孟彩婷为论文的第一作者,西安交通大学第二附属医院乔晨阳、郝谦等多位老师共同参与了研究工作,西安交通大学吴昊研究员、李帅军和郑州大学于政权教授为共同通讯作者。

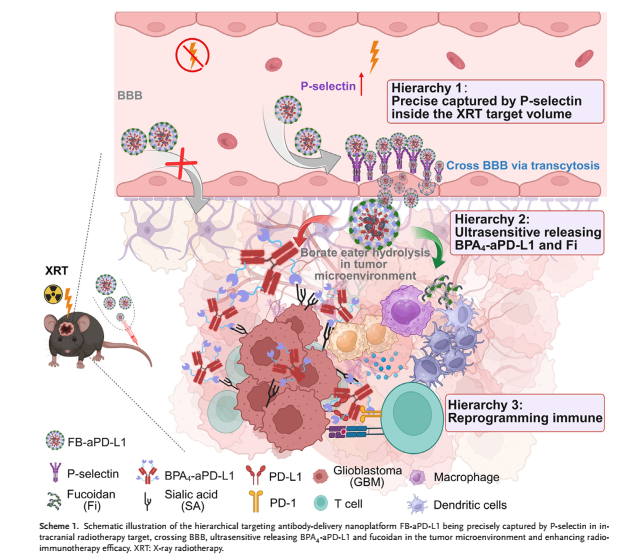
图1 单抗纳米递送平台的治疗示意图
主要研究内容
1. 放疗体系下的肿瘤微环境
研究团队发现PD-L1蛋白表达上调可能介导了肿瘤微环境中CD8+ T细胞的减少。在皮下荷瘤模型中发现,放疗联合PD-L1单抗是一种治疗脑胶质瘤的有效方式。然而,单抗递送效率较低,导致治疗受限。
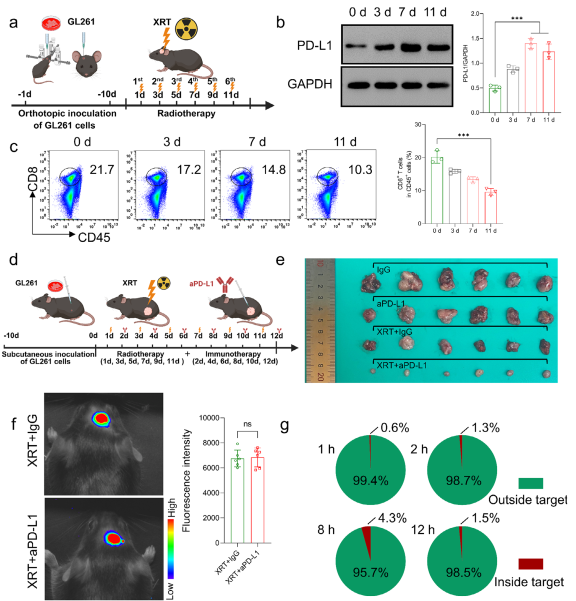
图2 放疗引起免疫微环境抑制反应
2. 血脑屏障上P-选择素的时空表达规律
研究团队通过蛋白免疫印迹(Western blot)以及组织水平上的免疫荧光(IF)检测等手段发现血脑屏障上P-选择素可受放疗X射线调控而产生时空表达特异性。
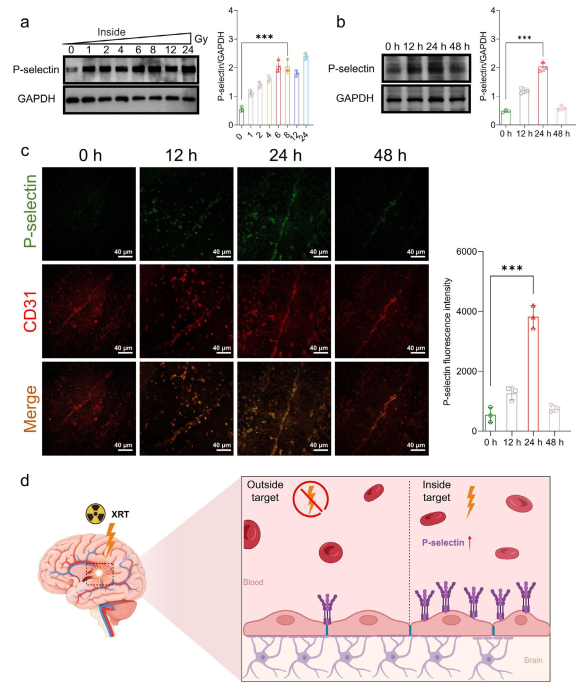
图3 血脑屏障上P-选择素受放疗调控表达规律
3. 纳米平台的制备和表征
研究团队将P-选择素的配体-岩藻多糖修饰在纳米平台外层,内部采用微酸pH灵敏响应化学键-吡啶硼酸酯键构建交联体,装载PD-L1单抗,开发了逐级精准纳米递送平台FB-aPD-L1。
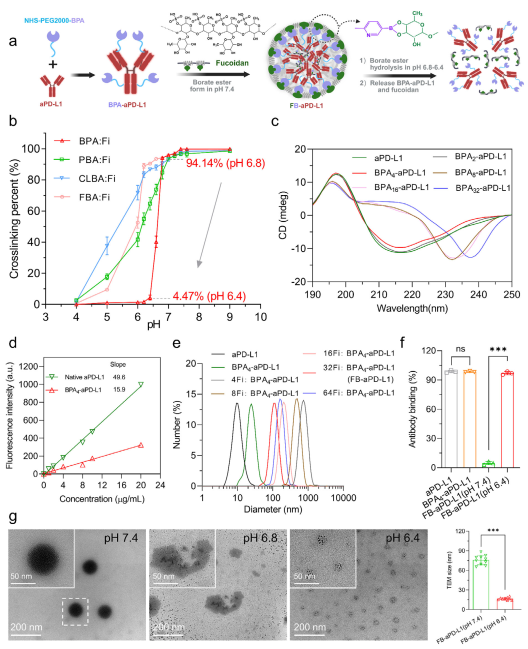
图4 纳米递送平台的表征
4. 纳米平台递送效率检测
研究团队在体外利用Transwell细胞装置并结合体内原位脑胶质瘤动物模型,对纳米平台的跨血脑屏障递送效率进行了评价。相关检测结果表明本次开发的纳米平台是由P-选择素介导的跨血脑屏障,并且可以将递送量提升至少6倍。
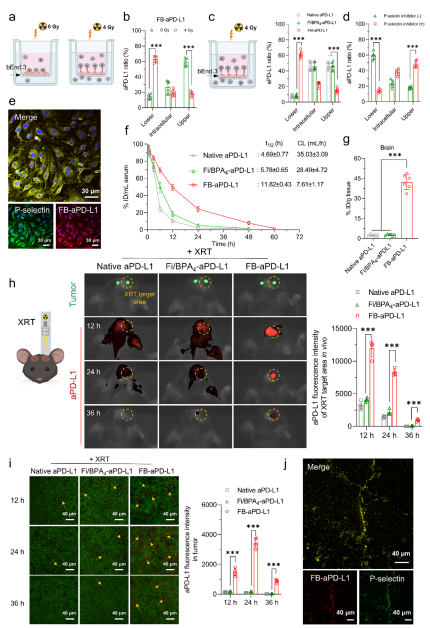
图5 体外以及体内评价纳米平台递送效率
5. 纳米递送平台治疗效果评价
研究团队构建了原位脑胶质瘤动物模型,并进行了系统性的治疗评价。肿瘤荧光强度逐渐减弱,尺寸变小,生存期延长等多个方面均验证了递送平台增强了放疗-免疫协同治疗脑胶质瘤的效果。
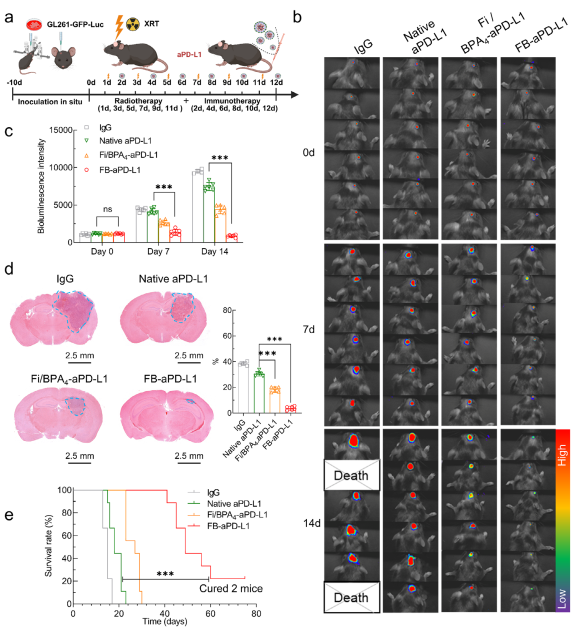
图6纳米递送平台抗肿瘤效果评价
6. 免疫学治疗机制分析
研究团队通过流式细胞术、免疫荧光、免疫组化等多种手段分析了纳米平台对肿瘤免疫微环境的影响。结果均表明纳米平台释放单抗和岩藻多糖可以协同提升CD8+ T细胞、M1型巨噬细胞、成熟DC细胞等相关免疫细胞数量,重编程免疫微环境。
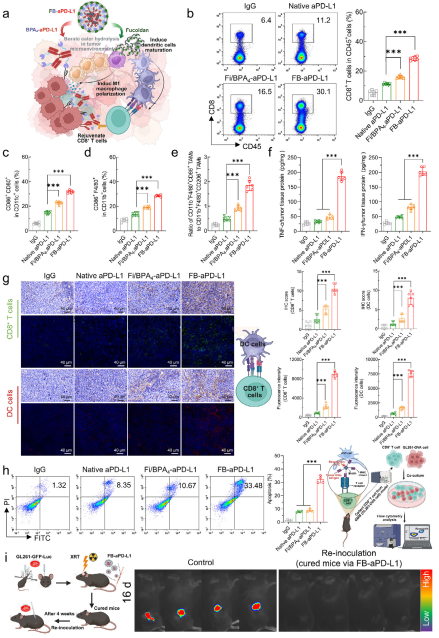
图7纳米递送平台改善了免疫微环境
【结论与展望】
在本研究中,研究团队设计了一种修饰岩藻多糖的纳米平台FB-aPD-L1,以克服PD-L1单抗不能有效递送到放疗靶区这一关键限制。FB-aPD-L1被岩藻多糖部分功能化,选择性地与脑微血管内皮细胞上辐射上调的P-选择素结合。穿过血脑屏障到达酸性肿瘤微环境后,超pH敏感的吡啶硼酸酯键发生水解,触发交联纳米结构的分解,同时释放PD-L1单抗和结构单元岩藻多糖。释放的单抗有效地阻断了CD8+ T细胞的耗竭,而岩藻多糖同时促进了DC细胞的成熟和巨噬细胞向抗肿瘤M1表型的极化。这种双重免疫调节作用协同重新编程免疫抑制环境,从而放大放射-免疫治疗的效果。综上所述,这项工作建立了一个刺激响应性纳米递送平台,证明了在放射诱导的脑胶质瘤治疗中实现精确的血脑屏障穿越和组合免疫调节的巨大临床转化潜力。
原文链接:
https://advanced.onlinelibrary.wiley.com/doi/abs/10.1002/adfm.202516391
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)