首页 > 医疗资讯/ 正文
摘要
脑卒中是体外膜肺氧合(ECMO)治疗期间最常见且最严重的神经并发症之一,密切监测、早期识别和及时干预可以减少脑卒中的发生率并大大降低患者死亡率。经颅多普勒超声(TCD)和经颅彩色多普勒超声(TCCD)因其床旁可操作性、实时动态监测能力以及无创安全性,已成为ECMO患者脑血流监测的首选工具。本综述总结了不同ECMO模式下脑血流的频谱特征,并重点阐述了TCD/TCCD在预测脑卒中事件、监测脑微栓子信号、反映颅内压变化、确认脑死亡及提供预后评价方面的最新研究进展及临床意义。
关键词:体外膜肺氧合;经颅多普勒超声;脑卒中;脑血流动力学;脑死亡
Key words:Extracorporeal membrane oxygenation;Transcranial Doppler;Stroke;Cerebral hemodynamics;Brain death
体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)是一种已广泛用于治疗难以控制的严重心力衰竭和呼吸衰竭的关键技术[1],它通过体外机械循环将患者的静脉血引流至体外,再经过氧合和二氧化碳排出后回输患者体内[2],可暂时替代心肺功能。ECMO治疗期间神经系统并发症(尤其是脑卒中)发生率高达4.5%~14.8%,死亡率高达89%[3-6],严重影响患者的预后及生存质量。因此脑卒中的早期识别与干预对改善ECMO患者结局至关重要。但传统神经影像学检查(如CT、MRI)因患者转运风险高、检查时间长等限制,难以满足ECMO患者重复监测和及时、快速识别脑卒中风险的要求。
经颅多普勒超声(transcranial Doppler,TCD)和经颅彩色多普勒超声(transcranial color Doppler ultrasonography,TCCD)作为一种床旁、无创、可重复性的脑血流动力学监测工具,目前已成为实时评估脑血流的首选方法[7]。既往研究表明,TCD/TCCD在诊断缺血性脑卒中患者动脉狭窄/闭塞、侧支循环评估方面具有极高的敏感性(87.5%)[8,9],并在危重症患者的颅内压(intracranial pressure,ICP)监测[10,11]、脑死亡诊断[12]及脑血流自动调节评估[13]中存在广泛应用,因此TCD/TCCD在ECMO患者脑卒中的早期识别、治疗评价和预后预测中都具有巨大潜力。本综述旨在系统阐述TCD/TCCD在ECMO相关脑卒中评估中的技术原理、临床应用及研究进展,为优化ECMO患者的神经监测策略提供循证依据。
1 不同ECMO模式下的脑血流频谱
ECMO按照血液回输途径分为2种模式:第1种是静脉输出-静脉回流(venovenous ECMO,VV-ECMO),此模式仅具有呼吸辅助作用;第2种是静脉输出-动脉回流(venous-arterial ECMO,VA-ECMO),此模式兼具循环和呼吸辅助功能[14]。如果VA-ECMO患者采用了容量给药、正性肌力药物和输注血管收缩剂后仍存在持续休克,也可以联合使用主动脉内球囊反搏器(intraaortic balloon pump,IABP),即VA-ECMO联合IABP[15]。
上述3种模式由于工作原理不同,开启后会引起不同的脑血流变化。TCD/TCCD评估脑血流的常用指标有收缩期峰值流速(peak systolic velocity,Vs)、舒张期末流速(diastolic velocity,Vd)、平均血流速度(mean flow velocity,Vm)和血管搏动指数(vascular pulse index,PI)等。正常人大脑中动脉的Vm为(55±12) cm/s,PI参考值范围为0.65~1.10,频谱形态呈低阻型单相波,分为收缩期S1峰(心脏收缩后形成收缩峰)、S2峰(血液进入大动脉后出现的血管搏动波)和心脏舒张早期形成的波峰D峰[16]。下面将分别介绍3种不同模式开启时患者的脑血流特点。
1.1 VV-ECMO
VV-ECMO仅具有呼吸辅助作用,依赖患者自身心脏搏动,因此保留了搏动血流。Caturegli等[17]在一项纳入了95例VA-ECMO和40例VV-ECMO患者的研究中发现,在两种模式下患者的大脑中动脉M1段、大脑前动脉A1段、基底动脉和椎动脉的Vm与健康成人队列相比均无显著差异,只有颈内动脉C1段高于健康人。但也有研究认为VV-ECMO支持下的患者脑血流量可能低于正常人。Bombardieri等[18]通过TCD记录了210例患者在VV-ECMO开始前和开始后45 min时的脑血流数据,发现VV-ECMO开始后,平均脑血流量(cerebral blood flow,CBF)由67 cm/s减少为55 cm/s(P=0.002),PI值由0.72上升至0.89(P=0.001)。原因可能是VV-ECMO的开启迅速改善了动脉低氧血症和二氧化碳分压(PCO2)。PCO2与脑血流量呈正相关,所以VV-ECMO启动后PCO2的快速下降导致了患者脑血管收缩,从而使脑血流量下降、PI值升高[19]。
1.2 VA-ECMO
VA-ECMO通过动脉系统逆向灌注氧合血,形成平流(非搏动性血流),因此波形显示为没有明显收缩峰的连续血流。Melmed等[20]记录了27例VA-ECMO患者的大脑中动脉血流,平均流速(56.07±21.00) cm/s,PI值(0.43±0.20),认为VA-ECMO患者在维持正常平均压的情况下,与正常人的大脑中动脉Vm没有明显差异,但PI值明显减低。
VA-ECMO患者本身的脑血流频谱形态及PI值还取决于心脏收缩功能,有研究认为当左室射血分数(left ventricular ejection fraction,LVEF)10%时,TCD只能检测到无搏动性脑血流[21],LVEF=13.50%是右侧大脑中动脉出现收缩期峰值的最佳预测值,之后随着心脏功能的改善、LVEF的升高,患者的PI也逐渐升高至正常[22]。另一项研究则认为如果不联合IABP,只有当LVEF20%时,才能检测到明显的收缩期峰值[23]。虽然对于出现搏动性血流时的LVEF值有所争议,但上述结果说明TCD/TCCD可通过显示大脑中动脉频谱形态和PI值变化及时反应ECMO患者心功能恢复情况(见图1)。
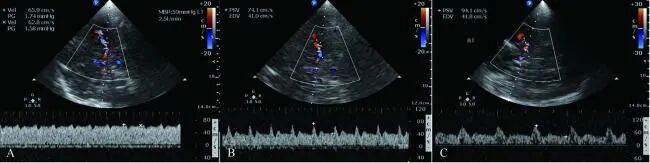
图1 同一患者VA-ECMO模式下颈内动脉终末段TCCD频谱
注:A,治疗1 d后,LVEF=11%;B,治疗8 d后,LVEF=24%;C,治疗11 d后,LVEF=60%。
1.3 VA-ECMO联合IABP
IABP的原理是在降主动脉内置入球囊,心脏收缩时球囊快速放气、造成空腔效应,增加心排血量;心脏舒张开始时球囊快速充气、增加动脉舒张压,从而增加冠状动脉灌注[24]。在VA-ECMO支持期间增加IABP已被证明可改善心脏手术后难治性心源性休克的冠状动脉搭桥术流量和心脏功能[25,26],但同时也有可能对脑血流量造成影响——降低心脏钝抑期间的脑血流量,并增加没有心脏钝抑的情况下的脑血流量。当心脏处于顿抑状态时(脉压≤10 mmHg), VA-ECMO联合IABP模式的脑血流量低于单独VA-ECMO模式,因为舒张期IABP球囊充气扩张很可能阻碍了ECMO经股动脉插管向上提供给大脑的血流灌注;而当心脏功能逐渐恢复(脉压10 mmHg)、心脏有一定收缩射血功能时,VA-ECMO联合IABP的脑血流量明显高于单独VA-ECMO[27]。所以专家共识建议当两者联合使用时,应该监测启动前后患者的脑血流变化,以便及时调整参数[7]。此外由于VA-ECMO联合IABP的安全性和远期预后效果存在一定争议,目前并不作为常规推荐使用。
频谱形态方面,由于IABP的辅助作用,VA-ECMO联合IABP模式下脑血流波形表现为更加明显的血流搏动,且搏动次数与反搏频率有关。1∶1反搏代表每次心跳均提供反搏,1∶2或1∶3反搏表示2次或3次心跳才反搏1次,其中临床最常用的是1∶1反搏(见图2)。
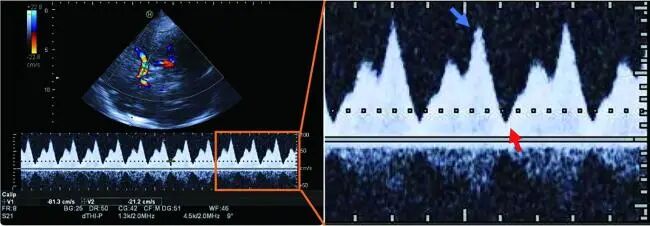
图2 1∶1反搏时的VA-ECMO联合IABP模式下颈内动脉终末段TCCD频谱
注:舒张期出现第2个正向血流峰值,对应IABP球囊膨胀(如蓝色箭头所示);舒张期结束时血流迅速减低,对应IABP球囊放气(如红色箭头所示)。
2 TCD/TCCD在ECMO患者脑卒中评估中的应用
脑卒中是指脑部血管阻塞或突然破裂而引起的疾病,分为缺血性脑卒中和出血性脑卒中两种类型。VA-ECMO与VV-ECMO的卒中类型和机制存在显著差异:VA-ECMO中缺血性卒中占主导(发生率:缺血性卒中4%~10% vs 出血性卒中2.0%~2.8%),与动脉插管导致的栓塞、低灌注、氧分压(PO2)升高、肾脏代替治疗等相关[4,6,28-31]。VV-ECMO中出血性卒中更常见(发生率:出血性卒中2%~8% vs 缺血性卒中1.4%~2.0%),与女性、ECMO上机时间、溶血、颈静脉插管致脑静脉高压或血栓形成等相关[4,30-32]。
VA-ECMO的总体脑卒中发生率(19%)高于VV-ECMO(10%),其中缺血性卒中风险尤其显著(VA-ECMO 10% vs VV-ECMO 1%)[29]。
2.1 脑血流速度
O’Brien等[33]研究纳入了18例18岁以下患者[年龄(3.8±7.2)岁],其中VV-ECMO 5例、VA-ECMO 13例,发现所有未发生明显神经损伤的患儿在ECMO支持时的脑血流速度低于正常值:Vs是同年龄、同性别儿童正常值的(54%±3%),Vm是同年龄、同性别儿童正常值的(52%±4%);拔管后Vs和Vm均较前升高,分别为[(73%±3%) vs上机时(P=0.000 7)、(64%±4%) vs上机时(P=0.01)]。但4例出现明显临床脑出血症状的患儿(VV-ECMO 1例、VA-ECMO 3例)在临床诊断前2~6 d均已观察到高于正常值的血流速度,并在该时间段内一直保持在较高水平。并且ECMO支持类型(VV、VA)和插管位置(外周、中心)与Vs(P=0.84)或Vm(P=0.31)的差异无统计学意义。
Rilinger等[34]的研究也证实了局灶性流速升高和双侧流速不对称可能提示患儿即将发生脑损伤,这种变化最早可在损伤前4 d出现。因此,脑血流速度测定或许可作为一种简便、无创的方法早期预测ECMO患儿的脑出血事件。
2.2 血管搏动指数
PI主要反映脑血管远端血流灌注情况,与ECMO患者出血性脑卒中和缺血性脑损伤的发生均有一定相关性。Caturegli等[17]研究显示在成人VA‐ECMO患者中,TCD中脑血管的搏动消失与脑实质内出血相关(14.7% vs 1.6%,P=0.03)。O’Brien等[35]的一项前瞻性研究表明,在90 d以内发生弥漫性脑缺血的婴儿中,大脑中动脉Vs、Vm和Vd与其他接受VA-ECMO但未发生急性神经损伤的同龄儿童相比没有明显差异,但PI值明显升高。
ICP升高是急性脑损伤的常见表现,而ICP与PI值呈正相关[11],因此PI值也常用于患者出血性脑卒中的早期识别,且广泛应用于出血性脑卒中患者恢复情况的评估。PI值升高体现在脑血流频谱形态上的变化:收缩峰S1和S2峰变尖或融合成单尖峰,Vd和Vm开始下降。需要注意的是,当VA‐ECMO患者心功能极差时,脑血流频谱为平流[20],其PI值缺失无法评估ICP。随着心功能的好转,患者逐渐出现搏动性血流频谱,但由于VA‐ECMO流量或IABP搏动的影响,此时的PI值不能反映真正的ICP(PI值的升高可能代表心功能改善),如需通过PI值评估患者ICP来反映脑卒中情况,需暂停VA‐ECMO或选择其他方法[21]。
2.3 微栓子信号监测
既往研究在ECMO患者的脑血流监测中观察到大量微栓子信号(microembolic signals,MES),尤其在VA-ECMO模式下,MES的发生率高达35.0%~81.8%[36,37]。MES的主要来源是中心静脉管路中的气态栓子,少量为回路血栓或系统性血栓掉落的实性栓子[38]。TCD是唯一能够实时检测脑血流中MES的方法。在Cho等[38]的研究中,18例发生血栓的ECMO患者中78%为MES阳性(14例),其中发生动脉侧环路血栓事件的10例患者均可检测出MES,提示MES是体外循环血栓发生的重要指标之一。
为了验证ECMO患者的缺血性脑卒中与脑微栓子之间的关系,Caturegli等[36]开展了一项单中心前瞻性研究,纳入了100例VA-ECMO患者及45例VV-ECMO患者,并在35.0%VA-ECMO患者和4.7%VV-ECMO患者脑血流中观察到了MES。其中单独使用VA-ECMO组29.4%,VA-ECMO联合IABP组为38.1%,但两者差异没有统计学意义(P=0.39)。在多变量Logistic回归分析中,急性脑损伤和动脉血栓栓塞事件的复合结局也与VA-ECMO中MES的存在或数量无关。另一项由Kietaibl等[37]开展的单中心队列研究显示在VA-ECMO患者中确实观察到比普通危重症对照组和健康志愿者更多的气态MES,但大量脑微栓子、低脑血流速度与包括缺血性卒中、神经精神障碍等在内的神经系统并发症之间也没有统计学差异。Marinoni等[39]虽然发现VA-ECMO患者LVEF与MES分级呈负相关(P=0.037),但在随访的6个月期间,也未发现与MES相关的临床神经功能损害。所以尽管VA-ECMO患者MES检出率高,但目前的研究并未证实其与脑卒中之间的因果关系,临床意义仍需进一步验证。
2.4 脑死亡诊断
脑死亡是脑卒中患者最严重的临床结局,ECMO患者总体住院死亡率为56%,发生脑卒中后院内死亡率可继续升高1~2倍,因此准确诊断并鉴别ECMO患者脑死亡血流频谱具有重要意义。2004年美国神经病学学会指南及2020年全球专家共识均推荐TCD用于脑循环停止(cerebral circulatory arrest,CCA)的诊断[12,40]。目前全球临床广泛应用的脑死亡诊断标准为“进入颅底的颈内动脉和椎动脉(4支动脉)出现振荡波、收缩早期尖小收缩波和(或)无血流充盈信号”[12]。
相较于其他影像学设备而言,TCD/TCCD具有便携和无创的优势,尤其适用于无法搬动的危重症患者,因此在诊断ECMO患者脑死亡中可作为首选工具[7]。由于ECMO患者脑血流频谱的特异性,判断ECMO患者脑死亡需结合当时使用的治疗模式。多项研究认为VV-ECMO并不会引起明显的血流动力学变化,所以可以采用非ECMO患者TCD的脑死亡标准[18,41,42]。对于VA-ECMO患者,当LVEF10%~20%和(或)联合IABP时,脑血流具有一定搏动性,脑死亡的TCD频谱可呈振荡波、钉子波或无血流信号,同样可参考正常标准进行诊断(见图3);而当LVEF10%~20%且不联合IABP时,TCD频谱呈非搏动性血流,就算出现脑死亡,仍有可能因为VA-ECMO的干扰在颅内探及低连续血流信号,因此无法明确诊断,结果仅供参考[43-46]。但与此同时,如果在TCD连续监测期间突然出现信号消失强烈提示脑死亡的可能,建议采取CTA或脑电图进行下一步评估[47]。
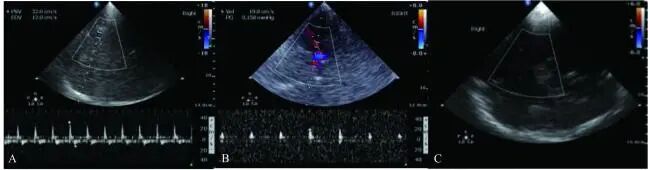
图3 脑死亡患者的VA-ECMO联合IABP模式下大脑中动脉TCCD频谱
注:A,振荡波,收缩期尖锐峰波,舒张期血流方向完全逆转。B,钉子波,收缩早期短暂正向尖峰血流信号,舒张期无血流。C,无血流信号。患者前次检查时能够获得明确血流信号,再次检查时血流消失。
3 TCD/TCCD对ECMO患者脑卒中相关预后的评估价值
Wang等[22]研究认为右侧大脑中动脉的初始Vs(OR=0.954,95%CI 0.921~0.988,P=0.009)是影响VA-ECMO患者28 d死亡率的独立危险因素。李乐等[48]的研究表明大脑中动脉的脑血流动力学指标(低Vs、Vd、Vm、高PI)均与VA-ECMO患者预后有密切联系,是一年后发生预后不良(包括心血管死亡、心肌梗死和卒中)的独立危险因素(P<0.05)。Siddiqui等[49]也进行了一项长达1年的观察性研究,在接受VA-ECMO的28例患者中,出现不良神经系统事件(包括缺血性脑卒中、脑实质出血、缺氧缺血性脑病、蛛网膜下腔出血、硬膜下出血)的患者比未出现不良神经事件的患者双侧平均颈内动脉流速更低。上述研究结果提示,较低的流速和较高的PI值可能与患者不良预后相关,临床可考虑单独或联合使用各段脑血流动力学指标,来预测ECMO患者的短期或长期不良事件的发生。
4 优势与限制
TCD/TCCD能够实时显示患者脑血流的变化,在指导参数调节、早期识别脑卒中风险方面具有其他影像学检查不可比拟的优势。但其也有一定的技术限制,比如约10%~15%患者(尤其老年患者)因为颞窗穿透性差无法进行TCD/TCCD检查。其次,这项检查对操作者技术依赖性高,需进行标准化培训,目前在基层医院的普及性不够,需要各级医院提高重视,增加推广力度。
此外,TCD/TCCD监测的准确度还会受到患者病理状态的影响。比如颅内感染患者PI值与ICP相关性较弱,可能会影响医生对出血性脑卒中等不良后果的判断,可在日常监测中使用TCD联合视神经鞘直径(optic nerve sheath diameter,ONSD)来提升ICP评估的准确性。有研究证明床旁ONSD与视神经鞘测量的金标准MRI相比具有良好相关性[50],非常适用于ECMO患者。当ICP20 mmHg(1 mmHg = 0.133 kPa)时,ONSD阈值波动在5.0~5.9 mm,因此可考虑将ONSD5.0 mm作为ICP升高预警的阈值[51],与TCD频谱形态和PI值联合进行脑卒中评估。
综上,TCD/TCCD是ECMO患者脑卒中风险评估、脑死亡确认及预后预测的关键工具,兼具无创性、实时性和成本效益,它通过提供实时脑血流动力学信息,优化了ECMO患者的临床神经功能管理策略。但目前TCD/TCCD的相关研究仍然较少,针对ECMO患者的血流参数阈值及干预策略尚需多中心、大样本研究验证。
参考文献
[1] Jentzer JC, Hibbert B. Optimal patient and mechanical circulatory support device selection in acute myocardial infarction cardiogenic shock[J]. Lancet, 2024, 404(10457): 992-993.
[2] 闵苏, 敖虎山. 不同情况下成人体外膜肺氧合临床应用专家共识(2020版)[J]. 中国循环杂志, 2020, 35(11): 1052-1063.
[3] Cho SM, Canner J, Caturegli G, et al. Risk factors of ischemic and hemorrhagic strokes during venovenous extracorporeal membrane oxygenation: analysis of data from the extracorporeal life support organization registry[J]. Crit Care Med, 2021, 49(1): 91-101.
[4] Cho SM, Canner J, Chiarini G, et al. Modifiable risk factors and mortality from ischemic and hemorrhagic strokes in patients receiving venoarterial extracorporeal membrane oxygenation: results from the extracorporeal life support organization registry[J]. Crit Care Med, 2020, 48(10): e897-e905.
[5] Sutter R, Tisljar K, Marsch S. Acute neurologic complications during extracorporeal membrane oxygenation: a systematic review[J]. Crit Care Med, 2018, 46(9): 1506-1513.
[6] Almajed MR, Fadel RA, Parsons A, et al. Incidence and risk factors associated with stroke when utilizing peripheral VA-ECMO[J]. Cardiovasc Revasc Med, 2025, 72: 1-7.
[7] 中国医师协会体外生命支持专业委员会. 体外膜氧合患者脑监测中国专家共识[J]. 中华医学杂志, 2024, 104(9): 662-673.
[8] 中华医学会神经病学分会, 中华医学会神经病学分会脑血管病学组, 中华医学会神经病学分会神经影像学协作组. 中国脑血管超声临床应用指南[J]. 中华神经科杂志, 2016, 49(7): 507-518.
[9] Finnsdóttir H, Szegedi I, Oláh L, et al. The applications of transcranial Doppler in ischemic stroke[J]. Ideggyogy Sz, 2020, 73(11-12): 367-378.
[10] de Moraes FM, Adissy ENB, Rocha E, et al. Multimodal monitoring intracranial pressure by invasive and noninvasive means[J]. Sci Rep, 2023, 13(1): 18404.
[11] Rasulo FA, Calza S, Robba C, et al. Transcranial doppler as a screening test to exclude intracranial hypertension in brain-injured patients: The IMPRESSIT-2 prospective multicenter international study[J]. Crit Care, 2022, 26(1): 110.
[12]Lewis A, Liebman J, Kreiger-Benson E, et al. Ancillary testing for determination of death by neurologic criteria around the world[J]. Neurocrit Care, 2021, 34(2): 473-484.
[13] 陈虹秀, 崔柳平, 陈松伟, 等. 经颅多普勒超声对脑血流自动调节的性别差异性研究[J]. 中国现代神经疾病杂志, 2023, 23(8): 758-764.
[14] Kulkarni T, Sharma NS, Diaz-Guzman E. Extracorporeal membrane oxygenation in adults: a practical guide for internists[J]. Cleve Clin J Med, 2016, 83(5): 373-384.
[15] Gandhi KD, Moras EC, Niroula S, et al. Left ventricular unloading with impella versus IABP in patients with VA-ECMO: a systematic review and meta-analysis[J]. Am J Cardiol, 2023, 208: 53-59.
[16] 中国医师协会超声医师分会. 血管超声检查指南[J]. 中华超声影像学杂志, 2009, 18(10): 911-920.
[17] Caturegli G, Zhang LQ, Mayasi Y, et al. Characterization of cerebral hemodynamics with TCD in patients undergoing VA-ECMO and VV-ECMO: a prospective observational study[J]. Neurocrit Care, 2023, 38(2): 407-413.
[18] Bombardieri AM, Annoni F, Partipilo F, et al. Changes in cerebral hemodynamics after veno-venous extracorporeal membrane oxygenation implementation[J]. Intensive Care Med, 2022, 48(11): 1659-1660.
[19] Thiara S, Stukas S, Hoiland R, et al. Characterizing the relationship between arterial carbon dioxide trajectory and serial brain biomarkers with central nervous system injury during veno-venous extracorporeal membrane oxygenation: a prospective cohort study[J]. Neurocrit Care, 2024, 41(1): 20-28.
[20] Melmed KR, Schlick KH, Rinsky B, et al. Assessing cerebrovascular hemodynamics using transcranial Doppler in patients with mechanical circulatory support devices[J]. J Neuroimaging, 2020, 30(3): 297-302.
[21] Kavi T, Esch M, Rinsky B, et al. Transcranial Doppler changes in patients treated with extracorporeal membrane oxygenation[J]. J Stroke Cerebrovasc Dis, 2016, 25(12): 2882-2885.
[22] Wang M, Li L, Tan YD. Transcranial Doppler ultrasound for monitoring the cerebral hemodynamic changes and prognosticating outcomes in venoarterial extracorporeal membrane-oxygenated patients[J]. Int J Clin Pract, 2022, 2022: 2912477.
[23] Marinoni M, Cianchi G, Trapani S, et al. Retrospective analysis of transcranial Doppler patterns in veno-arterial extracorporeal membrane oxygenation patients: feasibility of cerebral circulatory arrest diagnosis[J]. ASAIO J, 2018, 64(2): 175-182.
[24] 马浩源, 刘扬, 杨陆, 等. 主动脉球囊反搏术对心功能异常患者脑血流影响研究进展[J]. 创伤与急危重病医学, 2021, 9(1): 80-82.
[25] Wang K, Wang L, Ma J, et al. Intra-aortic balloon pump after VA-ECMO reduces mortality in patients with cardiogenic shock: an analysis of the Chinese extracorporeal life support registry[J]. Crit Care, 2024, 28(1): 394.
[26] Nishi T, Ishii M, Tsujita K, et al. Outcomes of venoarterial extracorporeal membrane oxygenation plus intra-aortic balloon pumping for treatment of acute myocardial infarction complicated by cardiogenic shock[J]. J Am Heart Assoc, 2022, 11(7): e023713.
[27] Yang F, Jia ZS, Xing JL, et al. Effects of intra-aortic balloon pump on cerebral blood flow during peripheral venoarterial extracorporeal membrane oxygenation support[J]. J Transl Med, 2014, 12: 106.
[28] Le Guennec L, Cholet C, Huang F, et al. Ischemic and hemorrhagic brain injury during venoarterial-extracorporeal membrane oxygenation[J]. Ann Intensive Care, 2018, 8(1): 129.
[29] Shoskes A, Migdady I, Rice C, et al. Brain injury is more common in venoarterial extracorporeal membrane oxygenation than venovenous extracorporeal membrane oxygenation: a systematic review and meta-analysis[J]. Crit Care Med, 2020, 48(12): 1799-1808.
[30] Illum B, Odish M, Minokadeh A, et al. Evaluation, treatment, and impact of neurologic injury in adult patients on extracorporeal membrane oxygenation: a review[J]. Curr Treat Options Neurol, 2021, 23(5): 15.
[31] Hwang J, Kalra A, Shou BL, et al. Epidemiology of ischemic stroke and hemorrhagic stroke in venoarterial extracorporeal membrane oxygenation[J]. Crit Care, 2023, 27(1): 433.
[32] Nunez JI, Gosling AF, O’Gara B, et al. Bleeding and thrombotic events in adults supported with venovenous extracorporeal membrane oxygenation: an ELSO registry analysis[J]. Intensive Care Med, 2022, 48(2): 213-224.
[33] O’Brien NF, Hall MW. Extracorporeal membrane oxygenation and cerebral blood flow velocity in children[J]. Pediatr Crit Care Med, 2013, 14(3): e126-e134.
[34] Rilinger JF, Smith CM, DeRegnier RAO, et al. Transcranial Doppler identification of neurologic injury during pediatric extracorporeal membrane oxygenation therapy[J]. J Stroke Cerebrovasc Dis, 2017, 26(10): 2336-2345.
[35] O’Brien NF, Buttram SDW, Maa T, et al. Cerebrovascular physiology during pediatric extracorporeal membrane oxygenation: a multicenter study using transcranial Doppler ultrasonography[J]. Pediatr Crit Care Med, 2019, 20(2): 178-186.
[36] Caturegli G, Kapoor S, Ponomarev V, et al. Transcranial Doppler microemboli and acute brain injury in extracorporeal membrane oxygenation: a prospective observational study[J]. JTCVS Tech, 2022, 15: 111-122.
[37] Kietaibl C, Horvat Menih I, Engel A, et al. Cerebral microemboli during extracorporeal life support: a single-centre cohort study[J]. Eur J Cardio Thorac Surg, 2021, 61(1): 172-179.
[38] Cho SM, Ziai W, Mayasi Y, et al. Noninvasive neurological monitoring in extracorporeal membrane oxygenation[J]. ASAIO J, 2020, 66(4): 388-393.
[39] Marinoni M, Migliaccio ML, Trapani S, et al. Cerebral microemboli detected by transcranial Doppler in patients treated with extracorporeal membrane oxygenation[J]. Acta Anaesthesiol Scand, 2016, 60(7): 934-944.
[40] Greer DM, Shemie SD, Lewis A, et al. Determination of brain death/death by neurologic criteria: the world brain death project[J]. JAMA, 2020, 324(11): 1078-1097.
[41] Berthoud V, Ellouze O, Constandache T, et al. Transcranial Doppler waveform patterns in nonpulsatile blood flow under venoarterial extracorporeal membrane oxygenation for brain death diagnosis[J]. ASAIO J, 2020, 66(4): e64.
[42] Cestari M, Gobatto ALN, Hoshino M. Role and limitations of transcranial Doppler and brain death of patients on veno-arterial extracorporeal membrane oxygenation[J]. ASAIO J, 2018, 64(4): e78.
[43] 国家脑损伤评价医疗质量控制中心脑死亡判定工作组, 中华医学会神经病学分会神经重症协作组, 中国医师协会神经内科医师分会神经重症学组. 体外膜氧合支持时脑损伤评估与脑死亡判定专家共识(2025版)[J]. 中华医学杂志, 2025, 105(17): 1331-1346.
[44] Migdady I, Shoskes A, Amin M, et al. Determination of brain death in patients undergoing short-term mechanical circulatory support devices[J]. Heart Lung Circ, 2022, 31(2): 239-245.
[45] Migdady I, Stephens RS, Price C, et al. The use of apnea test and brain death determination in patients on extracorporeal membrane oxygenation: a systematic review[J]. J Thorac Cardiovasc Surg, 2021, 162(3): 867-877.e1.
[46] Zhao DX, Caturegli G, Wilcox C, et al. Challenges in determining death by neurologic criteria in extracorporeal membrane oxygenation - A single center experience[J]. Perfusion, 2024, 39(6): 1238-1246.
[47] Marinoni M, Trapani S, Cianchi G. Transcranial Doppler confirming of brain death in patients treated with venoarterial extracorporeal membrane oxygenation[J]. ASAIO J, 2020, 66(4): e65.
[48] 李乐, 王曼, 刘振霖. 经颅多普勒超声在体外膜肺氧合患者脑血流动力学监测及预后评估中的应用[J]. 分子影像学杂志, 2022, 45(3): 413-418.
[49] Siddiqui K, Hafeez MU, Ahmad A, et al. Multimodal neurologic monitoring in patients undergoing extracorporeal membrane oxygenation[J]. Cureus, 2024, 16(5): e59476.
[50] Kerscher SR, Zipfel J, Groeschel S, et al. Comparison of B-scan ultrasound and MRI-based optic nerve sheath diameter (ONSD) measurements in children[J]. Pediatr Neurol, 2021, 124: 15-20.
[51] Fernando SM, Tran A, Cheng W, et al. Diagnosis of elevated intracranial pressure in critically ill adults: systematic review and meta-analysis[J]. BMJ, 2019, 366: l4225.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)