首页 > 医疗资讯/ 正文
多发性骨髓瘤(MM)是一种无法治愈的血液恶性肿瘤,其特征是克隆性浆细胞增殖,尽管一线治疗取得了显著进展,但疾病仍不可避免地进展。现代诱导治疗通常包含蛋白酶体抑制剂(PIs)、免疫调节剂(IMiDs)、抗CD38单克隆抗体(mAbs)和类固醇的多药方案,它们改善了患者的预后;然而复发/难治性MM(RRMM)仍然构成重大的临床挑战,特别是对于患有合并症、高危细胞遗传学或衰弱的患者。
《Blood Reviews》近日发表综述,概述了当前和新兴的变革性新型疗法,包括抗CD38和抗SLAMF7单克隆抗体、BCMA靶向免疫疗法(如CAR T细胞和双特异性抗体),重点介绍了关键研究的疗效和安全性,还提供了一个临床决策的实用框架。

RRMM的治疗
RRMM的可选方案
国际骨髓瘤工作组(IMWG)提供了定义多发性骨髓瘤复发和难治性的标准,详见表1。

本质上,复发意味着初始缓解后的疾病进展,可以是生化的(例如,M蛋白或游离轻链显著升高),也可以是临床的(出现或恶化的CRAB特征:高钙血症、肾功能不全、贫血或骨病变)。难治性MM的特征为对治疗缺乏最小缓解或在末次治疗后60天内疾病进展。在存在多种治疗选择的情况下,一个特别具有挑战性的情况在于为首次复发找到合适的疗法。遗传学高危疾病和功能性高危MM(通常在初始治疗或移植后12个月内复发)与较差的预后相关,并且通常意味着对PI、IMiD和mAb等一线治疗耐药,因此需要创新的治疗策略。
对MM病理生物学不断深入的理解揭示了众多可操作的分子靶点,为更精确的治疗干预铺平了道路(图3)。
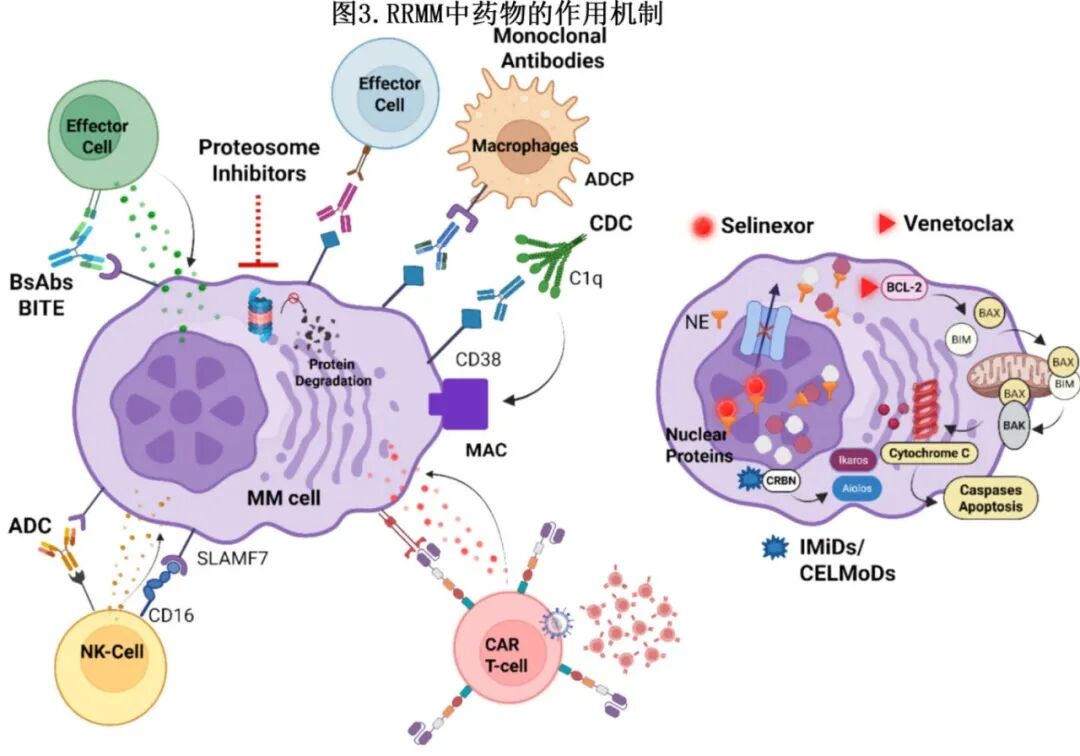
其中较为突出的是细胞表面抗原,如BCMA CAR T细胞(例如,idecabtagene vicleucel、ciltacabtagene autoleucel)和BsAbs(例如,特立妥单抗、埃纳妥单抗、linvoseltamab),靶向BsAb的GPRC5D(例如塔奎妥单抗)以及抗体药物偶联物(ADCs)。支撑当前疗法的其他关键靶点包括CD38(达雷妥尤单抗,艾莎妥昔单抗)、SLAMF7(elotuzumab)、BCL-2蛋白(尤其适用于t(11;14) MM的维奈克拉)、核输出蛋白XPO1(通过赛利尼索)和蛋白酶体(硼替佐米、卡非佐米)。针对这些靶点的药物开发标志着RRMM治疗朝着日益个性化和有效的方向取得进展。
早期复发(1-3线治疗)的治疗
MM首次复发的治疗方法高度个体化,取决于多种因素的联合:对既往治疗的反应性质和持续时间,包括特定的药物暴露和难治性(例如,对来那度胺、硼替佐米或抗CD38药物难治)、患者特异性特征(如体能状态和合并症)、潜在疾病生物学(例如,细胞遗传学风险状况)以及患者偏好(图1)。
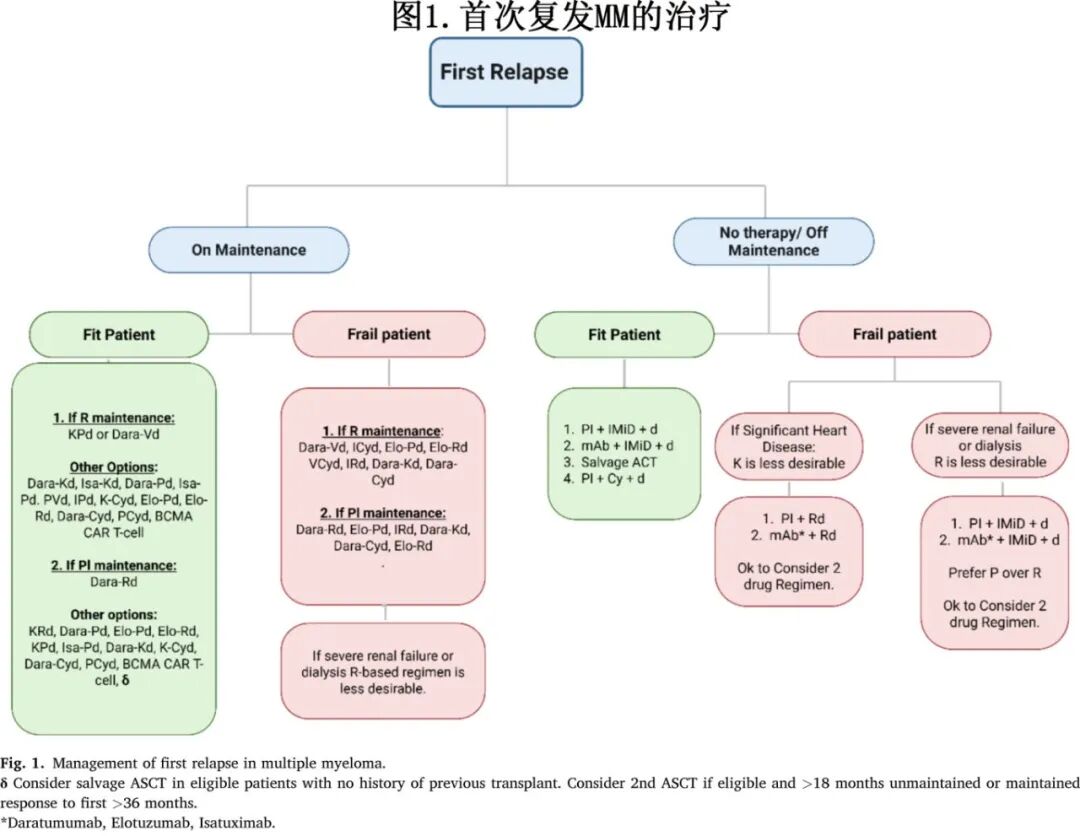
对于符合条件的患者,三药联合方案通常是标准治疗,已得到多项III期证据的支持,证明其疗效优于双药疗法(表2)。
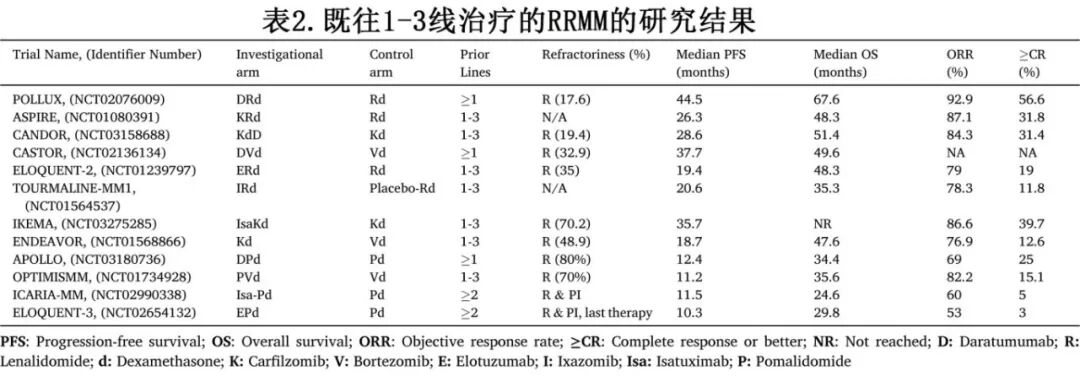
需要注意的是,由于患者群体、既往治疗线和研究设计的异质性,直接跨试验比较具有挑战性;然而,这些数据仍可为决策提供基础证据。FDA已批准ciltacabtagene autoleucel用于首次复发后的来那度胺难治患者,以及idecabtagene vicleucel用于第二次复发后,这标志着早期复发MM治疗的重大进展。建议与患者及其家属进行讨论,提供有关常规疗法和细胞疗法的必要信息,以帮助就下一步治疗方案做出明智决策。然而,对于全球范围内许多经历首次复发的患者来说,启动三药联合仍然是一种常见策略。个体化治疗至关重要:衰弱患者或有显著合并症的患者可能受益于改良剂量组合或某些PI-IMiD两药方案。
与三药方案相比,含抗CD38 mAb(例如,达雷妥尤单抗或艾莎妥昔单抗)、PI、IMiD和地塞米松的四药诱导治疗显著提高了缓解深度、PFS、总生存期(OS),并使MRD阴性率和持续12个月MRD阴性率提高2.5-3倍,减少了早期复发(移植后12-18个月内复发的功能性高危患者数量减少),仅伴有轻微的血液学毒性和感染增加。这种获益特指含抗CD38药物的四药方案,与三药方案相比,MRD阴性率高达62%,PFS的风险比(HR)为0.54,OS的HR为0.65。在新诊断适合移植的MM(NDMM)中,四药诱导治疗后进行自体干细胞移植(ASCT)巩固治疗,将诱导后10-5灵敏度下的MRD阴性率从63%提高到维持治疗前10-6灵敏度下的73-76%。ASCT提供了更大的MRD负荷降低,对于具有一个或多个高危细胞遗传学异常的患者,中位MRD对数降低为1.26-1.34,而标危患者仅有0.91。然而,在一线治疗中早期使用四药诱导治疗和ASCT会使患者暴露于所有三种主要药物类别(抗CD38 mAb、PI和IMiD)。在首次复发时,这些患者更有可能成为三类暴露/难治,从而适合商业化CAR T细胞疗法ciltacabtagene autoleucel治疗。
虽然第二次ASCT在历史上曾较为认可,但在高效新药时代现在很少用于首次复发。关键Myeloma X Relapse(Intensive)随机试验表明,与每周环磷酰胺相比,第二次ASCT改善了PFS(分别为19个月 vs. 11个月)。随后的数据一致表明,对于首次ASCT后缓解持续时间至少18个月的患者获益最大。然而对于大多数患者,尤其是早期复发者,较新的非移植疗法是首选,以避免移植相关毒性。
侵袭性复发可能需要强化、多药化疗(例如,DCEP, VTD-PACE)以快速控制疾病,通常作为通往细胞疗法的桥接,目标是建立长期疾病控制并达到MRD阴性状态的更深缓解,同时保持生活质量,最小化累积毒性,提高生存率,并进一步增强未来需要时接受后续治疗的资格。
基于抗CD38的三药方案
在首次复发情况下,包含抗CD38单克隆抗体的三药方案已成为基础性方法,显示出显著的疗效提升。POLLUX试验确立了在≥1线既往治疗的患者中,达雷妥尤单抗、来那度胺和地塞米松(DRd)优于来那度胺和地塞米松(Rd)。DRd显著延长了中位PFS(44.5个月 vs. Rd的17.6个月;HR 0.56, p<0.0001),具有更高的客观缓解率(ORR)(92.9% vs. Rd的76.4%)。对于可能不适合来那度胺或对其进展的患者,达雷妥尤单抗、硼替佐米和地塞米松(DVd)的联合方案提供了一个有效的替代方案。CASTOR试验比较了DVd与硼替佐米+地塞米松(Vd),显示DVd的中位PFS显著改善(37.7个月 vs. Vd的19.9个月;HR 0.43, p<0.0001),具有更高的ORR(82% vs. Vd的63%)。POLLUX和CASTOR试验也都报告了含达雷妥尤单抗的三药方案有更高的MRD阴性率。
达雷妥尤单抗联合强效PI卡非佐米及地塞米松(DKd)在CANDOR试验中进行了研究。在1-3线既往治疗的患者中,与卡非佐米和地塞米松(Kd)相比,DKd具有更优的中位PFS(28.4个月 vs. Kd的15.2个月;HR 0.64)和更高的MRD阴性率。艾莎妥昔单抗是另一种抗CD38单克隆抗体,在与卡非佐米和地塞米松联合时也显示出强大的疗效。在IKEMA试验(1-3线既往治疗的患者)中,艾莎妥昔单抗、卡非佐米和地塞米松(Isa-Kd)方案与Kd相比显著延长PFS(中位PFS 35.7 vs. 19.15个月;HR 0.53, p<0.0001),也实现了高ORR(86.6%)和深度缓解。
基于蛋白酶体抑制剂的三药方案
基于蛋白酶体抑制剂的三药方案(含或不含抗CD38 mAbs)仍然是治疗的重要组成部分。卡非佐米、来那度胺和地塞米松(KRd)方案在ASPIRE试验(1-3线既往治疗)中进行了评估,其中KRd相较于Rd显著改善中位PFS(26.3个月 vs. 17.6个月;HR 0.69, p<0.001)。重要的是,KRd也带来显著的OS获益(中位OS 48.3个月 vs. Rd的40.4个月;HR 0.79, p=0.0045)。虽然三药方案通常是首选,但Kd双药方案在ENDEAVOR试验(1-3线既往治疗)中显示出优于硼替佐米和地塞米松(Vd),Kd改善了中位PFS(18.7个月 vs. Vd的9.4个月;HR 0.53, p<0.0001)和中位OS(47.6个月 vs. Vd的40.0个月;HR 0.79, p=0.01)。伊沙佐米、来那度胺和地塞米松(IRd)是一个全口服的PI-IMiD组合,在TOURMALINE-MM1试验(1-3线既往治疗)中进行了研究,显示出改善的中位PFS(20.6个月 vs. Rd的14.7个月;HR 0.74, p=0.01)和ORR(78.3% vs. Rd的71.5%)。
卡非佐米、泊马度胺和地塞米松(KPd)也是一种高活性的方案,I/II期研究显示高ORR(范围62-95%)和令人鼓舞的PFS(中位约9-12+个月,取决于研究和患者群体,包括来那度胺难治患者)。在早期RRMM中对来那度胺难治的患者进行的SELECT研究报告ORR为58%,中位PFS为11.1个月。对于IMiD可能不是最佳选择的患者,卡非佐米、环磷酰胺和地塞米松(KCd)提供了一种替代的PI-烷化剂骨干方案。在有一线既往治疗方案的患者中进行的II期MUKfive试验比较了KCd与硼替佐米、环磷酰胺和地塞米松(VCd),发现KCd的≥VGPR率更高,中位PFS为11.9个月,而VCd为5.6个月。
基于免疫调节剂的三药方案
随着疾病进展到第二次和第三次复发,MM通常表现出生物学异质性增加和对先前有效疗法(包括PIs和IMiDs)的更高耐药倾向。随着治疗线数的增加,缓解持续时间通常会缩短。因此,在此阶段的治疗决策必须仔细考虑患者的详细治疗史、获得性耐药模式、体能状态和合并症(图2)。
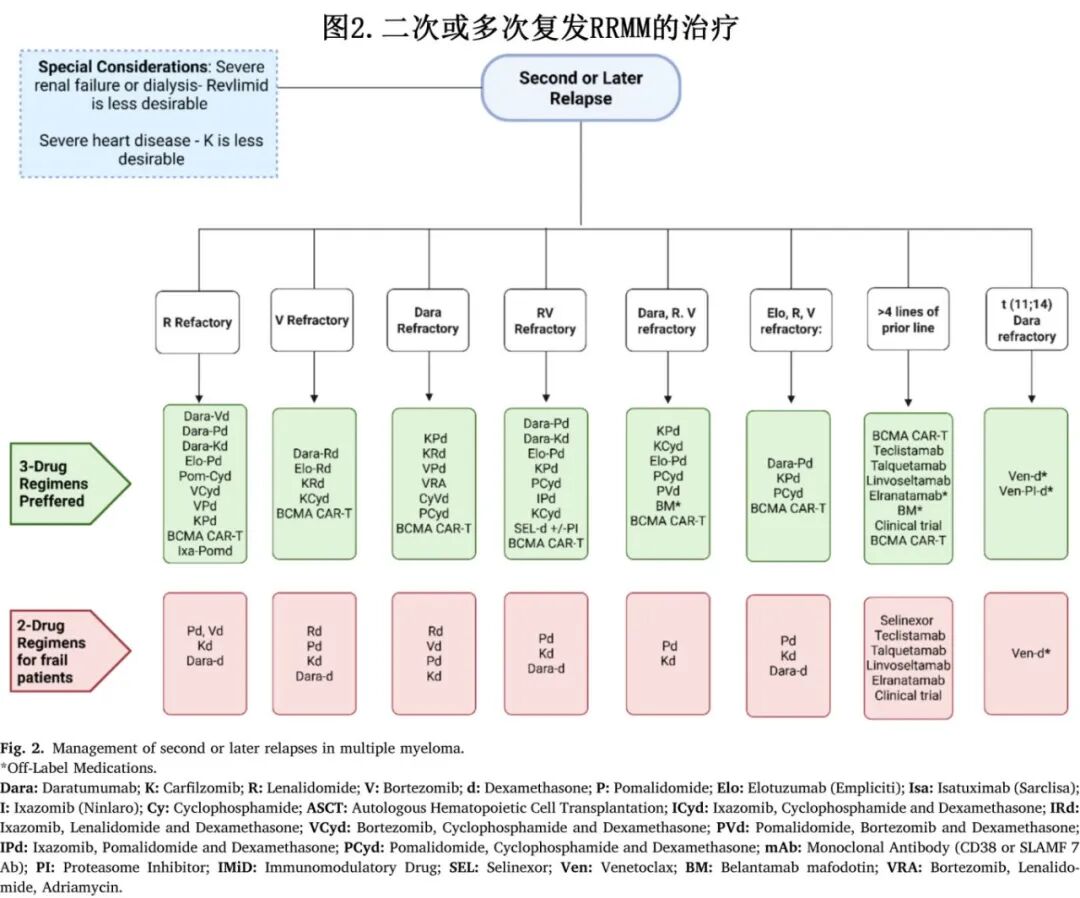
使用具有不同作用机制的药物是克服耐药性的关键策略。对于符合条件的患者,三药方案通常仍优于两药方案,但耐受性也变得越来越关键(表2)。几种三药组合在这种情况下显示出疗效,通常利用泊马度胺或下一代mAbs和PIs。达雷妥尤单抗、泊马度胺和地塞米松(DPd)方案对于先前暴露于或对来那度胺难治的患者特别有用。III期APOLLO试验比较了DPd与泊马度胺和地塞米松(Pd)在≥1线既往治疗(大多数为2-3线既往治疗)的患者中的效果。DPd显著改善中位PFS(12.4个月 vs. Pd的6.9个月;HR 0.63, p<0.0001)和ORR(69% vs. 46%)。
泊马度胺、硼替佐米和地塞米松(PVd)是另一个已确立的三药方案,特别适用于对硼替佐米不耐药的患者。III期OPTIMISMM试验纳入1-3线既往治疗(70%为来那度胺难治)的患者,证明PVd与Vd单用相比显著提高中位PFS(11.2个月 vs. 7.1个月;HR 0.61, p<0.0001)和ORR(82.2% vs. 50%)。艾莎妥昔单抗、泊马度胺和地塞米松(Isa-Pd)是≥2线既往治疗(包括PI和来那度胺)患者的重要方案。ICARIA-MM试验显示,与Pd单用相比,Isa-Pd显著改善中位PFS(11.5个月 vs. 6.5个月;HR 0.596, p=0.001)和中位OS(24.6个月 vs. 17.7个月;p=0.028)。
嵌合抗原受体(CAR)T细胞疗法
CAR T细胞疗法是RRMM一种变革性的个性化免疫疗法,但需要在经过认证的、具有管理其独特毒性专业知识的中心进行。鉴于ciltacabtagene autoleucel(用于首次复发后)和idecabtagene vicleucel(用于第二次复发后)的批准,它们的使用将取决于患者的资格、可用性、保险授权,以及与患者在详细讨论短期、长期毒性、发病率和死亡率风险以及罕见但严重的神经系统毒性(如运动障碍)影响后的知情决定。
其他已确立的疗法
Elotuzumab、来那度胺和地塞米松(ERd)方案中,抗SLAMF7单克隆抗体Elotuzumab通过ADCC和其他机制增强抗骨髓瘤活性。ELOQUENT-2试验主要在未接触过来那度胺的患者(1-3线既往治疗)中进行,显示ERd改善中位PFS(19.4个月 vs. Rd的14.9个月;HR 0.70, p=0.0004)和ORR(79% vs. 66%)。这些方案之间的选择受先前概述的因素指导,包括既往治疗暴露(尤其是来那度胺难治性)、患者合并症(例如,卡非佐米的心脏健康状况、硼替佐米的神经病变风险)和后勤考虑(例如,口服 vs. 静脉)。表2总结了这些首次复发方案的关键试验结果。
Elotuzumab、泊马度胺和地塞米松(EPd)在ELOQUENT-3 II期试验中针对对来那度胺和PI难治的患者进行了评估。与Pd单用相比,EPd使中位PFS翻倍(10.3个月 vs. 4.7个月;HR 0.54, p=0.008)并显著改善中位OS(29.8个月 vs. 17.4个月)。该方案被批准用于至少接受过两种既往治疗(包括来那度胺和PI)的患者。
塞利尼索是一种口服选择性核输出抑制剂(SINE),提供了一种新颖的作用机制。对于≥1线既往治疗的患者,塞利尼索、硼替佐米和地塞米松(SVd)在BOSTON试验中与Vd相比显示出改善PFS(13.9个月 vs. 9.5个月;HR 0.70, p=0.0075)。塞利尼索与泊马度胺的组合(SPd)在I/II期环境中也显示出活性(例如,STOMP试验,ORR 50-65%)。基于赛利尼索的方案对于对其他药物类别难治的疾病患者特别有价值。XPO1抑制剂独特的T细胞调节特性也可能与细胞疗法的顺序相关。许多抗BCMA治疗后和CAR T后的患者仍然对赛利尼索及其与PI、CD38抗体、IMiDs的联合治疗是未暴露的,或者仍可以是一种高效的挽救策略。
多次复发和五重难治性多发性骨髓瘤的治疗
三类难治定义为对 IMiD、PI 和抗 CD38 mAb难治,五重难治(penta-refractory)定义为对2 种 IMiDs、2 种 PIs 和抗 CD38 mAb难治,六重难治(Hexa-refractory)定义为对 BCMA 或 GPRC5D难治的五重难治性 MM 患者,七重难治(hepta-refractory)定义为对 BCMA和GPRC5D均难治的五重难治性 MM 患者。这些患者面临着治疗挑战和预后不良。针对经过重度经治人群的治疗手段正在扩大,主要由免疫疗法和具有独特作用机制的药物的新组合驱动(表 3)。
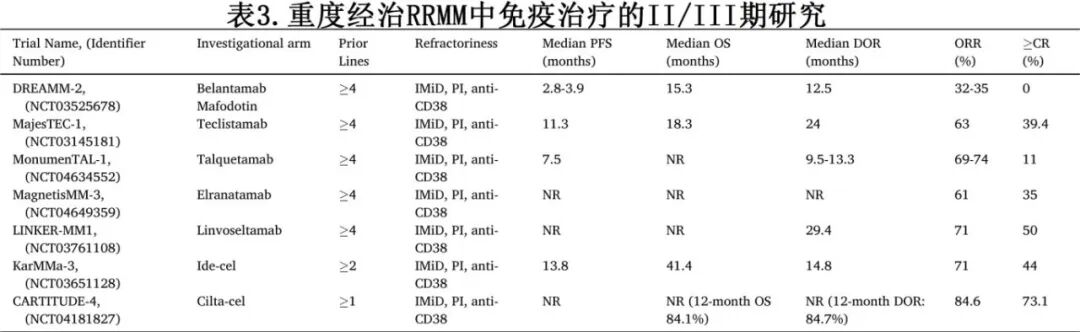
双特异性抗体(BsAbs)
能够引导 T 细胞靶向骨髓瘤细胞上 BCMA 的 BsAbs 已显示出令人印象深刻的疗效。FDA 目前在美国批准了四种药物用于四线或更多线治疗后(特立妥单抗, 塔奎妥单抗, 埃纳妥单抗和 linvoseltamab)。
在针对经过多线治疗患者的关键试验中,这些药物的 ORR 达到 61-71%。特立妥单抗 在 MajesTEC-1 研究中实现63% 的 ORR,中位 DOR 为 18.4 个月。埃纳妥单抗在 MagnetisMM-3 试验中显示出 61% 的 ORR,而 linvoseltamab 在 LINKER-MM1 试验中产生了 71% 的 ORR,中位 DOR 为 29.4 个月。靶向像 GPRC5D 这样的新抗原提供了一个关键替代方案,特别是对于在 BCMA 导向治疗后复发的患者。塔奎妥单抗是一种靶向 GPRC5D 的 BsAb,在 MonumentTAL-1 研究中产生了约 74% 的 ORR。实际上,所有 BsAbs 都需要一个初始的阶梯递增给药方案,通常在医院环境中进行,以减轻药物毒性风险和严重性。关键的类别范围内的毒性包括细胞因子释放综合征(CRS)、免疫效应细胞相关神经毒性综合征(ICANS)和显著的累积感染风险,需要警惕性监测和适当的预防措施。除了这些,塔奎妥单抗还具有独特的毒性特征,包括皮肤和指甲相关不良事件、体重减轻和味觉障碍。
抗体药物偶联物(ADCs)
玛贝兰妥单抗(Belantamab mafodotin)是一种靶向 BCMA 的 ADC,最初基于 DREAMM-2 试验获得加速批准,该试验显示在经过多线治疗的患者中 ORR 为 32-35%。显著的眼部毒性(角膜病变)需要多加监测和剂量调整,也是一个关键的考虑因素。尽管其批准状态已经演变(在 DREAMM-3 验证性试验结果后在美国自愿撤回),玛贝兰妥单抗仍在继续评估,特别是在联合方案中(例如DREAMM-7, DREAMM-8),这些研究在提高疗效和减轻某些毒性方面显示出有希望的早期结果。ADCs 可能为患者提供合适的选择,并避免与 T 细胞重定向疗法相关的特定毒性,如 CRS 和 ICANS。
BCMA细胞疗法
Idecabtagene vicleucel (Ide-cel)获批用于两线或更多线既往治疗(包括 IMiD、PI 和抗 CD38 mAb)后的 RRMM,在关键 KarMMa 研究中,Ide-cel 在经过多线治疗的患者中显示出 73% 的 ORR 和 33% 的完全缓解率(CRR),中位 PFS 为 8.8 个月。来自 KarMMa-3 在早期复发(1-3 线既往治疗)中的更新数据显示 ORR 为 71%,中位 PFS 为 13.8 个月。此外,Ide-cel 组中 4% 的患者发生 3/4 级 CRS,6% 的患者观察到 3/4 级神经毒性。
Ciltacabtagene autoleucel (Cilta-cel)获批用于一线或更多线既往治疗(包括 PI 和 IMiD,且对来那度胺难治)后的 RRMM。在对来那度胺难治且接受过 1-3 线既往治疗的患者中(CARTITUDE-4),与标准治疗相比,Cilta-cel 显著改善PFS(中位未达到 vs. 11.8 个月;HR 0.26, p<0.0001),ORR 为 84.6%,CRR/严格意义的完全缓解率为 73.1%,MRD 阴性率为 60.6% vs. 15.6%。比较分析表明,在三类暴露 RRMM 中,Cilta-cel 比 Ide-cel 具有更优的临床获益。
CAR T 前的高疾病负荷是严重并发症的风险因素,短期桥接治疗常规使用,旨在安全地减少肿瘤细胞,并在几周内输注 CAR T。确定细胞疗法(包括 CAR T 细胞和双特异性抗体)的理想候选人需要仔细评估毒性特征和合并症。虽然高龄不是绝对禁忌,但由于 CRS、ICANS 和严重感染的潜在风险,应仔细筛查患者的神经、心脏和肺部合并症。没有主要合并症且东部肿瘤协作组(ECOG)评分<2 更可取。除了在采集和 BCMA CAR T 输注之间用于符合条件的、既往接受过>4 线治疗的患者的常规三药联合方案外,短暂使用塔奎妥单抗因其安全性和有效性数据而越来越受欢迎。塔奎妥单抗靶向 GPRC5D,可降低与 BCMA CAR T 细胞产品交叉耐药的风险,因此特别适合作为桥接治疗。两种 CAR T 疗法都与显著、可控的毒性相关,主要是 CRS 和 ICANS,需要警惕性监测和及时干预。
血液学毒性也很常见。真实世界数据和观察性比较继续完善对它们相对疗效和最佳顺序的理解。密切的患者监测(通常在治疗中心输注后至少四周)对于管理潜在不良事件至关重要。最后,感染的预防措施和及时管理至关重要。在 CAR T 细胞治疗后至少六个月内应避免活疫苗,并根据免疫重建情况可能更长时间。
在 CAR T 细胞疗法和双特异性抗体之间选择
关于如何为患者选择 CAR T 细胞疗法还是双特异性抗体,取决于多种因素,例如患者偏好、疾病动态和 FDA 批准(BsAbs 仅批准用于>4 线既往治疗)。CAR T 有可能实现无治疗间隔(一次输注和监测),而 BsAbs 最初需要每周或每两周给药一次。使用 CAR T 细胞需要稳定的疾病动态,以便患者能够安全地接受 CAR T 评估、单采并等待制造,可能需要 3-6 周。另一方面,BsAbs 是现成的,但需要在医院进行初始阶梯递增给药。两组也存在独特的毒性差异,例如高级别(>3 级)ICANS 和运动障碍在 CAR T 疗法中更常见。最近的一项荟萃分析显示,CAR T 细胞的汇总缓解率高于 BsAbs(ORR 83% vs. 65%;完全缓解率 54% vs. 35%),但与较高的严重 CRS、ICANS 和血细胞减少发生率相关。如果两种疗法都获得批准且可用,则年轻、健康、愿意接受毒性特征并能安全等待细胞制造的患者优先接受 CAR T 而非 BsAb 选项,而 BsAbs 在 CAR T 复发后仍然是有效的挽救治疗选项。表 4提供了两种的比较。

其他靶向疗法和研究性方法
在具有 t(11;14) 易位的患者中,BCL-2 抑制剂维奈克拉(VEN) 已显示出显著的临床活性,无论是作为单药治疗还是联合治疗(例如,与地塞米松或硼替佐米)。虽然未经 FDA 特别批准用于无此易位的 RRMM,但对于 t(11;14) 阳性 MM 有特殊考虑(在该人群中 ORR 从 21% 增加到 40%)。然而,BELLINI 试验强调了患者选择的重要性,在该试验中,维奈克拉加入硼替佐米-地塞米松用于未经选择的 RRMM 人群,尽管改善了 PFS,但导致感染相关死亡率增加,特别是在非 t(11;14) 患者中。正在进行的试验探索 VEN 与其他药物的联合(NCT02899052, NCT03539744, NCT03567616, NCT03732703)。
参与临床试验仍然至关重要。新兴药物包括新型 CELMoDs(例如,iberdomide, mezigdomide)、针对不同抗原的其他 BsAb 结构(例如,FcRH5-cevostamab)、三特异性抗体(CD3/BCMA/GPRC5D 和 CD3/BCMA/CD38)以及创新的组合策略。如果先前未使用过,基于塞利尼索的方案也可以考虑(特别是 SVd,基于 BOSTON 试验数据),即使在后期治疗线中也是如此。
抗BCMA治疗后进展的六重和七重难治性MM的治疗
在新诊断MM中四药诱导治疗的日益广泛应用、CAR T细胞在早期复发环境中的使用以及BsAbs的可及性,导致了一个独特的临床挑战的重现——管理对多种药物和联合治疗复发或难治的患者。了解耐药机制和可用的挽救方案对于这个不断增长的患者群体至关重要。
对BCMA靶向治疗的耐药是多方面的,涉及诸如抗原逃逸等机制,这是由于骨髓瘤细胞上BCMA表达丢失或显著下调,无论是纯合子还是杂合子基因缺失或突变,使它们对BCMA靶向药物不太敏感。另一个因素是通过CAR T细胞耗竭、有限持久性或向肿瘤部位运输受损导致的耐药。最后,免疫抑制性肿瘤微环境也可能阻碍免疫疗法(包括CAR T细胞和BsAbs)的疗效。BCMA靶向药物失败后的治疗选择取决于几个因素,包括所使用的具体疗法、复发时间、耐药机制、既往药物暴露史、既往暴露时间以及患者健康状况。重要的是,新兴证据表明,重新使用BCMA靶向疗法可能仍能提供临床获益。患者可能对同一类别内的不同药物(例如,CAR T细胞失败后使用BsAb)产生反应,甚至可能对同一模式进行再治疗,特别是在初始缓解持久的情况下。例如,CARTITUDE-2试验显示,在既往接受过BCMA靶向治疗后,cilta-cel导致的ORR为60%,其中35%的患者达到MRD阴性。与之类似,特立妥单抗在既往有BCMA疗法暴露的患者中产生52.2%的ORR,从而突显了并非所有耐药都是由于永久性抗原丢失。除了BCMA再挑战之外,针对该人群的关键策略包括转向靶向不同抗原的疗法(例如,GPRC5D)或使用新型结构,如双靶向CAR T细胞(例如,BCMA/CD19),这些在该难治环境中显示出疗效(NCT03672253)。参与探索这些下一代免疫疗法的临床试验对于该患者群体仍然至关重要。
指导治疗选择的关键因素
RRMM中最佳治疗策略的选择是一个细致、多方面的过程,需要一种个性化的方法,仔细平衡治疗效果、潜在毒性和个体患者情况。几个相互关联的因素指导着这一关键的决策连续体。
患者相关因素
患者的生理状态和合并症深刻地影响治疗选择和耐受性。
年龄和衰弱:实际年龄虽然是一个考虑因素,但通常不如生理年龄和衰弱状态重要。由于年龄相关的生理衰退,老年人可能表现出对药物相关毒性的易感性增加,需要个体化的、可能剂量调整的治疗计划,以在保持生活质量的同时优化结局。通过正式评估(如IMWG衰弱指数)确定的衰弱患者,通常受益于强度较低的方案,以最小化不良事件。
合并症:既存状况显著影响方案选择。例如,心脏合并症(例如,心力衰竭)需要谨慎使用已知具有心脏毒性的药物,如卡非佐米。与之类似,MM中常见的肾功能损害可能需要调整药物剂量(如来那度胺)或倾向于具有更好肾脏安全性特征的方案(例如,基于硼替佐米的方案)。既存周围神经病变可能使临床医生远离神经毒性药物(如硼替佐米),如果存在替代方案的话。
体能状态:ECOG或Karnofsky体能状态评分对于评估患者的整体健康状况、告知治疗资格、强度以及提供预后见解至关重要。
疾病相关特征
骨髓瘤的生物学特征和行为在指导治疗中起着关键作用。
细胞遗传学异常:高危细胞遗传学与侵袭性疾病和较差预后相关,通常需要在复发过程中更早考虑高效的新型疗法,如CAR T细胞或双特异性抗体。相反,存在t(11;14) 可识别出可能受益于维奈克拉为基础方案的患者。
复发性质:复发本身的特征,包括其时机(相对于既往治疗的早期 vs. 晚期)、速度(惰性 vs. 侵袭性)和是否存在髓外疾病,都会显著影响干预的紧迫性和类型。侵袭性复发可能需要通过强化治疗组合进行快速肿瘤细胞减灭。塔奎妥单抗联合特立妥单抗在 RRMM 的1b/2 期临床试验(NCT04586426),即 RedirectT-1 试验中显示出高缓解率和可控的安全性,该试验纳入经过多线治疗的患者(中位 4 线既往治疗;86% 为三类难治,36% 有髓外疾病)。所有剂量水平的 ORR 为 78%,≥CR 率为 48%。在推荐的 2 期方案(RP2R)下,ORR 为 80%,≥CR 率为 52%。这些结果支持该组合的进一步研究,特别是考虑到在晚期、难治性疾病患者以及有髓外受累的患者(历史上结局较差的人群)中的高缓解率。
既往治疗史和治疗相关因素
(图 2)突出了基于既往治疗选择方案。患者的治疗历程和可用疗法的特征是治疗结局的关键决定因素。
既往疗法和难治性:考虑既往方案的类型、数量和顺序,以及患者对它们的反应和 DOR 至关重要。对特定药物类别的难治性(例如,对来那度胺难治、三重类别难治)直接决定了后续选择,通常需要转向具有不同作用机制的药物。如果在完成同一方案后超过六个月复发,重新使用同一方案可能是一个选项,但对于早期或侵袭性复发,通常首选替代的新药。
方案特征和患者偏好:潜在方案的安全性特征,包括常见和严重不良事件,必须与其疗效进行权衡。实际方面,如给药途径(口服 vs. 静脉/皮下)、随访频率、经济负担以及对生活质量的总体影响,也显著影响治疗选择,应在与患者讨论中做出决定。虽然实现深度缓解是一个目标,但“少即是多”的辩论承认,过度侵袭性的治疗有时会在没有相应获益的情况下降低生活质量,特别是在经过多线治疗或衰弱的患者中。 最终,治疗目标应与控制疾病同时优化患者整体福祉相一致,同时也要考虑他们的偏好、获得治疗的机会和治疗成本。
超越生存:定义有意义的治疗终点
虽然 PFS 和 OS 仍然是监管批准的金标准,但通过二代测序或流式细胞术评估的 MRD 阴性也已成为延长生存期的强大预后替代指标。在 RRMM 环境中,达到 MRD 阴性 越来越成为治疗目标,因为它标志着可能转化为更长无进展间隔和更好生活质量的缓解深度。此外,在经过多线治疗的人群中,目标可能转向减轻症状、维持独立性和生活质量措施作为关键终点。对于一些患者来说,最终(但仍难以实现)的目标是“功能性治愈”,定义为停止治疗期间的持续深度缓解,这是一个通过强效免疫疗法正逐步实现的概念。
新型疗法的实际负担:成本、便利性和生活质量
免疫疗法的引入是革命性的,但也带来了显著的实际挑战。CAR T 细胞和 BsAbs 的药物获取成本都很高,给患者和医疗系统带来了潜在的财务毒性。除了成本之外,后勤负担也是一个主要的考虑因素。CAR T 细胞疗法需要 FDA 强制规定的 2 周驾驶限制,要求患者及其护理者至少一个月(或根据治疗中心指南)搬迁到治疗中心附近,可能会影响就业和家庭生活。类似地,用于初始化的住院以及 BsAb 给药所需的频繁访视可能是一个显著的不便。这些因素必须是共享决策的一部分,在追求深度缓解与保持生活质量之间取得平衡。
未来考量
尽管取得了显著进展,RRMM 的管理仍然面临障碍,包括治疗耐药性的发展、管理累积毒性以及优化治疗顺序。临床试验中研究的一个关键问题在于,早期整合高效药物(如 CAR T 细胞和双特异性抗体)是否能够改变疾病的自然史,从而减少对大剂量化疗和 ASCT 的需求。细胞疗法的进步包括下一代 CAR T 细胞疗法,其努力集中在提高 CAR T 细胞的疗效、安全性和适用性上。除了 BCMA,靶向其他抗原(如 GPRC5D、CD19 和 CD38)的 CAR T 细胞也显示出巨大前景,特别是对于在 BCMA 治疗后复发的患者。GPRC5D CAR T 细胞(例如,OriCAR-017, POLARIS 研究, NCT05016778)的早期数据表明,在经过多线治疗的患者中具有高缓解率和可控的安全性。此外,为了对抗抗原逃逸,靶向双抗原(例如,BCMA/GPRC5D, BCMA/CD19, BCMA/CD38)的 CAR T 细胞正在进行中,早期研究报告了令人印象深刻的 ORR(例如,BCMA/GPRC5D 和 BCMA/CD19 结构分别为 86-92% ORR)。这种双靶向方法旨在通过多靶向和双特异性 CAR T 细胞加深缓解并预防耐药。具有新型结合域的 CAR T 细胞,例如 anticabtagene autoleucel(antio-cel,靶向不同的BCMA 表位),也可产生高效力(例如,1 期 ORR 100%,IMMagine-1 2 期 ORR 95%),并可能在 T 细胞特征或克服既往 BCMA 暴露方面提供优势。
减轻 CAR T 细胞毒性(CRS, ICANS)的策略包括结合安全开关或新型共刺激域,例如自杀基因或化学二聚体,以及结合共刺激域以微调 T 细胞活化。此外,来自健康供体 T 细胞的同种异体(“现货”)CAR T 细胞的开发旨在克服制造延迟并扩大患者可及性,有几种产品正在进行临床试验(NCT05722418, NCT04960579, NCT04093596)。临床试验正在探索将 CAR T 细胞疗法整合到新诊断或早期复发患者的早线治疗中(例如,NCT04935580),假设 T 细胞功能可能更好并导致更持久的缓解。
抗体疗法的发展包括新靶点和下一代结构。除了目前批准的靶向 BCMA 和 GPRC5D 的 BsAbs,针对其他靶点的新药正在出现,例如 FcRH5(例如,cevostamab),在经过多线治疗的患者中显示出良好疗效,包括 BCMA 治疗后的患者。Linvoseltamab (BCMAxCD3) 在关键试验中也显示出高 ORR(~71%)并正在推进。BsAbs 作为 CAR T 细胞输注前桥接治疗(以减少肿瘤负荷)或作为 CAR T 或其他侵袭性疗法后维持治疗的作用正在积极研究中。下一代ADCs也在出现。虽然玛贝兰妥单抗的发展较为复杂,但针对 BCMA(例如,AMG224, MED2228, CC-99712, HDP-101)或其他骨髓瘤表面抗原(例如,CD38, CD46, CD74)的新 ADC 正处于临床前和临床开发的不同阶段,旨在提高疗效和改善安全性。
免疫细胞因子新型药物(如 modakafusp alfa,一种靶向 CD38 的工程化干扰素-α 融合蛋白)选择性地将细胞毒性载荷或免疫激活信号递送至骨髓瘤细胞,提供了另一种免疫治疗路径,在早期试验中显示出单药活性。此外,cereblon E3 连接酶调节药物(CELMoDs),如 iberdomide 和 mezigdomide,与早期的 IMiDs 相比,在降解 Ikaros 和 Aiolos 方面表现出更高的效力。它们在对来那度胺和泊马度胺难治的患者中显示出显著活性,无论是作为单药治疗还是与地塞米松或其他药物联合,提供了克服 IMiD 耐药性的策略。
调节策略以克服免疫抑制性肿瘤微环境(TME)正在探索中,以增强免疫疗法(包括 CAR T 细胞和 BsAbs)的疗效,包括靶向调节性 T 细胞、髓源性抑制细胞或检查点通路的药物,通常与主要的抗骨髓瘤治疗联合使用。RRMM 的最终目标是实现持久、深度缓解和为更大部分患者实现功能性治愈。未来的进展可能取决于使用先进生物标志物改进风险分层、合理设计配对新药的协同组合疗法,以及在整个疾病过程中优化治疗排序。前所未有的创新速度为将 RRMM 从一种无法治愈的疾病转变为一种可以长期管理并保持生活质量的疾病提供了巨大希望,从而为更多患者带来治愈策略。
实践要点
采用针对每位 RRMM 患者的个性化治疗方法,考虑患者因素(年龄、衰弱、合并症)、疾病生物学(细胞遗传学、侵袭性)和既往治疗暴露,可提高疗效并降低发病率。
基于 III 期试验证据证明疗效更好,在首次复发管理中优先考虑包含抗 CD38 单克隆抗体(例如,DPd, DVd, DKd, Isa-Kd)的三药方案。
在早期复发环境(1-3 线治疗后)中使用 CAR T 细胞疗法(例如,idecabtagene vicleucel, ciltacabtagene autoleucel),特别是在来那度胺难治患者中,因为已证明具有高缓解率和持久缓解。
对于晚期复发,使用新型治疗类别,如双特异性抗体(特立妥单抗, 埃纳妥单抗, 塔奎妥单抗, linvoseltamab)和抗体药物偶联物,尤其是在三重类别难治性疾病中。
在 BCMA 靶向疗法后进展时,立即转向靶向替代抗原的疗法或评估下一代或双靶向 CAR T 细胞和新型双特异性抗体的临床试验。
采用多学科方法和共享决策框架,以平衡治疗效果与患者生活质量,整合患者偏好和实际方面,如给药途径和频率。
对特定方案相关毒性保持高度警惕(卡非佐米的心脏风险、肾功能损害考虑因素以及硼替佐米的周围神经病变), 调整方案以最小化风险并优化患者结局。
研究议程
研究新的治疗组合以增强当前免疫疗法的疗效。
评估对 BCMA 靶向疗法耐药的机制,包括抗原逃逸、CAR T 细胞耗竭和免疫抑制性肿瘤微环境,以指导下一代疗法的开发。
研究多靶向 CAR T 细胞和双特异性抗体的临床疗效和安全性, 尤其是靶向替代抗原(如 GPRC5D, SLAMF7,和 FCRH5)的疗法。
探索增强 CAR T 细胞持久性和运输的策略,包括新型共刺激域、创新结构和装甲CAR T 细胞。
对各种 CAR T 细胞产品(例如,idecabtagene vicleucel vs. ciltacabtagene autoleucel)的疗效进行比较分析,以优化患者特异性治疗选择和治疗框架的排序。
扩大对下一代 CELMoDs(例如,iberdomide, mezigdomide)在难治人群中的研究,以阐明克服 IMiD 耐药的机制。
研究双特异性抗体和新型ADCs在更早治疗线中、作为桥接疗法、或作为强效干预(如 CAR T 细胞疗法或干细胞移植)后维持方案的应用。
开发用于个性化治疗排序和反应预测的预测性生物标志物,重点关注细胞遗传学风险分析、微小残留病(MRD)和免疫反应特征。
研究旨在调节免疫抑制性肿瘤微环境以增强当前免疫疗法疗效的治疗组合。
参考文献
Ali Mushtaq et al., Blood Reviews, https://doi.org/10.1016/j.blre.2025.101339
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)