首页 > 医疗资讯/ 正文
套细胞淋巴瘤(MCL)是一种较为罕见的B细胞淋巴瘤亚型,男性发病率更高,确诊时的中位年龄为70岁。MCL的临床表现具有异质性,从惰性到高度侵袭性不一,与其生物学危险因素(如增殖率和TP53突变)密切相关。多数患者初诊时已为播散性疾病,需全身治疗。
传统上,免疫化疗是主要治疗手段,但最新数据显示,加入新型药物可显著改善年轻及老年患者的预后,尤其是共价BTK抑制剂(cBTKi),尽管尚未证实可治愈。对于老年患者,标准治疗仍是免疫化疗(如利妥昔单抗联合苯达莫司汀),但非化疗方案(如利妥昔单抗联合cBTKi)也可能对其构成挑战。复发/难治患者的治疗选择也在迅速发展,包括CAR-T细胞疗法、新型BTK靶向药物、BCL2抑制剂及T细胞衔接器等。
EHA指南委员会和欧洲MCL网络基于最新证据,近日发表了MCL的临床实践指南,为MCL的诊断、分期、治疗及随访提供基于现有证据的推荐。

发病率和流行病学
套细胞淋巴瘤(MCL)是一种不常见的 B 细胞淋巴瘤类型,约占所有淋巴瘤的 2%-10%,其病因仍未完全明确,但环境因素和感染被认为是潜在的风险因素。诊断时的中位年龄约为 70 岁,男性占主导地位,比例约为 3:1。欧洲的平均年年龄调整发病率估计为 0.45/10 万人/年,但在北欧则>1/10 万。在美国,白人的发病率(0.6/10万)略高于黑人和亚洲人(约 0.3/10万)。
由于更有效的免疫化疗(ICT)方案的出现,在过去的几十年里,MCL 的总生存率显著提高。对于 2000 年至 2020 年间接受治疗的 MCL 患者,合并年龄组的 5 年和 10 年生存率分别为 58% 和 32%。近年来,新型靶向药物和 T 细胞重定向疗法进一步推动了治疗格局的发展,它们对基于人群研究的生存趋势的影响仍有待未来证实。
诊断、病理学和分子生物学
MCL 的诊断应根据当前淋巴瘤分类标准进行。
大多数肿瘤具有经典的形态学特征,即中小型细胞,核不规则,可能以套区、结节状或弥漫性模式生长。然而恶性淋巴细胞也可能存在一系列形态学变异,包括小圆形(类似于慢性淋巴细胞白血病)、边缘区样和多形性/母细胞样细胞。MCL 的诊断需要成熟的 B 细胞表型,通常共表达 CD5,并有 Cyclin D1 表达和/或 CCND1 重排。SOX11 在常规 MCL(cMCL)中表达;检测到SOX11也可能识别出罕见的 Cyclin D1 阴性 MCL,这些病例携带 CCND2 或 CCND3 重排。大多数 cMCL 的 IGHV 与种系序列具有高度一致性(≥97%)。
也有一种白血病性非淋巴结性 MCL(leukemic nonnodal MCL nnMCL)亚型,伴有骨髓受累和频繁的脾肿大。这些病例 SOX11 阴性(<10%),携带高水平的 IGHV 体细胞超突变(>3%),并且通常遵循更惰性的临床病程。尽管在大多数肿瘤中,SOX11 表达和 IGHV 突变状态可以区分常规和非淋巴结性 MCL,但有些病例的这些参数可能处于临界值,cMCL 和 nnMCL 之间的区分可能有困难。
MCL 中的高危组织学特征为母细胞样/多形性形态和高 Ki-67 阳性细胞数(≥30%)。已经提出了一种标准化的 Ki-67 定量方法,并提出了两个临界值。欧洲学者认为 ≥30% 会导致较差的预后,而美国学者则认为 ≥50%。在骨髓中评估 Ki-67 阳性的可靠性较差,不推荐用于预后判断。TP53 突变和 17p 缺失存在于 10%-15% 的 cMCL 和 25% 的 nnMCL 中。它们与极为不良预后的关联支持在所有患者中进行检测,最好在诊断时进行。TP53 突变的类型可能影响预后,但尚未得到充分研究。DNA 测序优于 p53 过表达的免疫组织化学检测来识别突变,因为高达 30% 的突变是截短突变,可能无法通过免疫组织化学检测到。此外,高增殖性 MCL 也可能在没有基因突变的情况下过表达 p53。如果只能通过 IHC 检测 p53 表达,则应使用 ≥50% 的临界值来表示阳性。如果可能,应在复发时重新评估 TP53 异常和 Ki-67。
基因组复杂性增加、CDKN2A 缺失、MYC 易位和其他基因组改变也与不良预后相关,但这些信息尚不足以用于常规临床决策。BTK、PLCG2、CARD11 和 BCL2 突变是某些患者对特定靶向治疗的耐药机制。
CCND1 重排和 Cyclin D1 表达并非 MCL 独有,也可能在某些多发性骨髓瘤病例中,以及少数原发性和转化型弥漫性大 B 细胞淋巴瘤(DLBCL)中检测到。支持诊断为伴有 CCND1 重排的 DLBCL (而非多形性 MCL )的数据包括:先前存在克隆相关的小 B 细胞淋巴瘤、CD5 和 SOX11 阴性、伴随 BCL6、BCL2 或 IRF4 重排,或与 DLBCL 一致的突变谱。
MCL 的诊断理想上应基于手术标本,最好是淋巴结切除活检,仅在无法轻易触及淋巴结的患者中进行核心针穿刺活检。在仅有白血病表现的患者中,诊断可以在骨髓(BM)活检或外周血中通过额外的诊断参数(免疫表型和 t(11;14) 易位)确定。细针抽吸不适用。建议对复发疾病进行再次活检。MCL 的诊断应由血液病理学专家审核。如果可能,应新鲜冷冻保存额外的活检材料,以便进行额外的分子分析。
建议
•如果可行,MCL 的诊断应基于切除活检 [V, A]。
• 应在诊断时进行 TP53 突变分析 [IV, A]。
• 当需要新治疗时,尽可能进行重复活检(推荐进行 Ki-67 和 TP53 突变分析;否则的话,应通过 IHC 测定 p53 表达)[IV, B]。
分期和风险评估
MCL 最常表现为 IV 期疾病。初始检查应包括颈部、胸部、腹部和骨盆的计算机断层扫描(CT)、骨髓穿刺(包括流式细胞术)和环钻活检。正电子发射断层扫描(PET)-CT 可提供额外的分期信息,特别推荐用于罕见的局限期 I/II 期 MCL 病例。在这些病例中,还应进行胃肠道内镜检查以排除无症状的胃肠道(GI)受累,GI受累在相当一部分患者中存在。与某些其他类型的淋巴瘤不同,目前的证据表明,PET-CT 在识别骨髓和胃肠道受累方面不够敏感,无法免除活检和内镜检查的需要。对于骨髓,能够检测 10−4至 10-6水平的骨髓和/或血液浸润的高灵敏度微小残留病(MRD)检测分子技术目前已用于临床试验,并具有预后意义,但迄今为止尚未在常规临床实践中采用。但有一个例外,就是可以考虑在诱导后采用 MRD 指导治疗决策。
中枢神经系统(CNS)受累在诊断时无症状患者中很少见(<1%),因此在没有神经系统症状的情况下,不建议在诊断时进行常规腰椎穿刺。重要的是进行人类免疫缺陷病毒(HIV)以及乙型和丙型肝炎的筛查检测,因为阳性结果对同时使用抗病毒治疗有影响。还可能需要进行额外的检查来评估治疗相关并发症的风险,例如,在开始 BTK 抑制剂治疗或含蒽环类药物方案前进行心脏评估。
MCL 预后的标准风险分类是 MCL 国际预后指数(MIPI),其使用四个临床特征:年龄、体能状态、血清 LDH 水平和白细胞计数。Ki67 与 MIPI 的结合称为"联合" MIPI(c-MIPI)。
建议
MCL 的常规分期包括颈部、胸部、腹部和骨盆的计算机断层扫描(CT)、骨髓穿刺和活检 [V, A]。
对于疑似局限期 I-II 期疾病,推荐进行PET-CT 和胃肠道内镜检查 [V, B]。
新诊断疾病的管理
MCL 的惰性临床表现
尽管文献中的定义各不相同,但"惰性" MCL 通常以白血病表现、SOX11 阴性和低增殖指数(Ki-67)为特征,尽管也认识到一种惰性的"MALT 样"形式,主要是结外疾病,同样具有低 Ki67% 和经典形态。近年来的实践已经从治疗所有诊断时的患者发展到识别出可能适合主动观察的患者。直到最近,MCL 的临床试验并未单独研究亚组。
最近的前瞻性英国 MCL 生物库结果表明,超过三分之一(38%,222/588)的诊断患者可以接受观察,这组患者的初始治疗中位时间约为 21 个月,并且超过一半的观察患者在 2 年随访期内未接受治疗,且对患者的长期生存没有明显的不利影响。
来自 MD 安德森癌症中心西班牙和北欧小组及最近的 ENRICH III 期研究的非随机 II 期数据显示,低危疾病且通常具有惰性特征的患者,使用 BTK 抑制剂和抗 CD20 单克隆抗体治疗可以获得优异的疾病控制和生存结局。正在进行的随机试验正在评估 BTK 抑制剂和抗 CD20 单克隆抗体与观察在惰性 MCL 中的早期干预(NCT05635162)。
建议
可以采用观察等待策略管理无症状、具有低危特征的 MCL 患者,应初始每 3 个月监测一次,然后每 3-6 个月通过体格检查、影像学检查(根据临床需要)、血细胞计数和生化检查(包括 LDH)进行监测 [V, B]。
仅在前瞻性临床试验的背景下进行靶向治疗的早期干预 [II, C]。
在临床进展时应按如下所述开始治疗,如同其他 MCL [V, B]。
局限期疾病
局限期(I-II 期)MCL 很罕见,占所有新诊断病例的 5%-15%。
需要进行彻底的分期评估,包括 PET-CT、BM活检和内镜检查,如果计划采用局部治疗策略,则这一点尤其重要,因为隐匿性 BM 和胃肠道受累很常见。
一线治疗尚未明确界定。低危患者可以考虑观察。受累部位放疗(24-36 Gy)与高缓解率相关,并且缓解持久,尽管主要是在 I 期疾病和低危 MIPI 组。对于中危/中等肿瘤负荷的患者,可以考虑缩短的全身治疗,然后进行放疗。对于 II 期、大包块和/或高危 MIPI 患者,全身治疗可能导致更好的长期疾病控制,但治愈仍然难以实现(图 1)。尽管前瞻性证据很少,但作者建议具有高危生物学特征(母细胞样形态、Ki67 > 30%、TP53 突变/缺失)的患者应按照晚期疾病接受全身治疗。
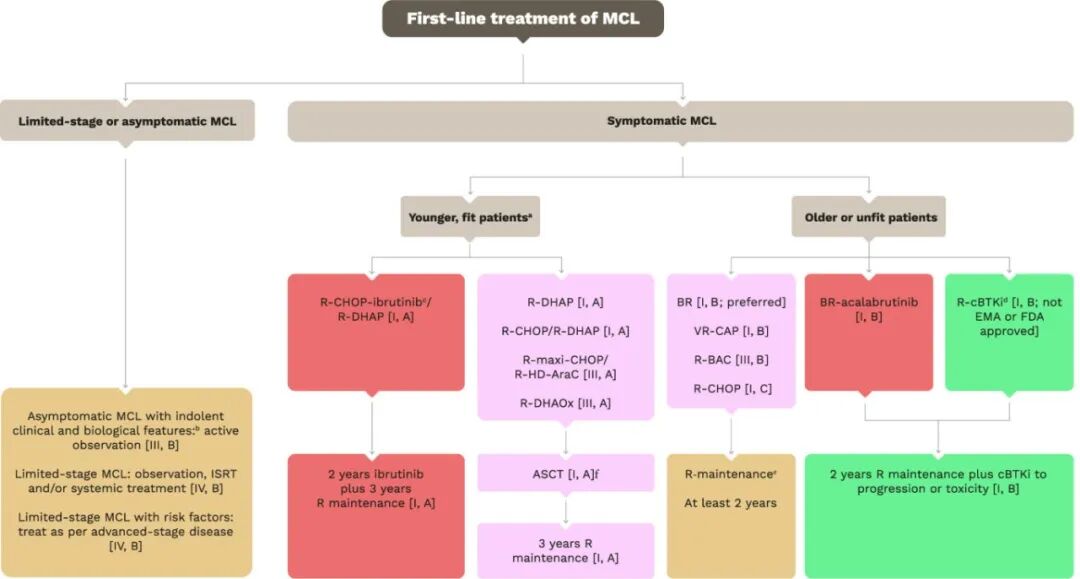
图1.MCL的一线治疗
a 年龄≤70岁的患者,由医生酌情决定。首选含cBTKi的一线治疗方案。
b 通常指白血病样或淋巴结型MCL,淋巴结≤3 cm,Ki67≤30%,形态为经典型或小细胞型,无血细胞减少或器官受累。
c 一线伊布替尼尚未获得FDA批准;其他cBTKi可根据可及性和偏好选用。
d 随机试验证据仅支持R–伊布替尼方案,但泽布替尼和阿可替尼联合抗CD20治疗正在研究中,可作为合理替代方案。
e R-BAC方案后无使用指征。
f 若采用clonoSEQ检测MRD达10⁻⁶阴性,可省略ASCT [I, A]。
建议
疑似局限期疾病应使用 PET-CT、BM 活检和胃镜/结肠镜及胃肠道活检进行分期 [II, B]。
在低危疾病(I 期,无风险因素)中,可以提供观察或 ISRT [II, B]。
对于中危/中等肿瘤负荷的患者,可以考虑缩短的全身治疗,然后进行放疗 [IV, B]。
对于具有高危特征的 II 期疾病,推荐按照晚期疾病进行全身治疗 [IV, B]。
晚期疾病
年轻患者
大多数针对该人群的试验纳入 65 岁以下的患者,但建议>65 岁的适合患者也按照图1治疗。在各种随机 III 期研究中,包含利妥昔单抗和阿糖胞苷的剂量强化诱导方案序贯大高剂量巩固方案和自体干细胞移植(ASCT),可实现长期缓解,因此直到最近仍是年轻和fit患者的标准治疗(表 1)。此外,ASCT 后 3 年的利妥昔单抗维持治疗进一步改善了无进展生存期(PFS),并且在数值上也改善了总生存期(OS)。
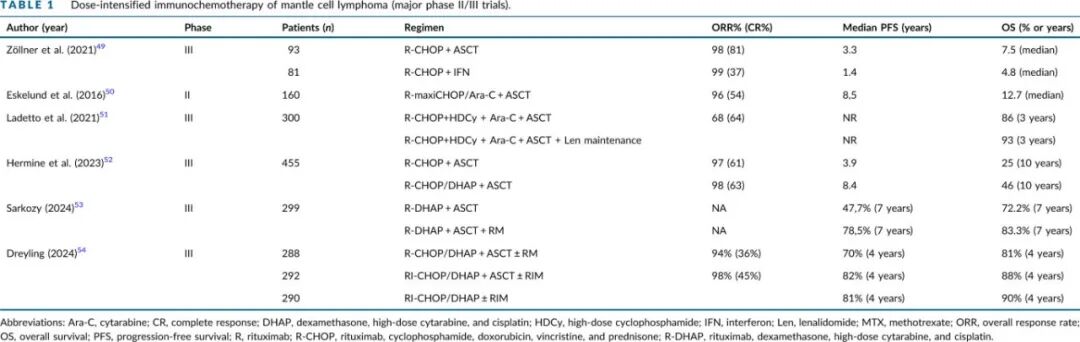
然而应注意,ASCT 的相对重要性是在常规实施大剂量阿糖胞苷诱导和利妥昔单抗维持治疗之前观察到的。在一项回顾性真实世界分析中,ASCT 与下次治疗时间(TTNT)之间没有显著关联,相反,加入利妥昔单抗维持治疗显著延长了 TTNT 和 OS。最近,在一项美国跨组试验中,对于诱导治疗(研究者选择方案)后达到 PET 定义的 CR 和深度分子缓解(x10−6)的患者,ASCT 并未改善总生存率。
III 期 TRIANGLE 试验评估了 ASCT 在一线治疗中的剩余价值。经过更长的随访,观察到在添加共价 BTK 抑制剂(cBTKi)伊布替尼(在诱导期间与 R-CHOP 一起给药,并进行 2 年维持治疗)后,(改良的)PFS 和 OS 有显著改善。有趣的是,剔除ASCT 并改用伊布替尼具有相似获益,但毒性要小得多。因此,两个伊布替尼组(+/- ASCT)在整个研究人群中产生相似的长期结局,尽管对生物学高危患者的非预设亚组分析表明添加 ASCT 可能有益。在 ASCT 后添加伊布替尼会增加相当大的感染毒性。在所有三个试验组中,添加利妥昔单抗维持治疗(无论是否联合伊布替尼)也延长了生存期。
在一项研究中,R-CHOP+伊布替尼与R-DHAP(地塞米松、阿糖胞苷、顺铂)或 R-DHAOX(其中顺铂被奥沙利铂替代)交替给药。来自法国 LyMa 试验的非随机数据表明,使用奥沙利铂的结局可能更有利,尽管 TRIANGLE 研究中很少有患者接受 R-DHAOX。
对 LyMA 和 LyMA-101 试验中患者的匹配比较(在后者中使用奥妥珠单抗替代利妥昔单抗)显示,接受奥妥珠单抗的患者 PFS 和 OS 有所改善,表明后者在 MCL 中可能是更优的 CD20 抗体。
综上所述,含 cBTKi 的方案因此代表了当前年轻、fit患者的金标准治疗。然而由于监管和报销问题,cBTKi 在欧洲各国的可用性各不相同。若伊布替尼不可用,可以合理地使用第二代 cBTKi(如果可用),但尚缺乏阿可替尼或泽布替尼的 III 期数据。
建议
年轻fit患者应接受 R-CHOP-伊布替尼/R-DHAP 或 R-DHAOX 诱导治疗,随后进行 2 年伊布替尼和 3 年利妥昔单抗维持治疗 [I, A]。
如果存在高危特征,考虑特定患者 ASCT [II, C]。
如果一线治疗中无法获得 cBTKi,可采用含利妥昔单抗和大剂量阿糖胞苷的诱导治疗和 ASCT 巩固治疗,随后进行 3 年利妥昔单抗维持治疗 [I, B]。
对于诱导后通过 NGS 检测达到分子缓解的 CR 患者,可以省略 ASCT [II, A]。
不适合剂量强化方案的患者应按照老年患者的建议进行治疗 [II, A]。
老年和虚弱患者
老年 MCL 患者通常定义为 65 岁以上的患者,以及因合并症不适合强化治疗的年轻患者,一直采用常规剂量的 ICT 方案治疗。虽然 R-CHOP 序贯利妥昔单抗维持的中位 OS 为 6.4 年,但一项随机试验表明,苯达莫司汀-利妥昔单抗(BR)诱导的 PFS 至少与R-CHOP相当,且短期毒性更好。在一项单臂 II 期试验中,BR 后利妥昔单抗维持治疗并未改善结局,但一项大型真实世界研究显示,至下次治疗时间(风险比 [HR], 1.96; 95% 置信区间 [CI], 1.61–2.38)和 OS(HR, 1.51; 95% CI, 1.19–1.92)均有显著改善,从而使其成为此情况下的标准选择。BR 后利妥昔单抗维持治疗也已在近期大型随机试验(SHINE, ECHO, ENRICH)的对照组中使用,证实了该方案的优异结局。
替代诱导方案包括利妥昔单抗-硼替佐米-环磷酰胺-多柔比星-泼尼松(VR-CAP),与 R-CHOP 相比改善了中位 PFS 和 OS(分别为 27.7 个月 vs. 14.4 个月 和 90.7 个月 vs. 55.7 个月)。该试验未应用利妥昔单抗维持治疗,并且是在常规在复发 MCL 中使用 BTK 抑制剂之前的时代开展的。尽管 VR-CAP 增加了血液学毒性、周围神经病变和胃肠道毒性,但通过缩短的硼替佐米方案(仅第 1 天和第 4 天)可能会改善这些毒性。该方案通过避免 T 细胞免疫抑制,为未来可能接受 T 细胞衔接疗法(包括 CAR-T)的候选者提供了苯达莫司汀的有用替代方案。因此,VR-CAP 序贯维持治疗可能对高危患者尤其有价值(图 1)。
BR 联合阿糖胞苷(R-BAC)在单臂 II 期试验中显示出非常高的缓解率和较长的疾病控制(7 年 PFS 和 OS 分别为 56% 和 63%),尽管代价是显著的血液学毒性。与之相反,6 个周期的 R-CHOP 与中剂量阿糖胞苷(不含顺铂)交替诱导治疗并未比 8 个周期的 R-CHOP 改善结局。在同一项随机 III 期试验中,将来那度胺加入利妥昔单抗来改善维持治疗,显示改善了 PFS(76.6 个月 vs. 60.8 个月),但未改善 OS。此外,联合维持治疗增加毒性,不推荐在一线环境中常规使用。
在老年人群中也研究了在诱导和维持治疗中加入 cBTKi。SHINE 试验评估了在 65 岁以上患者的 BR 诱导和 R 维持治疗中加入伊布替尼,显示 PFS 改善,但感染和心脏毒性增加。ECHO 试验采用类似设计,显示在 BR 中加入阿可替尼可改善 PFS,且毒性谱更可耐受,尽管随访时间较短。后者对于能够耐受的fit患者很有用。在 SHINE 和 ECHO 中,通过添加 cBTKi 均未显著改善 OS。
II/III 期 ENRICH研究评估了在 60 岁以上患者中用 cBTKi 替代化疗。R-伊布替尼(R-I)与免疫化疗(BR 和 R-CHOP)相比,改善了主要终点 PFS。与 R-CHOP 相比,PFS 显著改善,并且在中位随访超过 4 年后与 BR 相似。R-I 与较少的血液学毒性和改善的生活质量相关,使其在可用的情况下成为一个有吸引力的选择。其他 cBTKi(阿卡替尼、泽布替尼)目前也在 II 期试验中与抗 CD20 单抗 +/- 维奈克拉联合评估,显示出有希望的疗效和可接受的毒性,与年龄无关。目前,包括 cBTKi 在内的所有无化疗方案均未在一线环境中获得批准。
在非常虚弱的患者中,低剂量(2 Gy x 2)的姑息性放疗可能有效减轻症状,无论是新诊断患者还是复发患者。
建议
年龄 ≥ 65–70 岁且不适合强化治疗的患者应接受以下方案之一:
• R-化疗:选项包括 BR、VR-CAP、R-CHOP [I, B]、R-BAC [III, B]。
• BR-阿可替尼 [I, B]。
• 持续 cBTKi 联合利妥昔单抗诱导和 2 年利妥昔单抗维持治疗 [I, B]。
在以下一线诱导方案后,提供至少 2 年的利妥昔单抗维持治疗:
• BR [II, B]。
• VR-CAP [IV, B]。
• R-CHOP [I, C]。
高危疾病
高危MCL 患者通常具有高危 MIPI 评分、高 Ki67、母细胞样或多形性形态和/或 TP53 突变或 p53 过表达的特征。具有 TP53 突变的患者通常也富集其他高危临床或形态学特征。在接受 ICT 治疗的患者中,与 17p 缺失相比,TP53 突变是更主要的不良预后因素。在这些亚组中,使用抗 CD20 加 BTK 抑制剂非化疗组合的结局通常较差,并且 ENRICH 研究中少数母细胞样患者从化疗中获益多于伊布替尼-利妥昔单抗。在随机 TRIANGLE 研究的亚组分析中,对于高危肿瘤(母细胞样、高 Ki-67 或 p53 过表达)患者,接受伊布替尼 + ASCT(A+I组)的患者与 I 组(伊布替尼,但无 ASCT)患者相比,有改善结局的趋势。
对于诊断时存在 TP53 突变的患者,近期中等规模的 II 期临床试验表明,基于非化疗的三联疗法(抗 CD20、共价 BTK 抑制剂和 BCL2 抑制剂)可能比仅接受 ICT 的患者(其生存结局非常差,中位 PFS 约为 1 年)在数值上提供改善的生存结局。泽布替尼、奥妥珠单抗和维奈克拉(BoVEN)的联合方案显示出 88% 的完全缓解率和 72% 的 2 年无进展生存率。奥妥珠单抗-伊布替尼-维奈克拉也在少数 TP53 突变患者中进行了研究,并在 OASIS I 试验中显示出令人鼓舞的缓解率。意大利 FIL 小组采用了另一种方法,在标准 R-BAC 后,在高危 MCL 中添加维奈克拉作为巩固治疗,显示 2 年 PFS 为 58%。
建议
年龄≤ 70 岁且fit、伴有 p53 过表达的患者可考虑接受 R-CHOP-伊布替尼/R-DHAP/Ox 诱导 +/- ASCT,随后进行 2 年伊布替尼和 3 年利妥昔单抗维持治疗 [II, C]。
• 对于 TP53 突变患者,如果可用,考虑一线使用抗 CD20、BTK 抑制剂和 BCL2 抑制剂联合方案 [III, B]。
• 对于 TP53 突变患者,在疾病进程的所有时间点,都应考虑参加试验性新药和/或细胞疗法的前瞻性临床试验 [IV, B]。
复发/难治性MCL的管理
在每次 MCL 疾病进展时,都需要评估和考虑不同方面,以确定治疗目标并个体化选择治疗,包括疾病风险特征(早期进展时间、母细胞样组织学、Ki-67 升高、TP53 突变状态)、患者特定因素(合并症、既往治疗、毒性和患者偏好)以及治疗相关选项(疗效、起效时间、毒性、口服/静脉给药、转诊至 CAR-T 或移植中心、包括试验性临床试验在内的替代疗法的可用性、报销)(图 2)。
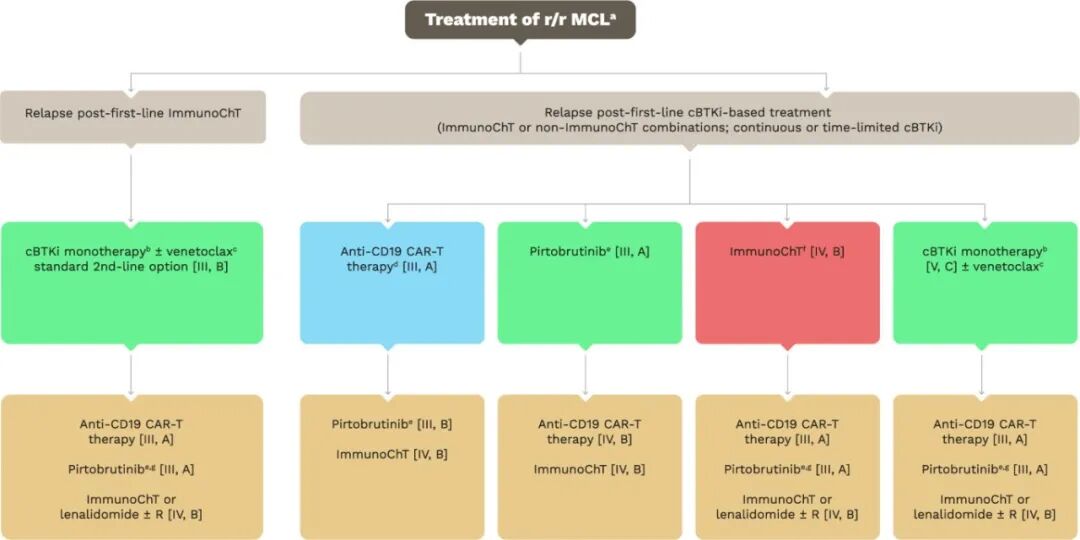
图2.复发/难治性套细胞淋巴瘤的治疗
a 对于年轻、fit的复发/难治(r/r)MCL患者,若CAR-T疗法不可及或已失败,可考虑异基因造血干细胞移植(AlloSCT)[IV, B]。
b 伊布替尼:获EMA批准,未获美国FDA批准;阿可替尼:获FDA与EMA双重批准;泽布替尼:获FDA批准,未获EMA批准。
c 伊布替尼-维奈克拉组合尚未获得EMA或FDA批准。若既往仅因不耐受停药或接受的是固定疗程cBTKi,可考虑再次挑战cBTKi。
d 若条件允许,CAR-T疗法可作为二线选择(brexucabtagene autoleucel:FDA批准用于≥1线治疗后,EMA批准用于≥2次复发;适用于高cBTKi失败风险患者)。Lisocabtagene maraleucel:FDA批准用于≥2线且含cBTKi治疗失败后,未获EMA批准。
e 匹妥布替尼:EMA批准用于≥1线治疗后,FDA批准用于≥2线治疗后。
f 免疫化疗方案的选择需综合考虑治疗目标、替代疗法可及性、既往免疫化疗暴露史、患者体能状态及个人意愿。CAR-T细胞采集前应避免使用苯达莫司汀。
g 三线治疗选择匹妥布替尼或CAR-T疗法时,应依据患者体能、疾病进展速度、患者意愿、CAR-T适用性及可及性综合决定。
ICT后复发
共价 BTK 抑制剂
cBTKi 是一线 ICT 进展后的标准治疗(表 2)。
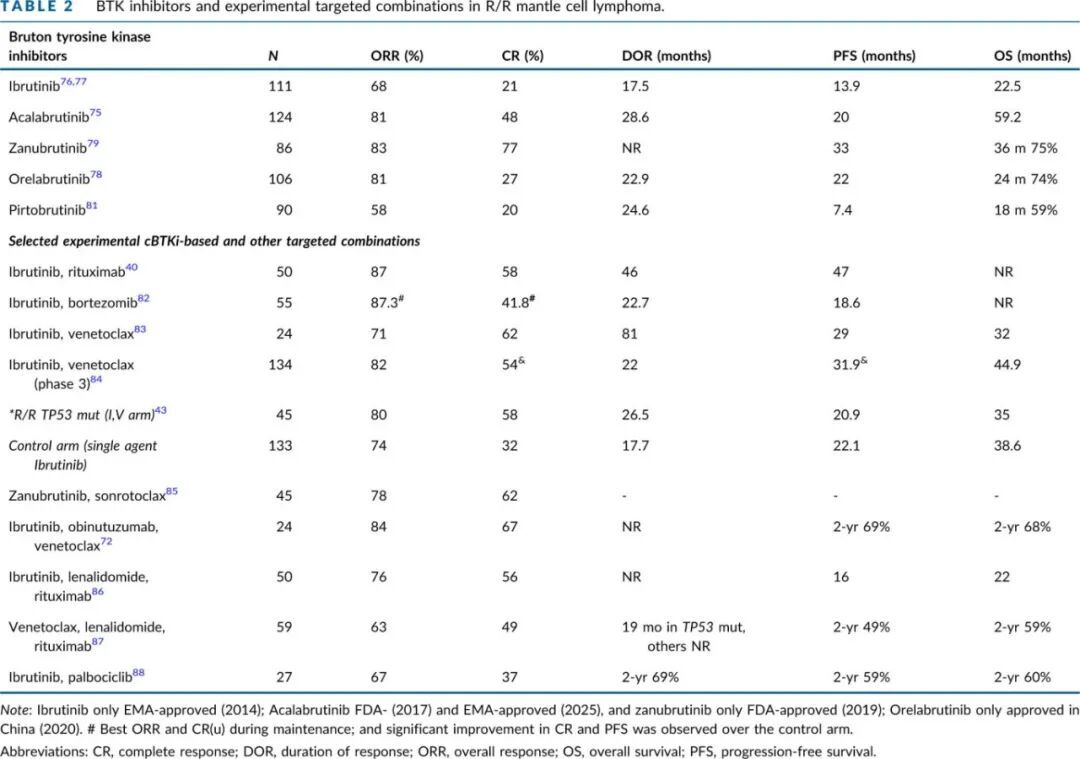
cBTKi 通常持续给药直至疾病进展或出现不可接受的毒性,但结局具有异质性:大约三分之一的患者对 cBTKi 无反应,持久的缓解主要见于达到完全缓解(CR)的患者。与 ICT 相比,伊布替尼在早期和晚期复发中均有优势,主要在首次 MCL 复发时使用时疗效更高。此外,在 CNS 受累的情况下,伊布替尼也优于其他穿透血脑屏障的方案。在回顾性研究中,因毒性导致的伊布替尼停药率在 10% 到 26% 之间。第二代 cBTKi显示出更高的特异性,导致脱靶抑制减少,与伊布替尼相比毒性降低。在 MCL 以外的组织学类型的随机研究中,阿可替尼和泽布替尼均比伊布替尼诱发更低的心房颤动、高血压和出血率。此外,cBTK 抑制剂转换可以显著改善大多数毒性病例,同时保持高度的疾病控制。
cBTKi 在具有高危生物学特征的 MCL 病例中也显示出疗效,包括母细胞样/多形性变异、高 Ki67 或 TP53 突变。然而中位 PFS 通常较短,约为 6 个月。一种简单的临床模型BTKi MIPI 可用于估算二线 cBTKi 治疗的持续时间,有助于识别可能在短时间内需要替代疗法的患者,从而避免突然停用 cBTKi 导致肿瘤反弹(flare)。
BTKi和其他无化疗联合方案
为提高伊布替尼的疗效,已探索了该药的联合治疗方案(表2)。一项随机研究84提供了其中一种最具前景且具有协同作用的组合(伊布替尼联合维奈克拉)的初步数据。伊布替尼持续给药直至疾病进展,而维奈克拉仅在前24个月内加用。与伊布替尼单药治疗相比,该联合方案显著改善了无进展生存期(PFS),尽管其毒性也更高。迄今为止,尚未检测到两组在总生存期(OS)上存在差异。此外,对TP53突变病例的亚组分析表明,该联合方案具有令人鼓舞的活性。
此外还测试了其他不含cBTKi的靶向联合方案。来那度胺联合利妥昔单抗(R2)是治疗复发或难治性MCL患者的一种耐受性良好的方案。维奈克拉–R2联合方案即使在既往暴露于BTK抑制剂的患者中也显示出合理的活性。然而与野生型病例相比,TP53突变患者的结局显著更差。
值得注意的是,几项II期探索了基于微小残留病(MRD)驱动的有限疗程靶向联合治疗,为这种方法在R/R MCL患者中的可行性提供了初步证据,显示出持续缓解甚至再次治疗的可能性。
cBTKi后复发复发
对于接受有限疗程cBTKi治疗后复发的患者,其最佳管理方案仍不确定,尽管重新使用cBTKi治疗可能会带来尚可的结局。目前尚缺乏指导MCL在此情况下治疗的前瞻性数据,应成为未来研究的重点。
相比之下,在持续cBTKi治疗期间出现MCL复发是一个日益常见的问题。直到最近,其结局仍然很差,中位OS约为8个月。常见的治疗方法包括R-BAC等化学免疫治疗方案、BCL2抑制剂维奈克拉以及来那度胺,但疗效有限。针对cBTKi暴露患者的首次显著改善出现在抗CD19 CAR-T细胞疗法brexucabtagene autoleucel。Z UMA-2的研究者在一项单臂II期研究中,主要在cBTKi暴露的MCL人群中评估了该细胞疗法。在68例cBTKi暴露的MCL患者中,ORR为91%,CR率为68%,中位PFS和OS分别为25.8个月和46.6个月。主要毒性是细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS)。在ZUMA-2研究中,≥3级CRS和ICANS的发生率分别为15%和31%,后者对于通常年龄较大且伴有合并症的MCL患者来说尤其是一个主要问题。Lisocabtagene maraleucel是另一种抗CD19 CAR-T结构,由TRANSCEND NHL001的研究者在88例MCL患者(83例为cBTKi暴露)中进行了评估。Liso-cel具有相似的ORR(83%)和CR率(72%),但具有更优的毒性特征,≥3级CRS(1%)或ICANS(9%)的发生率要低得多。
非共价、可逆性BTK(ncBTK)抑制剂是应对cBTKi治疗后MCL复发的另一种手段。此类药物中唯一获批的是匹妥布替尼,这是一种高选择性药物,旨在对C481S突变的BTK具有活性。BRUIN研究的II期MCL队列纳入了152例cBTKi暴露的MCL患者,该人群年龄(中位年龄70岁)大于CAR-T研究中的患者。其ORR(49%)和CR率(16%)低于CAR-T疗法所见;然而其安全性特征良好,除感染和中性粒细胞减少外,≥3级不良事件的发生率较低。
对于不适合CAR-T细胞疗法或在CAR-T治疗后复发的患者,或者对于疾病进展迅速、可能作为桥接CAR-T治疗手段的患者,匹妥布替尼是一个极佳的选择。其他ncBTKis正在开发中,例如nemtabrutinib,但针对cBTKi暴露MCL的详细结果仍有待公布。
CD20 × CD3 T细胞衔接抗体在此背景下展现出良好的活性。其中格菲妥单抗在61例MCL患者(其中31例曾暴露于cBTKi)中进行了评估。其ORR(74%)和CR率(71%)均很高,≥3级细胞因子释放综合征的发生率为8%。格菲妥单抗在比CAR-T疗法更简便;然而其缓解持续时间似乎也较短。格菲妥单抗在cBTKi治疗后复发MCL中的研发已进入后期阶段,一项关键的随机试验正在进行患者入组。另一种CD20 × CD3 T细胞衔接抗体莫妥珠单抗联合维泊妥珠单抗也在cBTKi治疗后显示出有前景的疗效。
BTK降解剂是通过泛素-蛋白酶体途径诱导BTK降解的异双功能分子。NX-2127和NX-5948是已在MCL中显示出初步活性的BTK降解剂,并且在一系列B细胞恶性肿瘤的cBTKi暴露患者中观察到了活性。BGB-16673是另一种在cBTKi暴露的B细胞淋巴瘤患者(包括MCL)中显示出有前景的初步活性的BTK降解剂。正在等待更大队列的更成熟结果。
ROR1在MCL中频繁表达,ROR1抗体药物偶联物zilovertamab vedotin在I期研究中纳入的17例cBTKi暴露的MCL患者中证明了其活性,ORR达到53%。
干细胞移植在R/R MCL中的作用
关于复发时自体干细胞移植的作用,近期支持性数据很少。美国移植与细胞治疗学会、国际血液与骨髓移植研究中心以及欧洲血液与骨髓移植学会联合发布了关于ASCT的作用、时机和序贯应用的共识建议。ASCT可考虑用于未在首次缓解期接受过ASCT的标危MCL患者(例如,缺乏TP53突变或双等位基因缺失的患者),以及对化疗敏感的淋巴瘤患者。ASCT在靶向治疗失败后的作用尚未有充分报道。
巩固性异基因干细胞移植仍然是fit的R/R MCL患者的重要治疗手段,尤其是携带TP53突变的患者。对324例历史上接受过减低强度预处理异基因干细胞移植患者的长期随访显示,其4年PFS率和OS率分别为31%和40%。另一项多中心回顾性研究显示,2年PFS率和OS率分别为50%和53%。此外,伴有TP53畸变的患者似乎也能从异基因干细胞移植中获益。第一项回顾性分析纳入了42例TP53突变R/R MCL患者,结果显示其2年PFS率为61%,2年OS率为78%。另一项回顾性研究报告了相似的结果,4年PFS率和OS率分别为51%和59%。
随着R/R治疗领域新型靶向疗法的出现,对于CAR-T治疗失败的患者,是否采用异基因干细胞移植应个体化讨论,需综合考虑患者的合并症、高危疾病特征和既往治疗史。异基因干细胞移植也可考虑用于部分经过筛选的、在CAR-T治疗后达到完全缓解且伴有高危特征的年轻患者。
CAR-T细胞疗法与减低强度预处理异基因干细胞移植之间的比较尚未经过前瞻性研究,但回顾性数据并未记录到一种策略相对另一种具有明确优势。
建议
对于未使用过BTK抑制剂的复发MCL患者,应提供cBTKi ± 维奈克拉作为一线免疫化疗后的标准治疗,适用于:
-
作为二线治疗(而非更晚线数),用于早期和晚期疾病进展(POD)的患者 [III, B]。
-
用于未使用过BTK抑制剂且出现中枢神经系统(CNS)复发的患者 [IV, B]。
含cBTKi的一线治疗方案之后的治疗选择包括:
-
CD19 CAR-T 疗法(适用于cBTKi治疗失败高危患者)[III, A];
-
匹妥布替尼[III, A];
-
免疫化疗 [IV, B]。
-
再次尝试使用cBTKi ± 维奈克拉,仅限于既往对cBTKi不耐受或仅接受过固定疗程cBTKi治疗的患者 [V, C]。
二线免疫化疗且含cBTKi治疗方案之后的治疗选择包括:
-
CD19 CAR-T 疗法 [III, A]。
-
匹妥布替尼[III, A]。
-
免疫化疗或来那度胺 ± 利妥昔单抗 [IV, B]。
CD19 CAR-T 疗法之后的治疗选择包括:
-
匹妥布替尼[III, B]。
-
免疫化疗 [IV, B]。
匹妥布替尼之后的治疗选择包括:
-
CD19 CAR-T 疗法 [IV, B]。
-
免疫化疗 [IV, B]。
对于年轻的、fit的复发MCL患者,在无法获得CD19 CAR-T疗法或该疗法失败的情况下,应考虑AlloSCT[IV, B]。
随访、长期影响及生存照护
对于采用"观察与等待"策略管理的、临床惰性播散性无症状患者,应通过以下方式监测:病史(包括B症状)、体格检查、血细胞计数、生化(包括LDH),以及根据临床需要进行的腹部超声或颈部、胸部、腹部和盆腔CT成像检查,频率为每3-6个月一次。
一线全身治疗后,鉴于疾病在长期随访中仍有持续复发的模式,患者通常需要终身随访。建议在治疗后头2年内,每3-4个月进行一次病史和体格检查、血细胞计数及分类计数、以及包含LDH的常规生化检查;随后3年,每6个月一次;之后每年一次。
颈部放疗后的患者应每年评估甲状腺功能(即TSH)。建议的CT或超声检查频率为:头2年内每3-6个月一次,之后至第5年每6-12个月一次,5年后仅在怀疑疾病进展时进行。PET-CT不应用于常规监测。
接受CAR-T细胞疗法治疗复发/难治性疾病的患者需要额外监测。这些患者发生晚期并发症的风险增加,尤其是感染。
CD19 CAR-T细胞疗法后获得完全缓解的患者可能出现长期B细胞再生障碍和低丙种球蛋白血症。对于低丙种球蛋白血症(血清IgG水平 <400 mg/dL)且伴有严重或反复感染(特别是鼻窦肺部感染)的患者,考虑进行免疫球蛋白替代治疗:静脉注射免疫球蛋白400–500 mg/kg,每3–4周一次;或皮下注射免疫球蛋白100–200 mg/kg,每1–2周一次。持续免疫球蛋白替代治疗直至血清IgG水平恢复正常且感染消退。
考虑使用G-CSF直至中性粒细胞绝对计数(ANC)> 500;但在CAR-T细胞疗法早期不推荐使用粒细胞-巨噬细胞集落刺激因子(GM-CSF)。
对于长期(>30天)中性粒细胞减少和/或长期使用皮质类固醇的患者,考虑使用氟喹诺酮类药物或其他替代药物进行细菌预防,如果存在高风险(长期严重中性粒细胞减少、近期接受过BMT、长期使用类固醇、使用BTK抑制剂),考虑使用氟康唑或抗霉菌活性唑类药物进行真菌预防;持续预防直至中性粒细胞减少缓解且皮质类固醇停用。
CD19 CAR-T治疗后,所有患者均应接受预防:针对疱疹病毒,使用阿昔洛韦200-400 mg口服每日两次或伐昔洛韦500 mg口服每日两次;针对耶氏肺孢子菌,使用甲氧苄啶-磺胺甲噁唑口服每周2-3次或替代药物(阿托伐醌、氨苯砜或喷他脒);预防至少持续6个月,且直至CD4计数 >200个/微升。
建议在CAR-T治疗后3个月开始接种COVID-19和流感疫苗,6个月后接种其他灭活疫苗,1年后接种活疫苗。
实验室检查应包括:每次访视时检测全血细胞计数(CBC)和LDH;CAR-T后前12个月内每次访视检测CRP、纤维蛋白原、铁蛋白;每月检测免疫球蛋白水平直至IgG >400 mg/mL,之后在CAR-T后前24个月内每3个月检测一次。
对于已知血清学阳性的CMV、EBV和HBV,应在CAR-T细胞输注后的前24个月内每3个月检测一次。如果检测到病毒载量,建议将监测频率增加至每1至4周一次。
建议
采用"观察与等待"策略管理的播散性无症状MCL患者,应每3-6个月通过体格检查、影像学检查(根据临床需要)、血细胞计数和生化检查进行监测 [V, B]。
一线全身治疗后,应每3-6个月进行一次病史和体格检查 [V, B]。鉴于疾病在长期随访中仍有持续复发的模式,随访通常不应中止 [V, D]。
应为高风险患者提供更密集的监测,因其是细胞疗法的潜在候选者 [V, B]。
对于有症状的反复感染患者,需要采取适当的预防措施(抗生素和/或IgG补充),并应考虑其既往治疗史(如CAR-T疗法、苯达莫司汀)[V, B]。应考虑接种COVID-19疫苗和年度季节性流感疫苗 [V, C]。
参考文献
Jerkeman, M., Aurer, I., Campo, E., Cheah, C.Y., Clark, J., Doorduijn, J., Eyre, T.A., Fehr, M., Giné, E., Gomes da Silva, M., Klener, P., Ladetto, M., Ribrag, V., Shpilberg, O., Walewski, J., Dreyling, M. and the EHA Guidelines Committee and the European MCL Network (2025), EHA–EU MCL network guidelines for diagnosis and treatment of mantle cell lymphoma. HemaSphere, 9: e70233. https://doi.org/10.1002/hem3.70233
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)