首页 > 医疗资讯/ 正文
摘 要
目的 分析急性坏死性纵隔炎临床特征、诊断和治疗转归,为临床诊疗提供参考。方法 回顾性分析四川大学华西医院2012年3月—2021年4月期间收治的急性坏死性纵隔炎患者的临床资料,包括病因、临床表现、影像学资料、病原学结果、手术方式及转归,分析其发病特点、临床诊疗方法及预后因素。结果 共纳入176例患者,中位年龄60(0~84)岁,男124例、女52例。最常见的感染来自颈部(66例,37.5%),最常见的临床表现是发热(85例,48.3%),脓液培养中以星座链球菌最常见(23例,13.1%)。本组患者中119例(67.6%)接受手术治疗,单纯颈部入路54例(30.7%)、单纯胸部入路27例(15.3%)[开胸9例(5.1%)、胸腔镜18例(10.2%)]、颈部+胸部入路37例(21.0%)[开胸7例(4.0%)、胸腔镜30例(17.0%)]、剑突下入路1例(0.6%)。176例患者中治愈出院144例(81.8%),死亡32例(18.1%)。多因素分析显示年龄调整后Charlson合并症指数(OR=2.95, P=0.022)、围术期存在脓毒症(OR=2.84,P=0.024)、未行外科手术引流(OR=2.41,P=0.043)是患者死亡的独立预测因素。结论 临床疑诊急性坏死性纵隔炎的患者应行影像学检查明确脓肿累及范围,以指导手术入路的选择,对于诊断明确的患者尽早行手术治疗,及时清除感染组织、充分引流。年龄调整后Charlson合并症指数、围术期存在脓毒症以及未行外科手术引流与患者的预后不良密切相关。
正 文
急性坏死性纵隔炎(acute necrotizing mediastinitis,ANM)又称纵隔脓肿,是一种累及纵隔结缔组织的严重急性感染性疾病,其病因包括颈部及胸部感染、食管穿孔、手术导致的医源性感染等,其中感染源来自口咽部、颈部的纵隔炎称为下行性坏死性纵隔炎(descending necrotizing mediastinitis,DNM)[1]。由于ANM诊断较为困难,以及对脓肿的引流不及时、不充分等原因,早期文献[2]报道中其死亡率高达49%。随着影像学检查不断发展、广谱抗生素的普及、外科手术技术及重症支持的不断进步,ANM死亡率有所下降,但依然高达11%~32%[3-5]。早期准确诊断ANM,从而针对性进行积极有效的干预,对改善患者预后尤为重要。我们回顾性分析了ANM患者的临床资料,总结分析其临床特征、危险因素及转归,以期为ANM的诊治提供参考。
1 资料与方法
1.1 临床资料和分组
从华西大数据平台(WCH-BDP)回顾性收集2012年3月—2021年4月就诊于四川大学华西医院的ANM患者临床资料[6],包括患者性别、年龄、症状、合并症、初诊时白细胞计数、围术期是否存在脓毒症、影像学纵隔受累范围、病原学结果、是否手术、重症监护室(intensive care unit,ICU)住院监护时间、总住院时间、临床转归。研究人群的合并症通过年龄调整Charlson合并症指数(age-adjusted Charlson comorbidity index,aCCI)进行量化评价[7],其基于患者所患疾病数量及严重程度,并结合患者年龄对患者合并症进行综合量化,用于预测患者死亡风险。本研究依据纳入人群aCCI的中位数,将患者分为低aCCI组和高aCCI组;根据是否行外科手术将患者分为手术组和非手术组。
1.2 诊断
ANM的诊断参考以往文献[1, 8]报道,具体诊断标准包括:(1)口咽部或颈部感染、胸腔内感染、食管异物穿孔或胸部手术病史;(2)患者存在发热、咽痛、咳嗽、胸背部疼痛等症状;(3)增强电子计算机断层摄影(computed tomography,CT)显示脂肪密度增加(>25 Hu),可见纵隔、胸腔及心包积液、脓肿形成等感染征象。脓毒症是患者对感染应激失调导致危及生命的器官功能障碍,诊断标准包括:(1)有明确的感染证据;(2)有器官功能障碍表现,序贯器官衰竭估计评分(Sequential Organ Failure Assessment Score)≥2分[9]。
1.3 治疗方法
临床诊断ANM的患者从接诊开始即经验性给予广谱抗生素(覆盖需氧菌及厌氧菌)抗感染治疗,根据病情决定收治普通病房或ICU,如合并脓毒症或需要机械通气,则收入ICU,其他患者收入普通病房。入院后继续给予抗感染治疗,并和患者家属沟通外科手术引流的必要性及风险,拒绝手术者则维持抗感染治疗并密切监测。手术适应证包括:颈胸部增强CT提示纵隔脓肿形成,其中脓肿局限于颈部及上纵隔则可通过行颈部手术进行引流,脓肿范围累及下纵隔则需行胸腔手术引流。手术禁忌证包括:患者家属拒绝手术或患者存在多器官功能衰竭、濒临死亡、无法耐受手术患者[8]。手术入路选择需结合病灶范围,由头颈外科医生与胸外科医生讨论后确定选择颈部和/或胸部入路。对于累及颈部及上纵隔的脓肿,采用颈部衣领形手术切口,充分引流并清除颈部及上纵隔感染坏死组织、反复生理盐水冲洗后于脓腔放置引流管;如脓肿累及下纵隔,则需经胸入路手术,包括后外侧开胸手术或胸腔镜手术,术中充分打开脓腔并切除部分纵隔胸膜,脓肿破溃入胸腔者一并行脓胸廓清,生理盐水反复冲洗后分别于纵隔脓腔及胸腔内放置引流管。所有患者均留取脓液作微生物培养及药敏试验,继续静脉应用广谱抗生素抗感染治疗,根据药敏结果及患者感染征象及时调整抗生素。术后转入ICU支持治疗,密切关注患者病情变化,如患者(1)出现无法解释的发热,感染指标升高等症状;(2)复查颈胸部增强CT提示纵隔再次出现局限性脓肿,则需再次行手术引流脓肿。
1.4 统计学分析
采用SPSS 22.0统计软件包建立数据库。符合正态分布的连续变量采用均数±标准差(x±s)描述,组间比较采用t检验;不符合正态分布的连续变量以中位数和上下四分位数[M(P25,P75)]描述,组间比较采用Wilcoxon Rank-sum 检验。分类变量采用百分比描述,组间比较采用χ2检验或Fisher确切概率法。患者死亡风险的危险因素使用logistic回归,将单因素分析中P≤0.10的危险因素纳入多因素分析。P≤0.05为差异有统计学意义。
1.5 伦理审查
本研究属回顾性研究,获得四川大学华西医院生物医学伦理委员会审批(No.2021-1420),免除患者知情同意。
2 结果
2.1 临床特征
共纳入176例患者,男124例(70.5%)、女52例(29.5%),中位年龄60(0~84)岁;有76例(43.1%)患者存在合并症,其中最常见的合并症是糖尿病(29例,16.5%),其次为高血压(24例,13.6%)。
感染起源于颈部66例(37.5%)、食管穿孔59例(33.5%)、牙源性感染28例(15.9%)、胸部感染9例(5.1%)、手术操作所致感染6例(3.4%)、其他病因8例(4.5%)。常见的临床症状包括发热(85例,48.3%)、吞咽困难(81例,46.0%)、咳嗽(72例,40.9%)、胸背部疼痛(65例,36.9%)、咽痛(64例,36.4%),部分患者还有呼吸困难、颈部肿胀、颈部疼痛等症状。根据影像学检查,其中上纵隔受累最多(156例,88.6%)、后纵隔次之(137例,77.8%)。分别对比手术组与非手术组患者的年龄、合并症、脓肿累及范围等临床指标。手术组与非手术组相比,手术组年龄小于非手术组(P<0.01),脓肿累及纵隔的范围(上纵隔、中纵隔、前纵隔)大于非手术组(P<0.01),转入ICU患者的比例大于非手术组(P<0.01,表1)。
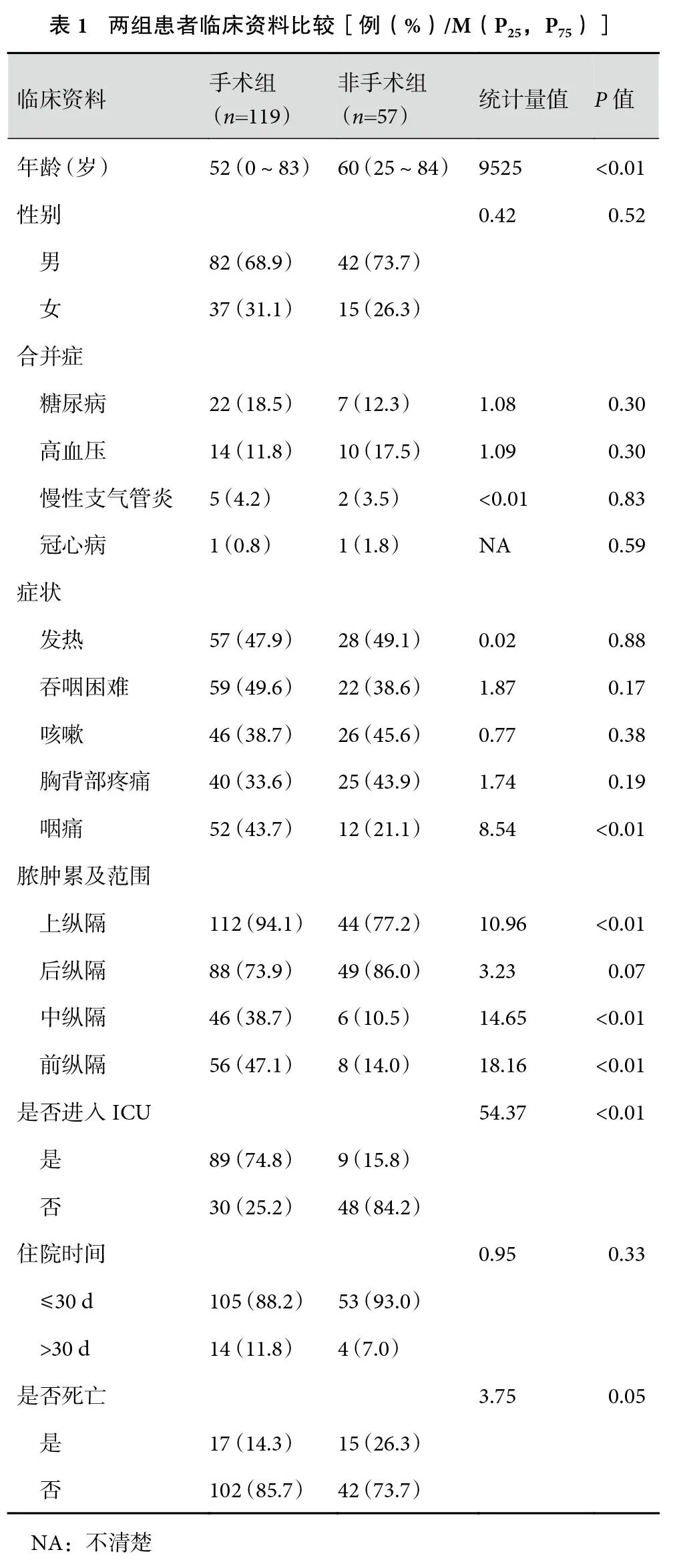
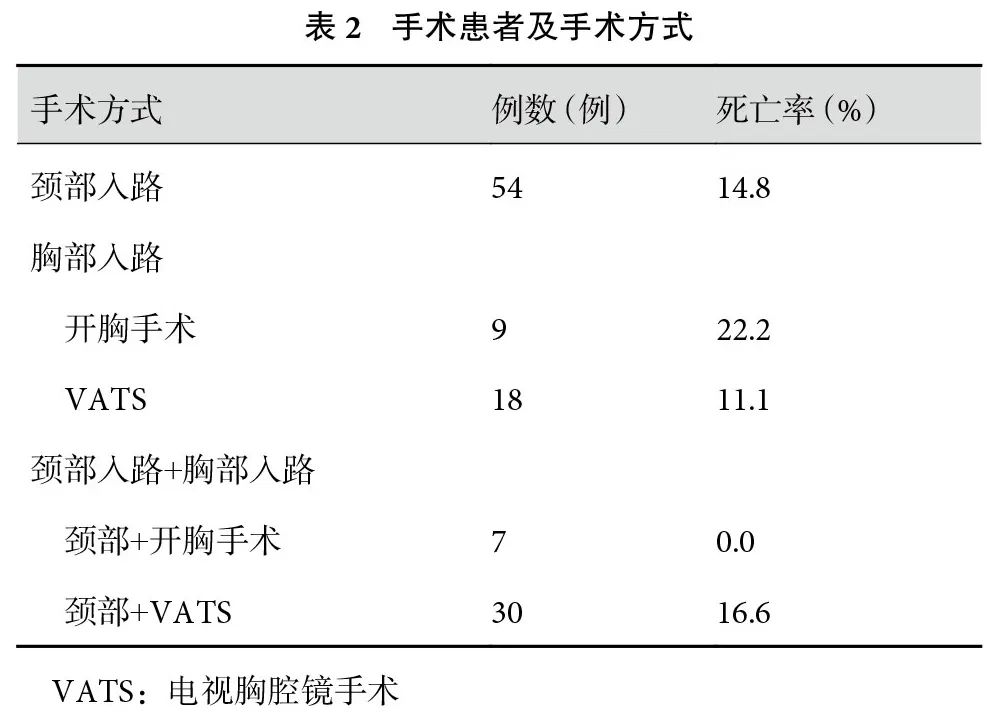
2.2 治疗方法
本研究纳入的患者中119例(67.6%)行外科手术治疗,其中单纯颈部入路54例(30.7%)、单纯胸部入路手术27例(15.3%)[开胸9例(5.1%)、胸腔镜18例(10.2%)]、颈部+胸部入路手术37例(21.0%)[开胸7例(4.0%)、胸腔镜30例(17.0%)]、剑突下入路1例(0.6%,表2)。
患者术后常见并发的问题包括肺炎(89例,50.6%)、电解质紊乱(46例,26.1%)、脓胸(25例,14.2%)、静脉血栓(25例,14.2%)。在脓液培养中,最常见的细菌包括星座链球菌(23例,13.1%)、肺炎克雷伯氏菌(14例,8.0%)、鲍曼不动杆菌(13例,7.4%)和铜绿假单胞菌(7例,4.0%),在痰培养中最常见的细菌有鲍曼不动杆菌(14例,8.0%)、肺炎克雷伯菌(8例,4.5%)、铜绿假单胞菌(7例,4.0%)、大肠埃希菌(7例,4.0%)。在分泌物培养和痰液培养中,最常见的真菌是白色念珠菌(8例,4.5%;14例,8.0%)。
2.3 临床转归
全组患者中位住院时间14(1~61)d;入住ICU 98例,ICU中位住院时间5.5(1~58)d。治愈出院144例,死亡或自动出院后死亡患者32例,死亡率18.1%。手术治疗的119例患者中有17例(14.3%)死亡,未手术的57例患者中15例(26.3%)死亡。患者的死亡原因包括感染性休克、脓肿侵及大血管导致大出血以及呼吸衰竭等,其中感染性休克是最常见的原因(表3)。治疗过程中再次行手术治疗的患者有12例,其中第一次手术仅行颈部引流的患者8例(66.7%),仅经胸腔手术的患者4例(33.3%)。这部分接受再次手术的患者中死亡5例(41.7%)。
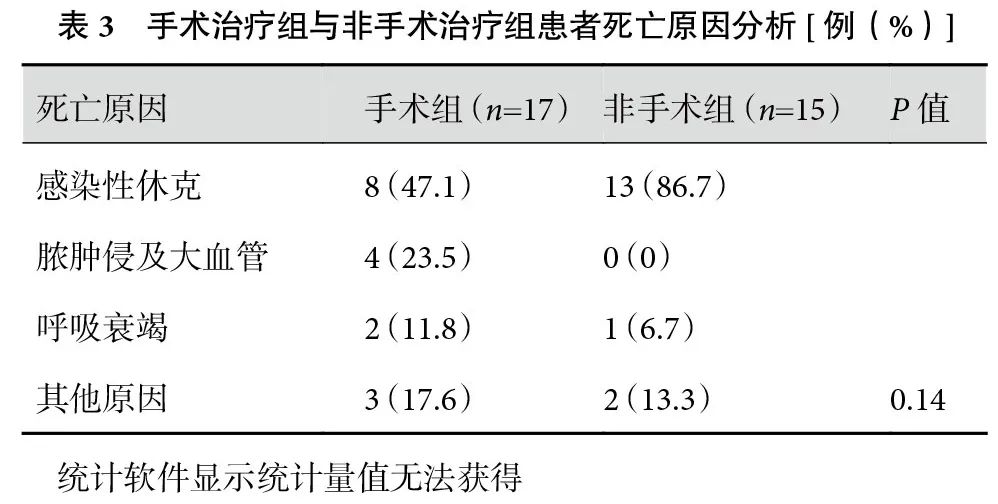
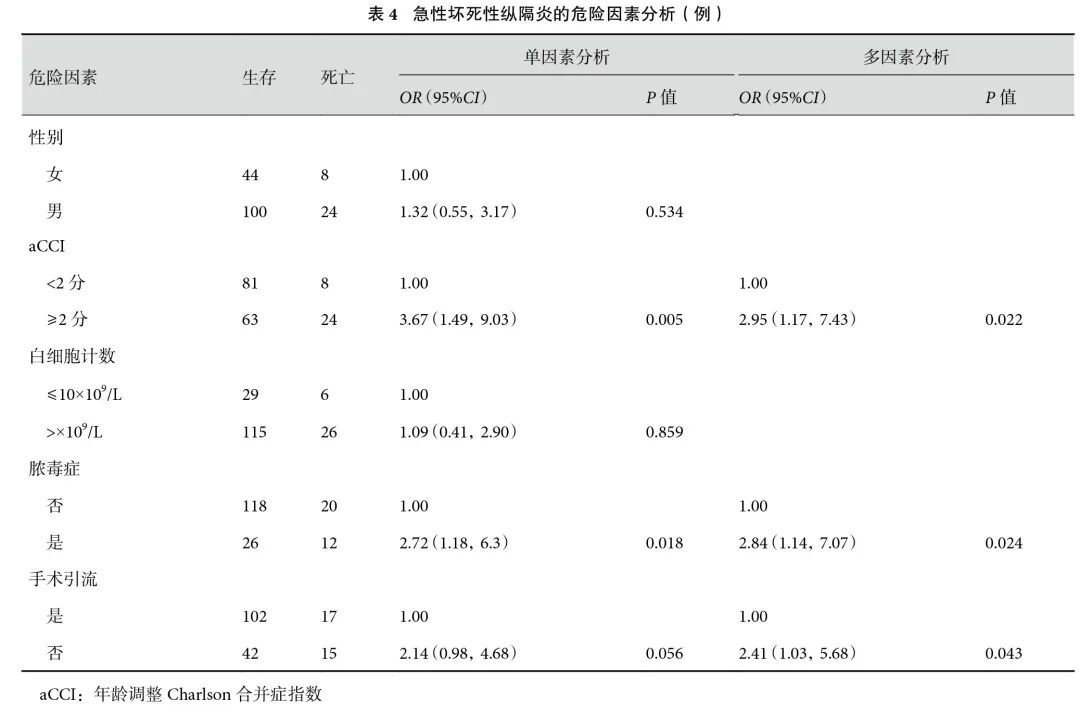
2.4 死亡相关危险因素分析
多因素分析结果显示,aCCI(OR=2.95,P=0.022)、围术期存在脓毒症(OR=2.84,P=0.024)、未行外科手术引流(OR=2.41,P=0.043)是患者死亡的独立预测因素(表4)。
3 讨论
ANM的诊断由Estrera提出,欧洲胸心协会在后续其专家共识中补充CT相关诊断细节,最终诊断标准包括:(1)口咽部或颈部感染、胸腔内感染、食管异物穿孔或胸部手术病史;(2)患者存在发热、咽痛、咳嗽、胸背部疼痛等症状;(3)增强CT显示脂肪密度增加(>25 Hu),可见纵隔、胸腔及心包积液、脓肿形成等感染征象[1, 8]。
ANM分型现普遍采用Endo提出的DNM分型并用此分型指导外科手术治疗:脓肿局限于上纵隔的患者分为Ⅰ型,脓肿局限于上纵隔和前纵隔的患者分为ⅡA型,累及整个纵隔的患者分为ⅡB型[10],Ⅰ型患者仅通过颈部手术即可达到引流效果,Ⅱ型患者则需要颈部和胸部联合手术以彻底清除脓肿。后续有其他研究者提出新的分型,但这两个分型都未能得到共识[11-12]。在治疗方面,后外侧开胸手术是最为常用的胸部术式。随着技术进步,许多研究[13-14]报道胸腔镜在清除脓肿方面的应用,有研究[15]对比胸腔镜和开胸手术的优缺点,发现胸腔镜能够取得和开胸手术相同的治疗效果,并且危重患者更加能够耐受微创的胸腔镜手术。
既往文献[3, 12, 16-18]大都聚焦于DNM,对ANM的报道较少。ANM患者有较高的死亡率,主要原因是纵隔和颈部有重要的器官以及复杂的解剖结构,其中包含疏松结缔组织和互通的间隙。在感染程度较轻时,结缔组织可将其限制在一定范围内;随着感染的加重,脓肿形成,病变可突破结缔组织和间隙快速扩散。
因此,外科医生对颈部和纵隔解剖结构的了解尤为重要[19],颈部与纵隔相联通的间隙包括:气管前间隙、颈血管鞘间隙、食管后间隙以及椎前间隙。来自咽部和下颌的感染可沿气管前间隙或颈血管鞘间隙扩散至心包,导致心包及其周围的感染。食管后间隙向上与咽后间隙相通,食管异物穿孔可通过此间隙导致后纵隔感染。来自颈部脊柱的感染可以通过椎前间隙侵入纵隔组织。食管穿孔是本研究中第二常见病因,食管的肌层外缺乏浆膜,任何尖锐的物体都可导致食管穿孔,穿孔的异物将病原菌带入颈部或纵隔结缔组织内,引发严重感染。牙源性感染是第三种常见的病因,口腔内存在厌氧菌,因此病灶来自口腔,发展至颈部及纵隔的患者,需考虑厌氧菌感染。对于因外科手术而导致感染的患者,应详细了解既往术式和术中具体情况,从而对后续内科治疗和外科手术提供指导。
早期明确诊断是降低ANM死亡率的关键。由于该病发病率较低,且早期临床表现与其他疾病相似,因此群众对ANM了解不足,警惕性不高,导致患者出现临床症状或仅表现为颈部感染,缺乏胸部特异性症状,从而就诊不及时,延误治疗时机。确诊ANM的方法包括:(1) 详细询问病史,患者是否有明确的感冒、食管异物、牙痛、手术操作等既往史,以及是否出现吞咽困难、颈部肿胀、颈部疼痛、咽痛等特征性临床表现;(2) 辅助检查中最推荐颈胸部CT,其比胸部CT层次更全面,能更好地显示病灶位置和周围组织其水肿情况。当颈胸部CT显示颈部或纵隔软组织肿胀,并且存在液体或气体时,提示纵隔脓肿形成。
在危险因素分析aCCI、围术期存在脓毒症、未行外科手术引流与患者的预后密切相关。对于高龄,同时有多种合并症的患者应仔细评估患者病情,糖尿病患者围术期应使用降糖药物,严格控制血糖,以避免血糖过高对术后伤口愈合的不良影响。对于肾功能受损的患者,应密切关注其肾功能指标,及时给予透析等支持治疗。对于既往有消化道溃疡的患者,应及时使用抑酸药物,并关注凝血指标,以避免消化道出血。
患者入院后临床诊断为ANM时,应尽早给予广谱抗生素进行抗感染治疗。在本次研究中,脓液培养结果提示患者可能感染的病原菌包括真菌、厌氧菌、革兰阳性菌和革兰阴性菌,因此除使用广谱抗生素外,还需根据病情考虑使用抗真菌和抗厌氧菌药物。对于围术期诊断为脓毒症的患者,应尽早转入ICU接受相应支持治疗。当出现脓毒性休克时,应及时给予血管活性药物,以确保机体器官的灌注[20]。
一旦确诊患者颈胸部有脓肿形成,应在患者生命体征稳定的情况下立即行外科手术清除脓肿。手术准备过程中,患者应被置于侧卧位,使用双腔气管插管,对于已行气管插管的患者,应使用封堵器进行单肺通气。外科手术治疗包括颈部入路和胸部入路。颈部入路采用衣领形手术切口,胸部入路则包括后外侧开胸手术治疗或胸腔镜治疗[21- 22],后外侧切口能将大部分纵隔纳入术野,提供良好的操作空间,是最为推荐的开胸术式。胸腔镜入路包括:在腋中线第7肋间隙做腔镜切口;第3或第4肋间隙腋前线用于操作口,第9肋间隙(腋后线与肩胛骨线之间)用于辅助切口。外科手术治疗的核心问题是仅使用颈部或胸部手术是否足以完全清除脓肿,以及如何确定颈部和胸部联合手术的适应证。根据我们的临床实践经验,通过颈部入路可以清除至隆突,当脓肿涉及下纵隔时,需要进行胸部手术来清除脓肿,这与文献[22-23]中的观点一致。术中应彻底清除感染组织,使用生理盐水和聚维酮碘进行充分冲洗,并切除感染的胸膜组织,术后需要在脓腔及胸腔中分别放置1根28-French(Fr)硅胶引流管。术后密切关注是否再次出现脓肿。如果患者出现无法解释的发热、白细胞计数以及炎症因子持续升高的症状,需要立即行CT复查。若再次出现脓肿且无法通过调整引流管进行引流,需再次进行手术引流以完全清除脓肿。
本研究具有一定局限性,首先,本研究是单中心回顾性研究,因此存在着选择偏倚;其次,ANM患者的手术都是急诊手术,在术式选择和手术操作方面可能存在不同医生之间的差异。
综上所述,对出现不明原因发热、吞咽困难或颈胸部疼痛,且有高危病史的患者,应高度警惕ANM,尽早行颈胸部增强CT检查明确是否有纵隔脓肿形成,一旦临床诊断ANM,应尽量争取机会行外科手术引流,在围术期使用广谱抗生素抗感染治疗,术后密切观察病情,必要时复查CT,评估脓肿引流效果及是否再次形成脓肿。aCCI、围术期存在脓毒症以及未行外科手术引流与患者不良预后密切相关。
利益冲突:无。
作者贡献:梁林川、彭智愚负责数据录入、统计分析、查阅文献及文章撰写;林华杭参与数据收集、文章修改;周柯参与数据整理、论文修改;梅建东负责文章总体设计、论文审阅及修改。
猜你喜欢
- Eur J Prev Cardiol:一般人群心血管疾病与痴呆风险
- CKJ:托伐普坦治疗常染色体显性多囊肾病的肝脏安全性
- 千万级中国人体检数据解读 2024:脂肪肝已成为我国最常见的慢性肝病
- 秋分已至!凉燥易伤人 防寒保暖温和拒秋冻
- 罕见病例:烧脑!这个我一度以为两肺特殊感染的多发结节病例,病情复杂程度远超想象!真相会是什么?
- JAMA子刊:胆碱酯酶抑制剂用于阿尔茨海默病和帕金森病精神症状的有效性研究
- 【AJH】CAR-T治疗转化的惰性非霍奇金淋巴瘤和De Novo侵袭性LBCL的结局对比
- 直面卒中突袭,要做的三件紧要事
- 山西医科大学康永波团队总结了益生菌和益生元治疗溃疡性结肠炎的可能机制及其前景
- 天气多变、气温骤降 专家建议:心血管病患者少出门避免感冒
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)