首页 > 医疗资讯/ 正文
肿瘤坏死因子受体超家族 8 受体 CD30 分子在霍奇金淋巴瘤和间变性大细胞淋巴瘤的所有肿瘤细胞中均有表达,但在正常外周淋巴组织中仅在一小部分大型淋巴样细胞中弱表达,这使得该分子成为诊断和治疗表达 CD30 的淋巴瘤的重要靶点。
《American Journal of Hematology》近日发表综述,描述了 CD30 分子的发现之路,以及 CD30 如何促进淋巴瘤的更精确诊断和分类。此外还探讨了抗 CD30 免疫疗法是如何开发的,以及抗 CD30- auristatin 偶联物和抗 CD30 CAR-T 细胞在治疗表达 CD30 的淋巴瘤方面的影响。

引言
CD30(TNF 受体超家族 8 受体)在许多淋巴瘤的肿瘤细胞中占主导地位且强表达,而在正常淋巴组织细胞中表达较少且低,使其成为诊断和治疗表达 CD30 的淋巴瘤的重要靶点。
将 CD30 引入免疫组织化学诊断病理学,使得间变性大细胞淋巴瘤被定义为一个独立的亚型,对外周 T 细胞淋巴瘤进行了更精确的亚型分型,阐明了霍奇金(Hodgkin)和Reed-Sternberg (HRS)细胞的细胞起源,并理解了它们的特殊特征。此外,它使得经典霍奇金淋巴瘤、ALCL 及其亚型与纵隔灰区淋巴瘤之间的鉴别诊断更加清晰。在常规活检中精确检测 CD30 极大地有助于识别适合抗 CD30 免疫治疗的淋巴瘤。
本综述的第一部分描述 CD30 分子的发现之路,以及 CD30 如何促进淋巴瘤的更精确诊断和分类。第二部分探讨抗 CD30 疗法是如何开发的,以及抗 CD30- auristatin 偶联物和抗 CD30 CAR-T 细胞在治疗表达 CD30 的淋巴瘤方面的影响。
CD30的发现之路
将许多大细胞淋巴瘤鉴定为 IgM 阳性 B 细胞淋巴瘤 (1972)
在 1960 年代,美国和欧洲的淋巴瘤专家认为淋巴结的大细胞肿瘤来源于网状细胞或组织细胞,这种观点主要基于淋巴细胞没有能力转化为大细胞的教条观念。然而1965 年,免疫学研究表明淋巴细胞可以转化为大细胞,并包括 B 细胞和 T 细胞。这些发现在当时被淋巴瘤专家忽视了。
鉴于观察到小鼠 B 细胞表面携带免疫球蛋白,学者测量了网状细胞肉瘤和组织细胞淋巴瘤的新鲜尸检样本中的 IgM。值得注意的是,在这些肿瘤中检测到高量的 IgM,表明它们来源于 B 细胞,代表高度恶性的大 B 细胞淋巴瘤。
随后旨在鉴定 IgM 阴性大细胞淋巴瘤(包括 cHL 的 IgM 阴性 HRS 细胞)起源细胞的研究长期未能成功。
建立第一个霍奇金细胞系 (1979)
当 HRS 细胞的细胞系建立后,取得了一定进展。然而最初的尝试却导致了在 1977 年发表的错误且不实的研究结果,这在 3 年后才得以揭露。1979 年,Diehl 的团队成功地从一名霍奇金病患者的胸腔积液中建立了永久生长的 L428 细胞系。首先发现 L428 细胞缺乏 B 细胞、T 细胞和组织细胞抗原,因此类似于 HRS 细胞。随后寻找 HRS 细胞特异性或特征性标记物的动机源于观察到体内 HRS 细胞通常被淋巴细胞包围(图 1A)。将 L428 细胞与本综述作者之一 (H.S.) 的外周淋巴细胞共培养的实验显示,L428 细胞像体内 HRS 细胞一样,将淋巴细胞结合到其表面(图 1B)。这些发现强烈表明 L428 代表着一个真正的 HRS 细胞系。
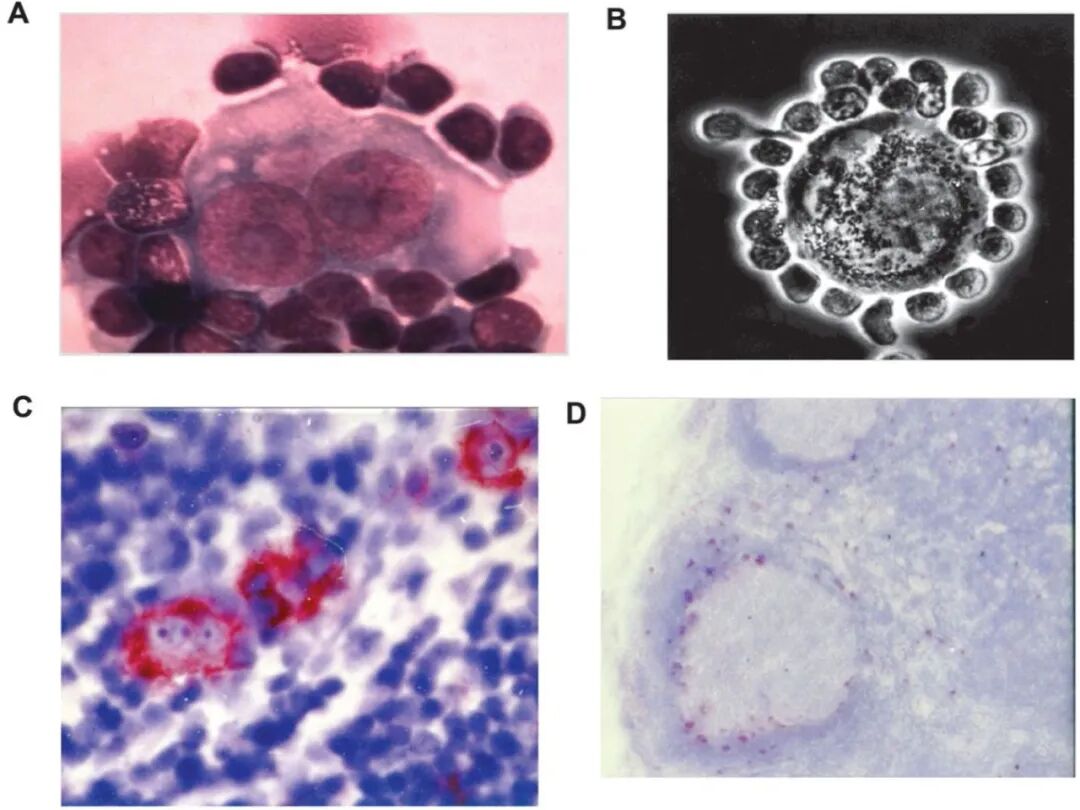
图1.识别 L428 为真正的霍奇金细胞系,以及生成针对 L428 细胞系细胞的多克隆和单克隆抗体。(A)体外 Reed-Sternberg 细胞的印迹,周围有淋巴细胞;(B)将 L428 细胞系细胞与作者之一(H.S.)的外周淋巴细胞共培养,显示淋巴细胞与 L428 细胞系表面强烈结合;(C)第一种名为 Ki-1 的单克隆抗 L428 细胞抗体,在霍奇金活检的冷冻切片中显示出与多克隆兔抗血清相同的 HRS 细胞选择性染色特征,并且(D)在人扁桃体的冷冻切片中对少数正常淋巴样细胞有弱染色。
寻找霍奇金相关抗原 (1981)
用来自 L428 细胞的高度纯化的胞质蛋白组分对几只兔子进行免疫,其中一只兔子的抗血清在吸收中性粒细胞和 Daudi 细胞系细胞后,在霍奇金活检的冰冻切片中选择性地染色了 HRS 细胞的细胞质。这些发现表明,该多克隆抗血清检测到一种霍奇金特异性分子,可能具有病毒性质。
Ki-1 抗原的发现 (1982)
鉴于上述可能性,学者应用由 Cesar Milstein 和 George Köhler 建立的单克隆抗体技术,以生成一个能产生针对多克隆抗血清检测到的抗原的、质量相同且数量无限的抗体的杂交瘤。在生成的 1500 个杂交瘤中,鉴定出一个杂交瘤,其分泌的抗体在冰冻切片中强烈染色 HRS 细胞的细胞质(图 1C),并且在人扁桃体的冰冻切片中,染色 B 细胞滤泡周围的少数大细胞(图 1D)。鉴定出的杂交瘤称为 Ki-1。
将Ki-1根据分化群分类为CD30 (1986)
为了使 Ki-1 抗体被纳入 CD 分类,需要更多具有 Ki-1 特异性的抗体。在柏林,产生了八个新的 Ki-1 样杂交瘤。这些新杂交瘤的抗体被 1986 年牛津白细胞分型研讨会接受。Ki-1 杂交瘤被纳入 CD 簇分类,命名为 CD30。
生成用于在常规石蜡切片中检测Ki-1/CD30分子的Ber-H2抗体 (1989)
在八个新的 Ki-1 杂交瘤中,鉴定出一个名为 "Ber-H2" 的杂交瘤,其分泌的抗体检测到 Ki-1/CD30 分子的一个耐福尔马林表位,从而能够在常规石蜡切片中对 CD30 进行强而特异的染色。随着 Ber-H2 抗体在全球范围内的可用,CD30 也被引入诊断性免疫组织学组织程序。
将IgM阴性大细胞淋巴瘤分类为Ki-1/CD30淋巴瘤 (1994)
出乎意料的是,Ki-1 抗体除了 HRS 细胞外,还染色了具有间变性形态的 IgM 阴性大细胞淋巴瘤,导致这些肿瘤最初被命名为 Ki-1 淋巴瘤。新的抗 CD30 抗体 Ber-H2 使得能够在常规石蜡切片中扩展对 Ki-1 淋巴瘤的研究(图 2A,B)。Ki-1 淋巴瘤的初始组织学分类差异很大,包括:恶性组织细胞增生症、间变性癌、多形性大细胞淋巴瘤和霍奇金肉瘤。当这些 Ki-1 阳性病例被集中审查时,它们似乎属于一个单一的实体,被命名为 ALCL。这一点被 R.E.A.L和 WHO 淋巴瘤分类所接受。随后的免疫球蛋白和 T 细胞受体(TCR)重排研究发现,Ki-1/CD30 阳性的肿瘤是一种特殊的 T 细胞来源的淋巴瘤类型,且常伴有 T 细胞程序的丢失。
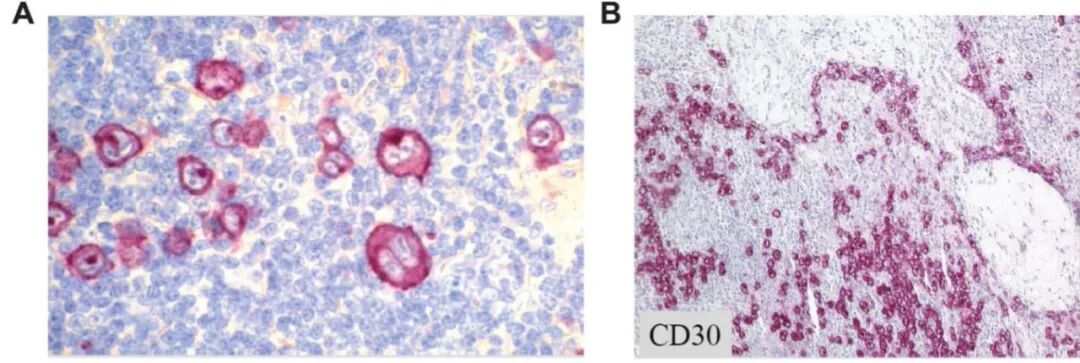
图2.福尔马林固定并石蜡包埋(FFPE)的组织切片中的 CD30 染色。单克隆抗体 Ber-H2 对 HRS 细胞(A)和 ALCL 细胞(B)的染色具有很强的选择性,在 FFPE 切片中可见。
CD30 分子的特征
CD30分子的染色体定位和结构 (1992)
CD30 基因定位于染色体 1p36.13(图 3,左),与其他 TNF 受体超家族成员紧密连锁,如人类 TNFR2 和 OX40 基因,并且是肿瘤坏死因子受体超家族的一个成员。CD30 是一个 120 kD 的糖蛋白,具有胞内、跨膜和胞外结构域(图 3,右)。胞外结构域由六个富含半胱氨酸的区域组成,呈重复结构]。所有 TNF 家族蛋白,包括 CD30,都形成同源三聚体,这种构型对其功能至关重要。CD30 蛋白的胞质末端包含 TNF 受体相关因子结合序列,可以激活核因子 kappa B 转录因子的通路。CD30 的成熟形式是在其通过高尔基体期间从一个约 84 kD 的前体加工而来。分子量从 84 kD 转变为 120 kD 主要是由于糖基化。CD30 的胞外部分被锌金属蛋白酶 (ADAM17) 蛋白水解切割。这种可溶性 CD30 被释放到血清中,在 cHL和 ALCL患者中均可检测到。一个问题是可溶性 CD30 是否可能结合并中和部分注射的抗 CD30 免疫毒素,但可溶性 CD30 降低治疗效果的可能性似乎不大,因为与已显示在体内靶向肿瘤细胞的最小量天然抗 CD30 单克隆抗体相比,免疫毒素是以过量方式给药的。
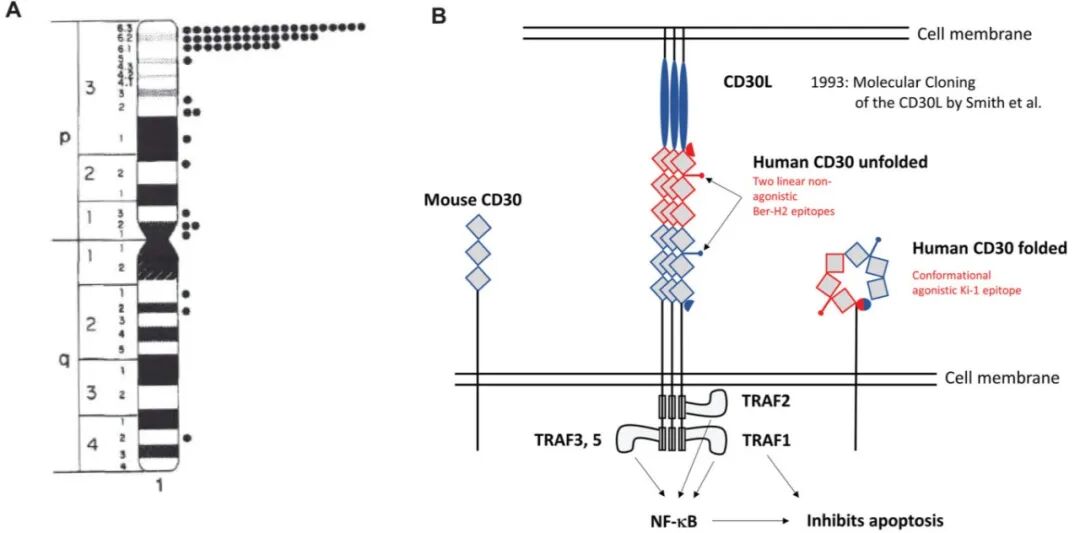
图3. Ki-1/CD30 分子的分子克隆。(左侧)Ki-1/CD30 的染色体定位;(右侧)Ki-1/CD30 分子的结构。细胞外未折叠结构域由六个半胱氨酸重复序列组成,包含两个被 Ber-H2 抗体识别的表位。折叠结构域表达一个表位,第一个 Ki-1 抗体就是针对该表位的。细胞内结构域含有 TNF 受体相关因子结合序列,能够激活 NF-kB 并抑制细胞凋亡。
CD30 蛋白的生物学功能
CD30 的表位刺激实验导致受体三聚化,并通过募集 TNFR 相关因子和 TRAF 结合蛋白进行信号转导,生成一个信号复合物。TRAF2 以及 TRAF1 和 TRAF5 都参与信号传导过程。CD30 刺激的下游效应部分由 NFkB 介导,也由丝裂原活化蛋白激酶/细胞外信号调节激酶通路介导。CD30 胞质尾中的一个新结构域也介导 NFkB 激活,而不直接与 TRAF2 或 5 相互作用,表明未知的 TRAF 蛋白参与了 CD30 的信号转导通路。
CD30 在 cHL 和 ALCL 中高且一致地表达,而在正常淋巴组织中罕见且低表达,表明 CD30 在 cHL 和 ALCL 的发展中起着重要作用。NFkB 和丝裂原活化蛋白激酶/细胞外信号调节激酶通路是 CD30 介导的信号传导不可或缺的部分,这似乎提示 CD30 表达可能赋予肿瘤细胞增殖和抗凋亡优势。Horie 等人提出了 cHL 细胞中 CD30 过表达与 NFkB 通路的配体非依赖性刺激之间的联系,强调了 CD30 表达与肿瘤持续存在之间的可能联系。Stein 等人的研究组无法重复这些发现,并提出 cHL 中的 NFkB 激活是组成性的,与 CD30 无关,但存在于 ALCL 细胞中。Watanabe 等人显示 cHL 和 ALCL 细胞系中 CD30 的上调可能通过丝裂原活化蛋白激酶/细胞外信号调节激酶通路与 JunB(激活蛋白转录因子家族的一个成员)的表达相联系,形成一个自我维持的循环,具有多种效应,包括可能与恶性转化有关。在 ALCL 细胞系中显示,转录因子干扰素调节因子 4 通过涉及 NFkB 的正反馈环驱动 CD30 表达。除了 IRF4 和 AP-1/JunB,Ets 转录家族也与肿瘤细胞中 CD30 的上调有关。
其他研究试图定义 CD30 刺激在淋巴瘤发病机制中的作用,但受限于使用了应用不同配体和不同细胞系。对不同研究的解释以及 CD30 刺激的多效性效应导致了显著程度的争议。因此,最终尚不清楚 CD30 是否对表达 CD30 的淋巴瘤的发病机制有贡献。
cHL的CD30阳性HRS细胞的特征
HRS 细胞的频率
最初描述时,在病变组织的苏木精-伊红染色切片中评估的 HRS 细胞频率为 0.5%–2%。单核霍奇金细胞通常在组织学上未被识别,因为它们的形态类似于其他非恶性大细胞。低频率数据来源于 CD30 免疫染色可用之前。将 CD30 纳入诊断程序显示,霍奇金组织活检中 HRS 细胞的频率可以达到 > 10%(Stein H,未发表的研究结果)。
通过从霍奇金活检冰冻切片中挑取CD30阳性细胞阐明HRS细胞的细胞起源
许多旨在阐明 HRS 细胞起源的研究因霍奇金受累组织中 HRS 细胞的稀少而失败。CD30 免疫染色使得单个 HRS 细胞可见,以便从冰冻切片中提取。分离的 CD30 阳性 HRS 细胞进行单细胞 PCR,并证明含有克隆性重排的 IG V 区基因,这是恶性 B 细胞的标志 [52, 54–56]。在 HRS 细胞的克隆性重排 VH 基因中发现了高负荷的体细胞突变,表明 HRS 细胞来源于生发中心 B细胞。与其他 B 细胞抗原不同,B 细胞程序中的一个分子 PAX5 没有被关闭,它的表达是 HRS 细胞 B 细胞性质的表型确认。基于这些发现,先前的名称霍奇金病被改为霍奇金淋巴瘤 (cHL)。
CD30在正常和病理组织中的表达情况
CD30在正常组织中的表达
在正常淋巴组织中,CD30 在一小部分具有明显核仁的大单核细胞中表达。这些大的 CD30 阳性细胞处于细胞周期中,可由 Ki-67 表达证明,并且主要位于 B 细胞滤泡周围,在较小程度上位于扁桃体、淋巴结和脾脏的生发中心边缘,以及胸腺的哈索尔小体周围。CD30+细胞的细胞学特征及其在正常淋巴组织中的拓扑分布让人想起 cHL 中的 HRS 细胞。因此,有人提出这些成分可能代表 cHL 肿瘤群体的正常对应物。免疫表型和 IgV 基因分析表明,罕见的生发中心和滤泡外 CD30+ 细胞代表 B 细胞。CD30+生发中心和滤泡外 B 细胞的转录组共享一个强烈的 MYC 特征,不同于CD30 阴性的 GC B 细胞、记忆 B 细胞和浆细胞。CD30+ 生发中心 B 细胞可能代表重新分化为中心母细胞的 MYC+ 中心细胞,而 CD30+ 滤泡外 B 细胞可能由活跃、增殖的记忆 B 细胞组成。通过进一步研究,发现反应性淋巴结中的许多 CD30 阳性细胞是多克隆 B 细胞的异质性群体,从而得出结论,没有迹象表明此类 CD30 阳性 B 细胞群体代表霍奇金淋巴瘤的前驱病变。
CD30分子的诊断影响
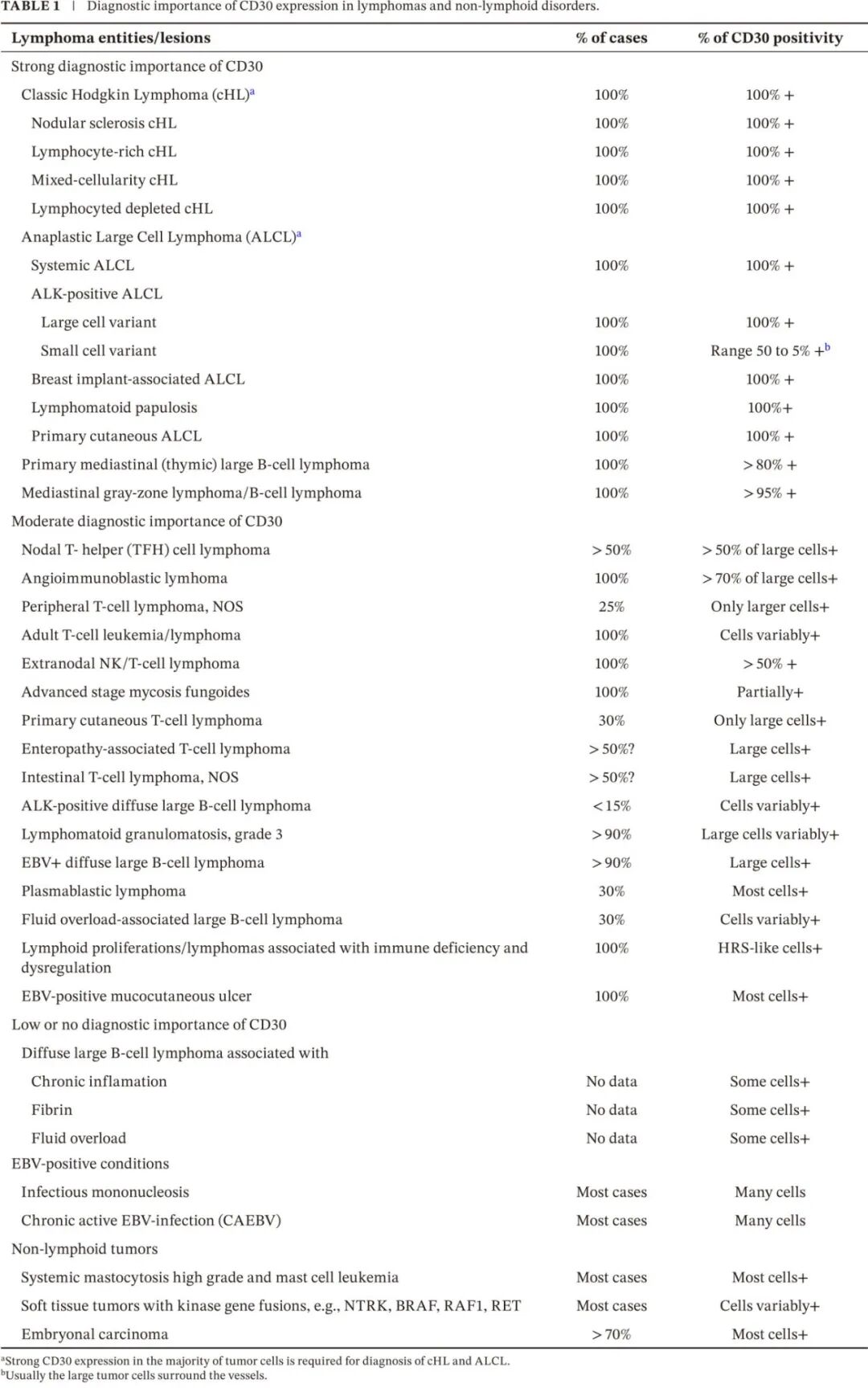
CD30 表达已在多种淋巴样恶性肿瘤中检测到,最高及最一致的表达见于 cHL 和 ALCL。因此,检测高水平 CD30 是诊断 cHL 和 ALCL 的必要条件(图 4)。最近,评估了流式细胞术检测 CD30 在诊断乳腺植入物相关 ALCL 中的作用。重要的是要注意,植入物周围液中存在 CD30 阳性细胞并不等同于淋巴瘤的诊断,除非存在非典型细胞。在 T 细胞淋巴瘤中发现了 CD30 的可变表达和强度,如 PTCL、皮肤 T 细胞淋巴瘤和结外 NK-T 细胞淋巴瘤。
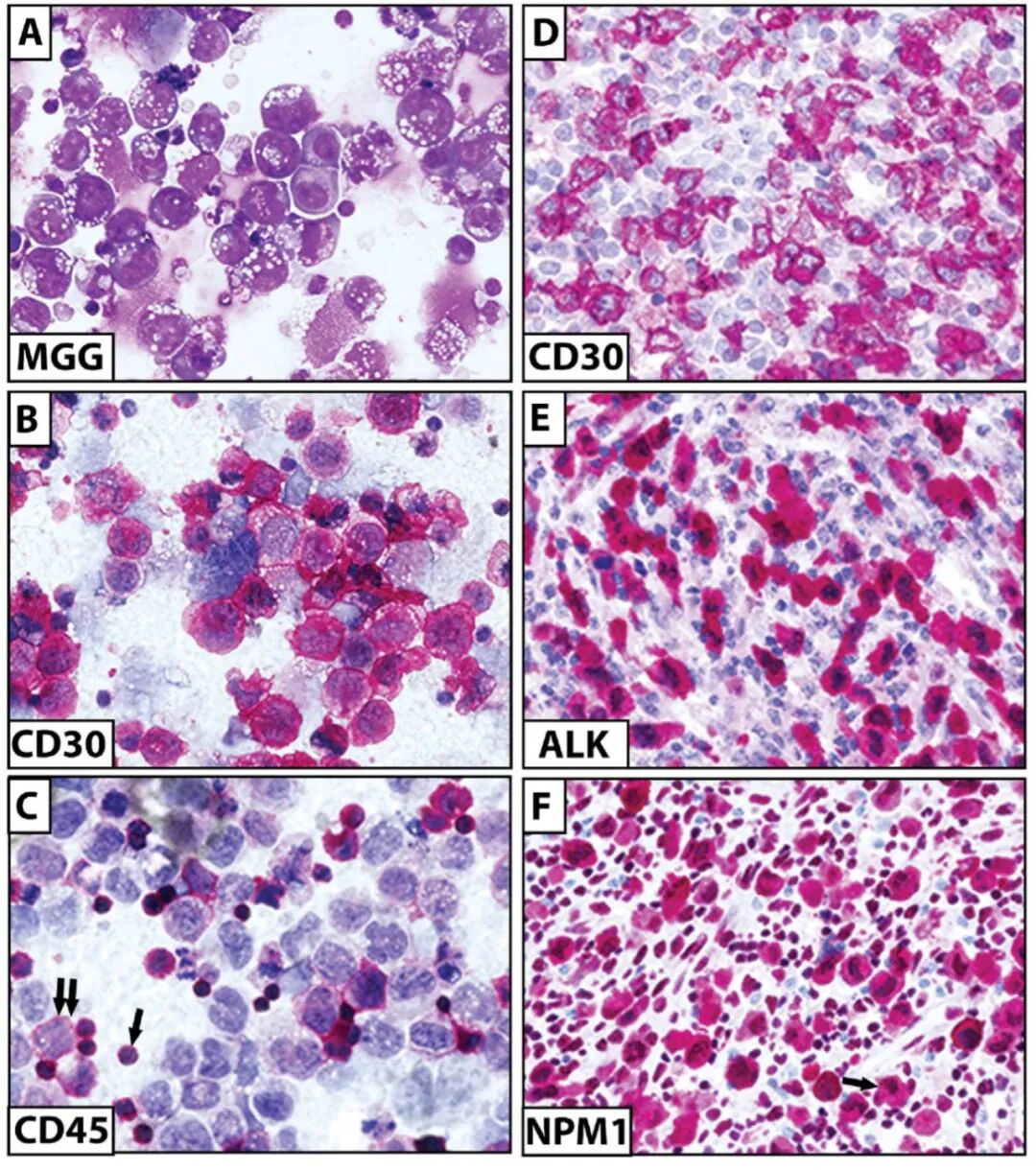
图4.间变性大细胞淋巴瘤(ALCL)的鉴别诊断。(A)ALK 阴性间变性大细胞淋巴瘤(腹水)。可见大量具有嗜碱性细胞质和细胞质空泡的大型肿瘤细胞(May-Grunwald-Giemsa 染色;×400 倍放大);(B)大多数肿瘤细胞为 CD30 阳性(APAAP 技术;×400 倍放大);(C)CD45 在小型反应性淋巴细胞(单箭头)中表达,但在仅少数肿瘤细胞(双箭头)中表达(APAAP 技术;×400 倍放大);(D)ALK 阳性间变性大细胞淋巴瘤。CD30 免疫染色(APAAP 技术;×400 倍放大);(E)ALK 免疫染色显示大型肿瘤细胞的细胞质和细胞核呈阳性(APAAP 技术;×400 倍放大);(F)NPM1 免疫染色显示大型肿瘤细胞的细胞质和细胞核呈阳性(单箭头),以及许多正常反应性细胞仅细胞核呈阳性(APAAP 技术;×400 倍放大)。
CD30 表达也可能提示恶性淋巴组织增生(如 EBV 阳性皮肤黏膜溃疡和 EBV 阳性 DLBCL)以及非恶性淋巴组织增生(如传染性单核细胞增多症和慢性 EBV 驱动病变)中存在 EBV 感染细胞。CD30 表达也常见于侵袭性系统性肥大细胞肿瘤和白血病、具有激酶基因融合的软组织肿瘤以及生殖细胞肿瘤,最一致的是在胚胎性癌中。表 1 显示了 CD30 表达具有强、中度或仅有很少或没有诊断重要性的淋巴瘤亚型、其他肿瘤和非肿瘤性病变。
抗CD30免疫毒素的开发
由于,CD30 分子在 HRS 和 ALCL 细胞中的强且一致表达,以及在正常淋巴组织中的有限其表达是一个合适的免疫治疗靶点。
第一种抗 CD30 免疫毒素的开发 (1992)
使用天然抗 CD30 单克隆抗体 SGN-30 和 SF11 的临床前研究在体外和小鼠模型中显示出有前景的活性,但在患者中仅显示出微弱的抗肿瘤疗效。
临床前研究探索了与植物毒素皂草素或其他毒素偶联的抗 CD30 抗体的活性,并首次证明这种免疫毒素在难治性/复发性 cHL 患者中具有活性。然而复发率较高,因为由于宿主对皂草素和蓖麻毒蛋白以及鼠源抗体部分产生强烈的免疫反应,无法进行重复治疗。
开发一种有效的抗CD30单克隆抗体Auristatin偶联物 (2003)
十一年后,非免疫原性毒素单甲基 auristatin E 与人源化抗 CD30 抗体连接。Auristatin 是一种微管抑制剂。抗 CD30 auristatin 偶联物与肿瘤细胞表面的 CD30 结合,通过受体内吞作用被内化,并被捕获到溶酶体中,在那里 auristatin 被蛋白水解酶释放并变得有毒。释放的 auristatin 抑制细胞骨架中微管蛋白的聚合,导致细胞周期停滞在 G2/M 期和凋亡或抗体依赖性细胞吞噬作用。Auristatin 还可以通过跨细胞膜扩散诱导邻近细胞死亡。此外,auristatin 似乎通过刺激树突状细胞发挥额外的抗肿瘤免疫力。该偶联物被命名为维布妥昔单抗(BV),在临床前和临床研究中显示出显著的体外和体内活性。
尽管BV具有高特异性,也仍存在off-target效应,特别是在外周神经病变方面,这很可能是由 auristatin 的抗微管蛋白作用介导的。其他更罕见但严重的副作用包括胰腺炎和脑白质病。在 cHL 和 ALCL 细胞系中已报道了各种对 BV 的耐药机制,包括药物转运蛋白表达增加、对 auristatin E 耐药以及 HRS 细胞释放含 CD30 的细胞外囊泡。在体外观察到 CD30 下调,但在 cHL 的组织样本中未观察到。然而,在复发难治性(R/R)ALCL 病例中已有报道在 BV 治疗后出现 CD30 下调。
CD30作为cHL的靶点
过去半个世纪,晚期 cHL 患者的结局已显著改善。然而,高达 30% 的 III–IV 期 cHL 患者在一线化疗后显示难治性疾病或复发,并且在老年患者中结局更差。在过去的二十年中,使用抗 CD30 免疫疗法取得了进一步进展。
BV联合化疗重塑了晚期cHL的一线治疗
直到最近,ABVD(多柔比星、博来霉素、长春碱和达卡巴嗪)在美国仍是 cHL 的标准治疗。德国霍奇金研究组则主要使用增强的 BEACOPP(博来霉素、依托泊苷、多柔比星、环磷酰胺、长春新碱、丙卡巴肼和泼尼松)治疗晚期 cHL。
该疾病标准治疗的一个改变是将 BV 纳入一线治疗。ECHELON-1 3 期试验在 III–IV 期 cHL 中比较了 BV-AVD(n=664 例患者)与 ABVD(n=670 例患者)。BV-AVD 的 2 年修正 PFS 为 82.1%,ABVD 为 77.2%(p=0.04)。与 ABVD 相比,BV-AVD 的中性粒细胞减少症(58% 对 45%)和 ≥ 2 级外周神经病变(31% 对 11%)发生率更高。接受 BV-AVD 的患者中报告了 < 1% 的 3 级或以上肺毒性,而接受 ABVD 的患者为 3%。在 6 年随访时,BV-AVD 比 ABVD 有 7.8% 的 PFS 和 4.5% 的 OS 获益。
在 PET 引导的 3 期 HD21 试验中,将 BrECADD(BV、依托泊苷、多柔比星、环磷酰胺、达卡巴嗪、地塞米松)与增强的 BEACOPP 进行了比较。64% 的患者 iPET 阴性,总共接受了 4 个周期的治疗。与 esc-B 相比,BrECADD 显示出更优的 4 年 PFS(94.3% 对 90.9%)、更低的急性血液学毒性(4 级 31% 对 52%)和更低的外周感觉神经病变(所有级别 38% 对 49%)。治疗 1 年后无显著残留器官毒性,>95% 的女性患者激素恢复。基于这些结果,BrECADD 是 GHSG 针对 ≤60 岁晚期 cHL 成年患者的新标准治疗。
晚期 cHL 的老年患者,尤其是不适合化疗的患者,通常比年轻患者预后更差。然而,BV 单药治疗或序贯 BV-AVD在这种情况下显示出有希望的结果。使用序贯 BV-AVD,2 年 PFS 和 OS 分别为 84% 和 93%。不适合化疗的 >60 岁 cHL 患者也可能受益于 BV 与达卡巴嗪或纳武利尤单抗联合使用。缓解率高,并且在中位随访 > 4 年时,近一半的缓解较为持久。BV 联合纳武利尤单抗的长期随访表明,该方案对 > 60 岁的患者有效,治愈率约为 40%。BV-AVD 在 HIV 相关晚期 cHL 中也具有高活性且不良事件发生率可耐受。
重塑早期cHL的一线治疗
在早期不良预后 cHL 中也评估了 BV 联合方案,目的是提高 CR 率、缩短治疗持续时间或省略放疗。在 BREACH 研究中,与 4 个周期 ABVD + 30 Gy 相比,4 个周期 BV-AVD 后进行受累淋巴结放疗(30 Gy)与更高的 PET-2 阴性率相关(82.3% 对 75.4%)。然而,2 年 PFS 相似(97.3% 对 92.6%)。发热性中性粒细胞减少症和外周神经病变在 BV-AVD 中更常见。在另一项研究中,新诊断的、具有高危因素的早期 cHL 患者接受了 4 个周期 BV-AVD 治疗,达到 PET 阴性的患者接受 30 Gy 原位放疗。超过 90% 的患者在 2-4 个周期 BV-AVD 后达到中期 PET 阴性。所有完成 BV+AVD+原位放疗的 25 名患者均达到 CR。中位随访 18.8 个月,意向治疗分析显示 1 年 PFS 为 93.3%。治疗耐受性良好,无显著肺毒性。这可能是一个高活性方案,特别是在有大包块疾病的患者中。在一项 2 期研究中,评估了 ABVD(2-6 个周期)后巩固性 BV(6 个周期)在高危早期 cHL 中的应用。CR 率为 95%,估计 3 年 PFS 为 92%。
BV-AVD 也评估了用于非大包块 I/II 期 cHL,结果显示出高 CR 率,PFS 和 OS 分别为 94% 和 97%,大多数患者仅需要 4 个周期治疗。由于毒性高于单独使用 AVD 的预期,这种方法可能不适用于预后良好的早期患者。最后,一项研究评估了在非大包块局限期 cHL 中省略博来霉素和长春碱(BV-DC)。观察到高 CR 率和持久的 PFS,大多数患者需要 4 个周期治疗。估计的 5 年 PFS 和 OS 分别为 91% 和 96%。
累积来看,所有上述研究表明,通过加入 BV 可以获得高 CR 率和优异的 PFS,允许对早期 cHL 进行仅化疗的治疗。
BV在难治性/复发性cHL中的应用
R/R cHL 通常使用非交叉耐药化疗方案治疗,随后对化疗敏感的患者进行自体干细胞移植。这种组合通常具有约 50% 的长期治愈率。在两项研究中评估了 BV 在 R/R cHL 中的应用,一项是 1 期,另一项是 2 期,均显示安全性和活性。在最大的 2 期研究中,招募了 102 名 ASCT 后 R/R cHL 患者。ORR 为 75%,其中 34% 为 CR。所有患者的中位 PFS 为 5.6 个月,CR 患者的中位缓解持续时间为 20.5 个月。1.5 年后,31 名患者存活且无记录进展性疾病。最常见的治疗相关不良事件是外周感觉神经病变、恶心、疲劳、中性粒细胞减少和腹泻。5 年随访数据表明,一部分使用单药BV 获得 CR 的 R/R cHL 患者具有长期疾病控制,并可能潜在治愈。
BV 单药作为二线治疗可作为 ASCT 的有效桥接,ORR 为 75%,CR 率为 43%。ASCT 后2 年 PFS 和 OS 分别为 67% 和 93%。移植前 PET 阴性是移植后结局的最强预测因素之一。一项多中心 2 期研究报告,BV x 4 后 ORR 为 68%,通过这种方法,49% 的患者 (18/37) 避免了额外化疗,在 CR (35%) 或部分缓解 (14%) 后直接进行 ASCT。BV 联合纳武利尤单抗作为 ASCT 的桥接也是安全有效的,ORR 为 85%,CR 率为 67%。3 年 OS 为 93%。
PET 引导的序贯挽救治疗(先用 BV,然后用增强的 ICE)具有高 PET 阴性率,移植后 2 年 PFS 为 80%。Lynch 等人观察到联合剂量密集型 BV 和 ICE 的类似结局。由于其显著的毒性,该方案可能是年轻适合移植患者的二线治疗选择。除了 ICE,BV 还与其他化疗方案联合使用,ASCT 后 CR 率为 70%–79%,2 年 PFS 率为 70%–76%。然而,这些方案与高发生率的 3-4 级血液学毒性相关。BV 联合或不联合挽救化疗似乎能提高复发性 cHL 患者的 PFS,但对原发性难治患者无效。
ASCT 后使用 BV 作为巩固治疗,是针对具有不良风险因素(难治性疾病、初始治疗后 < 1 年复发、复发时结外疾病)的 cHL 患者的一种治疗选择,他们通常会在 ASCT 后进展。随机、双盲、3 期 AETHERA 试验评估了在这种情况下 BV 作为巩固治疗的安全性和有效性。在这项研究中,329 名具有 R/R 不良风险 cHL 的患者被随机分配在 ASCT 后接受 BV 或安慰剂治疗最多 16 个周期。BV 组和安慰剂组的中位 PFS 分别为 42.9 和 24.1 个月。然而,BV 组和安慰剂组之间未观察到 OS 的显著差异。在进一步随访时,BV 继续为患者提供持续的 PFS 获益,BV 组 5 年 PFS 为 59%,安慰剂组为 41%。这些结果导致 FDA 批准 BV 作为 ASCT 后巩固治疗用于高复发或进展风险的 cHL 患者。
累积来看,上述研究表明 BV 可以安全地与化疗联合,具有高 CR 率,并有可能改善 ASCT 的结局。
CD30+外周T细胞淋巴瘤的靶向治疗
重塑CD30+ ALCL和其他PTCL的一线治疗
CHOP 代表 PTCL 患者的标准一线治疗,但该方案与频繁复发和仅 35% 的 5 年生存率相关。为了改善临床结果,BV 已在一线治疗中与化疗联合使用。III 期 ECHELON-2 比较了 BV +环磷酰胺、多柔比星和泼尼松(CHP)与 CHOP 在 ALCL 或其他 CD30 阳性 > 10% 的 PTCL 患者中的应用。在 5 年随访时,BV-CHP 优于 CHOP,PFS(51.4% 对 43%)和 OS(70.1% 对 61%)均改善。ECHELON-2 的进一步分析显示,在 ALK+ 和 ALK- 亚组中,与 CHOP 相比,BV-CHP 在 5 年随访时均观察到预后改善。
BV-CHP 显然是 CD30 强表达的 ALCL 的标准治疗选择,而该方案在 CD30 表达不均一的 PTCL-NOS 和 AITL 亚组中的获益不确定。在 ECHELON-2 试验的亚组分析中评估了治疗结束时达到 CR 的患者在 BV-CHP 后进行巩固性 ASCT 的影响,该分析报告显示接受 ASCT 的患者比未接受者的 PFS 更好(5 年 PFS 65.3% 对 46.4%)。这些结果也在另一项研究中得到证实。
CHOEP 比 CHOP 具有更高的活性,尤其是在 ALK+ ALCL 中。在 46 名表达 CD30 的 PTCL 患者中评估了 CHEP-BV 随后 BV 巩固的安全性和有效性。ORR 为 91%,CR 为 80%,与亚型或 CD30 表达无关。该方案可能在年轻、高危患者中发挥作用。这些数据在最近的一项研究中也得到证实。CHEP-BV 即使在成人 T 细胞淋巴瘤/白血病中作为一线治疗也是安全有效的,可作为异基因造血干细胞移植的桥接。
BV 在 CD30+ 皮肤 T 细胞淋巴瘤和淋巴瘤样丘疹病中耐受性良好,ORR 为 73%,CR 为 35%。在一项 III 期试验中,评估了 BV 与医生选择的甲氨蝶呤或bexarotene在皮肤 T 细胞淋巴瘤中的活性和安全性。与医生选择的甲氨蝶呤或贝沙罗汀相比,BV 在持续至少 4 个月的客观缓解方面有显著改善(56.3% 对 12.5%)。
BV在R/R CD30+ ALCL和其他PTCL中的应用
大约一半的 CD30+ ALCL 患者(尤其是 ALK 阴性型)以及更高比例的其他 CD30+ PTCL 亚型患者会在一线治疗和 ASCT 巩固后复发。因此,BV 已广泛用于 R/R患者。在一项 2 期研究中评估了 BV 作为单药治疗(1.8 mg/kg,每 3 周一次,最多 16 个周期)在 58 名 R/R ALCL 患者(中位年龄 52 岁,大多为 ALK 阴性)中的安全性和有效性。在先前治疗(包括 ASCT)失败的患者中,ORR 为 86%,其中 57% 为 CR。CR 的中位缓解持续时间为 13.2 个月。中性粒细胞减少、血小板减少和外周感觉神经病变是影响 >10% 患者的主要 3-4 级不良事件。在 5 年随访时,38 名 (66%) 患者处于 CR,与 ALK 状态或先前治疗次数无关。整体患者和未达到 CR 的患者亚组的估计 OS 率分别为 79% 和 25%。此外,CR 患者的 PFS 率远高于总入组患者(57% 对 39%)。一项意大利观察性、多中心、回顾性研究在 40 名系统性 ALCL 患者中报告了类似结果,ORR 为 62.5%(45% CR 和 17.5% PR)。
BV 单药治疗在其他类型 R/R PTCL 中的疗效低于 ALCL,AITL的ORR为54%。中位缓解持续时间有限。BV 也已在 R/R PTCL 患者 (n = 82) 中与苯达莫司汀联合使用。最佳 ORR 为 68%,其中 49% 为 CR。CR 患者的中位缓解持续时间为 15.4 个月。BV + ICE(异环磷酰胺、卡铂、依托泊苷)联合治疗 R/R PTCL 与 66.7% 的 ORR 相关,所有患者均达到 CR。BV 联合纳武利尤单抗在 R/R PTCL 和皮肤 T 细胞淋巴瘤中的疗效不佳。
其他表达CD30的淋巴瘤
CD30 在 DLBCL 和纵隔淋巴瘤中表达有差异,BV 的活性和安全性已在 R/R DLBCL 中得到证实,无论是作为单药治疗(ORR 44%,包括 17% CR)还是与来那度胺联合使用(ORR 57%,CR 35%)。研究探索了 BV +纳武利尤单抗联合治疗 R/R 原发性纵隔 B 细胞淋巴瘤。中位随访 11.1 个月后,ORR 为 73%,CR 率为 37%。由于C19 CAR-T在 R/R DLBCL 和原发性纵隔淋巴瘤中取得高度成功,BV 在此背景下的兴趣已减少。然而BV仍可能作为 CAR-T 细胞的桥接治疗发挥作用。
CD30 CAR-T细胞
治疗 R/R cHL和其他CD30+淋巴瘤
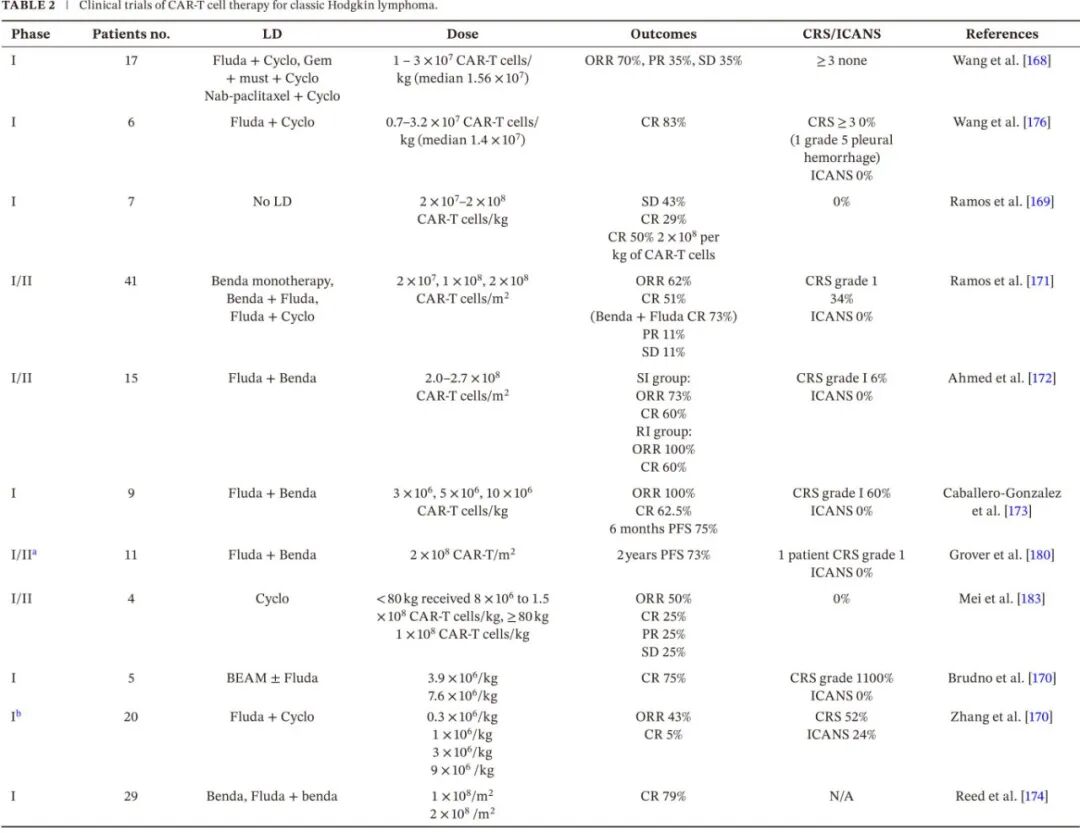
CD19 CAR-T 细胞彻底改变了 R/R B 细胞急性淋巴细胞白血病和 B 细胞淋巴瘤的治疗,CD30 CAR-T 细胞在 R/R cHL 中的结果则较为有限。在第一个发表的 I 期试验中,18 名经过多线治疗的患者(17 名 R/R cHL,1 名 ALCL)接受 CD30 CAR-T 细胞治疗。ORR 为 39%(全部为PR),中位 PFS 为 6 个月。所有患者均经历 1-2 级细胞因子释放综合征,但没有免疫效应细胞相关神经毒性综合征或治疗相关死亡。其他研究显示类似的不令人满意的反应,并伴有高毒性。
在一项 I/II 期试验中,41 名经过多线治疗的 cHL 患者接受 CD30 CAR-T 细胞治疗。整个队列的 ORR 为 62%,1 年 PFS 为 36%。在 32 名接受基于氟达拉滨的清淋的患者中,ORR 为 72%,其中 19 名患者 (59%) 达到 CR;该亚组的 1 年 PFS 和 OS 分别为 61% 和 94%。CRS 为低级别,未观察到神经毒性。这些有利结果在 15 名难治性 cHL 患者中得到证实,CR 率约为 60% 。然而,虽然cHL 获得高 CR 率,但 6 年随访时仅获得 19% 的低 PFS 和 25% 的持续缓解。
ASCT 可CD30 CAR-T 细胞输注串联使用,以治疗 R/R CD30+ 淋巴瘤。这种方法在 R/R cHL 和 ALCL 中耐受性良好且高效,即使在 PET 阳性或化疗难治患者(预期 ASCT 后结局较差)中也是如此。
在 R/R CD30+ 淋巴瘤中评估了第三代 CD30 CAR-T 细胞联合清淋化疗。9 名患者的中位 PFS 为 13 个月,其中三例长期 CR 超过 2 年。可能是由于两个共刺激结构域 CD28 和 4-1BB,它们既可以促进 CAR-T 细胞增殖(由于 CD28 共刺激结构域),又可以延长 CAR-T 细胞在体内的持久性(由于 4-1BB 胞内结构域)。另一项研究使用共表达 CCL17 同源受体 CCR4 的 CD30CAR-Ts,与不表达 CCR4 的 CD30CAR-Ts 相比,具有改善的肿瘤归巢和抗淋巴瘤活性,用于治疗 8 名 R/R cHL 患者,其中 6 名 (75%) 达到 CR,2 名 (25%) 达到 PR。5 名患者至今仍处于缓解状态,其中一名患者在治疗后 2.5 年仍处于 CR。
CD30 CAR T 细胞也用作 CD30 阳性淋巴瘤患者 ASCT 后的巩固治疗,这些患者具有高复发风险。具体而言,18 名患者(11 名 cHL,六名 T 细胞淋巴瘤,一名灰区淋巴瘤)在 ASCT 后中位 22 天(范围 16-44)输注抗 CD30 CAR-T 细胞。一名患者出现 1 级 CRS。最常见的 3-4 级不良事件是淋巴细胞减少和白细胞减少(11% 的病例)。在输注后中位随访 48.2 个月时,所有治疗患者 (n = 18) 的中位 PFS 为 32.3 个月,cHL 治疗患者 (n = 11) 的中位 PFS 尚未达到。所有治疗患者的中位 OS 尚未达到。
尽管清淋化疗后CD30 CAR-T 细胞具有高缓解率,但疾病进展仍很常见,治疗失败主要与 CAR-T 细胞输注前 PET 显示的较高代谢肿瘤体积 (> 60 mL) 相关。相反,桥接治疗、抗 CD30 CAR-T 细胞扩增/持久性以及治疗前 6 周内 CD3+ 淋巴细胞百分比不影响 PFS。
最近对 R/R cHL 中抗 CD30 CAR-T 细胞疗法的安全性和有效性进行了一项荟萃分析,共纳入 151 名参与者。ORR 和 CR 分别为 57% 和 34%。32% 的病例观察到部分缓解。中位随访时间范围为 9.5 至 71.5 个月,1 年 PFS 为 39%,1 年 OS 为 89%。白细胞减少和 CRS 是最常见的不良事件但可耐受,并且通过治疗可以解决。cHL 中 CD30 CAR-T 的临床试验总结在表 2 中。
对CD30 CAR-T的耐药机制及CAR-T后复发的治疗
已经研究了抗 CD30 CAR-T 细胞的耐药机制。在一名 cHL 患者中观察到 BV 和抗 CD30 CAR-T 细胞治疗后 CD30 表达降低。Marques-Piubelli报告了类似发现,但未得到证实。相反,其他研究者发现,在抗 CD30 CAR-T 细胞治疗后复发的肿瘤中,CD30 表达通常保留。这些发现表明,复发可能更可能是由于 scFv 与 CD30 的低亲和力结合和/或 cHL 中高度免疫抑制的肿瘤微环境。因此,已采用一些策略来克服这些问题。人工智能和表面等离子共振被用于选择对 CD30 具有高亲和力的单克隆抗体的 scFv 片段。可以采用双靶点抗CD30/PDL1-CCR CAR-T 细胞作为一种策略,PDL1.CCR 预计会阻断 CAR-T 细胞和巨噬细胞与 PDL1+ 肿瘤细胞的 PDL1/PD1 相互作用,模拟免疫检查点效应并减少 CAR-T 细胞耗竭。同时,PDL1-4.1BB 协刺激受体的刺激将增强 CAR-T 细胞的增殖和持续存在。
在 CAR-T 细胞治疗后复发的患者中,PD-1 抑制剂可能重新诱导完CR,即使患者之前接受过这些药物治疗或在治疗期间病情进展。此外,CD30 CAR-T 细胞可以与抗 PD-1 抗体疗法联合使用。特别是,抗 PD-1 抗体可增强CD30 CAR-T 疗法在复发难治性 CD30 阳性淋巴瘤患者中的效果,且毒性最小。ORR达到 91.7%(12 名患者中的 11 名),其中 6 名患者达到CR(50%),CRS为低级别。中位随访时间为 21.5 个月(范围:3−50 个月),PFS和OS分别为 45% 和 70%。
结论
CD30 分子是 cHL 和 ALCL 的优秀诊断标志物,靶向 CD30 对淋巴瘤治疗也很有价值。在早期 cHL 一线治疗中加入 BV 观察到的高 CR 率表明,该策略可能潜在地导致省略放疗。不适合基于蒽环类化疗的晚期 cHL 患者可能获益于 BV-纳武利尤单抗。BV 作为某些 PTCL 类别一线治疗的疗效仍需要进一步研究,特别是考虑到 CD30 表达在不同亚型间的可变性,最高水平见于 ALCL 和 cHL。用于患者选择的最佳 CD30 表达 cutoff 值仍然是一个未解决的问题,但在低甚至缺乏 CD30 表达的情况下仍观察到对 BV 的反应,正如在各种 T 细胞淋巴瘤亚型和蕈样肉芽肿中。这种反应可能是由于存在低水平的表面 CD30,低于免疫组织化学检测的阈值。一个更吸引人的假设是 BV 的旁观者效应,即 MMAE 穿过罕见被杀死的 CD30+ 肿瘤细胞的细胞膜,释放到周围的细胞外基质中,对邻近的 CD30 阴性肿瘤细胞发挥其细胞毒性活性。抗 CD30 CAR-T 细胞的疗效仍有限,应尝试对其进行结构修饰,旨在提高抗肿瘤活性,并拮抗 cHL 的免疫抑制微环境。
参考文献
H. Stein and B. Falini, “ CD30 as a Target Molecule in the Diagnosis and Therapy of Lymphomas,” American Journal of Hematology (2025): 1–19, https://doi.org/10.1002/ajh.70107.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)