首页 > 医疗资讯/ 正文
在发育过程中,大多数少突胶质细胞前体细胞(OPCs)分化为成熟髓鞘细胞(mOLs)参与神经元的髓鞘形成。成年大脑中,这些OPCs依然存在,并均匀分布于整个脑组织。脱髓鞘过程中OPCs迁移到损伤部位,增殖分化为mOLs,重新包裹在受损轴突,称为髓鞘再生。
AMP 活化蛋白激酶 (AMPK)作为关键的葡萄糖感受器,在空腹状态下可通过一条不依赖AMP的独特途径被激活,该过程发生于溶酶体表面。葡萄糖能够通过其代谢产物1,6-二磷酸果糖(FBP)水平的下降,再通过FBP空置的醛缩酶作为感受器,抑制钙离子通道TRPV,进而抑制v-ATPase,从而激活AMPK的过程。
2025年10月22日厦门大学/河南大学林圣彩团队在nature metabolism杂志发表文章“Oligodendrocyte precursor cell-specific blocking of low-glucose-induced activation of AMPK ensures myelination and remyelination”揭示OPCs 依赖去乙酰化酶SIRT2阻断低浓度葡萄糖激活AMPK,维持脱髓鞘后髓鞘再生过程。
1 低浓度葡萄糖状态下OPCs醛缩酶乙酰化水平升高,不能激活AMPK
离体实验发现在低浓度葡萄糖或无葡萄糖状态下,神经元、星形胶质细胞、小胶质细胞、成熟少突胶质细胞中AMPK信号被激活,但在OPCs并不出现这种激活,上述五种细胞中FBP水平均下降。TRPV2在OPCs中TRPV家族成员中表达量最高。在低浓度葡萄糖下OPCs的v-ATPase、TRPV2活性均不下降。细胞实验发现抑制OPCs的TRPV活性后可抑制v-ATPase,进一步激活AMPK。这些结果表明低浓度葡萄糖状态下醛缩酶无法抑制OPCs的TRPV活性。
醛缩酶家族包括三种结构非常相似的同工酶:ALDOA、ALDOB和ALDOC.其中OPCs富集表达ALDOC。利用质谱组学技术发现少突胶质细胞前体细胞ALDOC存在87个修饰位点,将赖氨酸残基第14位点突变后低浓度葡萄糖状态下OPCs的AMPK被激活。进一步实验发现低浓度葡萄糖状态下OPCs的ALDOC赖氨酸残基第14位点乙酰化(AcK14-ALDOC)水平显著升高,这种升高依赖于去乙酰化酶SIRT2。在成熟少突胶质细胞和293T细胞中并不出现AcK14-ALDOC乙酰化水平升高。
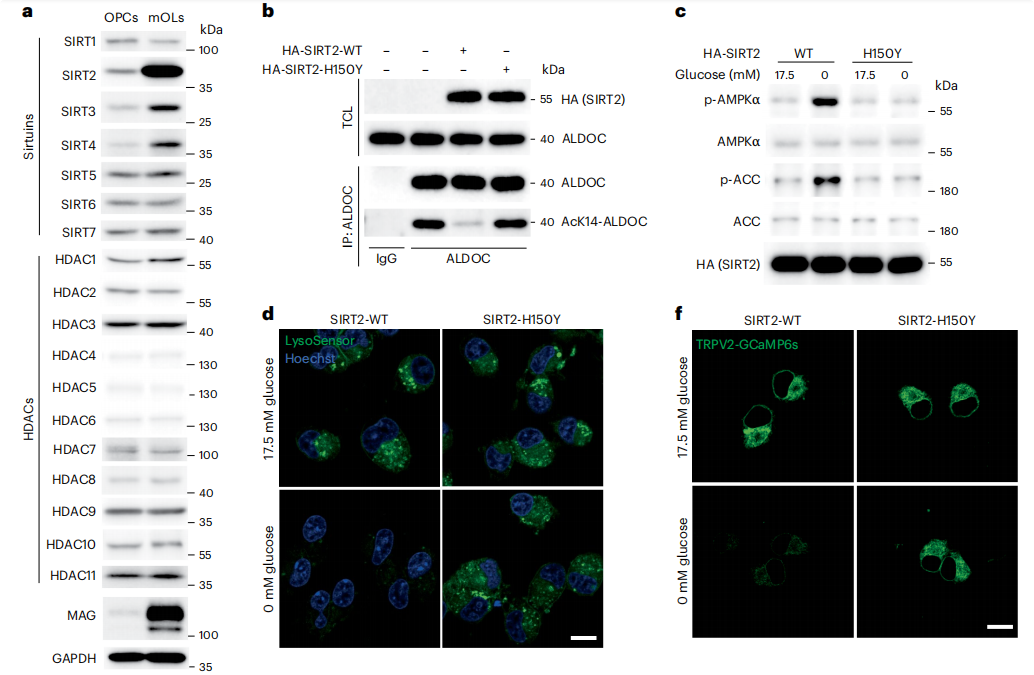
图1、低浓度葡萄糖状态下OPCs醛缩酶乙酰化水平升高,不能激活AMPK
2 激活OPCs 的AMPK信号抑制髓鞘形成
离体实验发现抑制TRPV活性激活AMPK后OPCs的增殖、分化过程均受到抑制。将大鼠OPCs的AMPKγ1突变后(AMPK的γ亚基,其突变使最终形成的异源三聚体AMPK复合物保持持续活性)OPCs和成熟少突胶质细胞的数量均显著减少。AMPKγ1突变小鼠聠胝体区域成熟少突胶质细胞的数量减少,髓鞘蛋白MBP表达减少,这些结果表明激活OPCs 的AMPK信号抑制髓鞘再生。
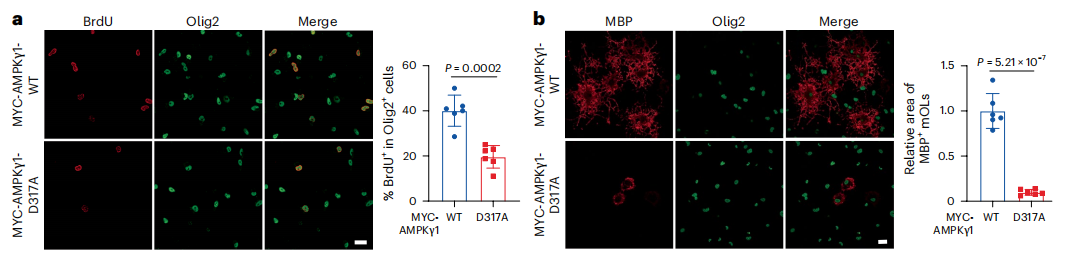
图2、OPCs 的AMPK信号激活抑制髓鞘形成
3 OPCs 的低AMPK活性维持脱髓鞘后髓鞘再生过程
Cuprizone诱导脱髓鞘后野生型小鼠聠胝体区域葡萄糖和FBP水平均下降,AMPK信号激活。OPCs特异性表达AcK14-ALDOC突变小鼠(ALDOC-K14R)在脱髓鞘过程中也会出现类似变化。然而,在髓鞘再生过程中野生型小鼠聠胝体区域成熟少突胶质细胞显著增多,但在ALDOC-K14R小鼠中并不出现这种增多,存在髓鞘再生障碍。AcK14-ALDOC突变后可加重自身免疫性脑脊髓炎模型的运动障碍。
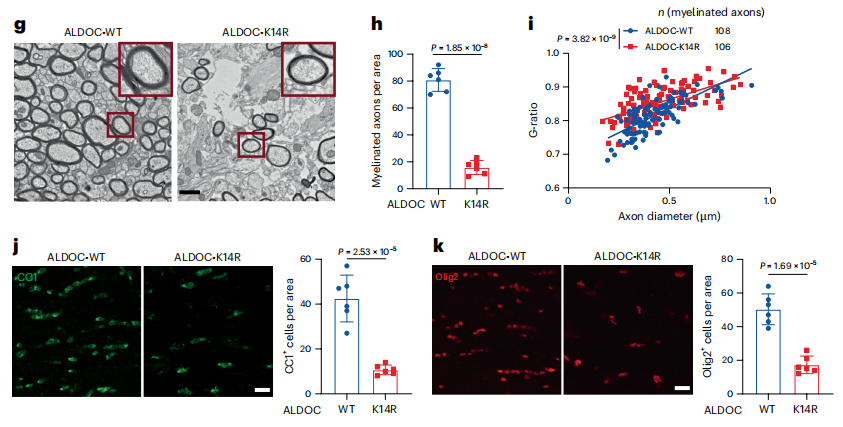
图3、OPCs 的低AMPK活性维持脱髓鞘后髓鞘再生过程
总结:
本文发现在低浓度葡萄糖状态下少突胶质细胞前体细胞醛缩酶ALDOC乙酰化水平升高,不能抑制TRPV活性,不激活AMPK信号,促进髓鞘再生过程。
参考文献
https://doi.org/10.1038/s42255-025-01386-8
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)