首页 > 医疗资讯/ 正文
1 病例资料
患儿男性,3岁,广东本地居民。因“全身多发淋巴结肿大伴反复发热1年”于2022年4月13日入院。
病史:
患儿1年前(2021年6月)首次发现左侧颈部鹌鹑蛋大小肿物,轻触痛,无发热破溃。首次入院查体示双侧颈部多发淋巴结肿大(最大2.5×1.5cm),血常规提示贫血(Hb 99g/L)、炎症指标升高(CRP 11.1mg/L),EB病毒抗体阳性(VCA-IgG 561AU/ml)。拟诊“颈部淋巴结炎”,予哌拉西林舒巴坦、阿昔洛韦治疗,淋巴结暂时缩小后出院。
病情进展:
出院后肿物进行性增大,5个月后(2021年8月)第二次入院时最大淋巴结达4×3cm,质硬,伴间歇发热(最高38.0℃),疑诊“淋巴瘤”。拟行淋巴结活检因患儿呼吸道感染中止。
本次入院:
淋巴结持续肿大1年(最大5cm),伴反复高热(39.6℃)、贫血(Hb 86g/L)、低蛋白血症(ALB 24.0g/L)、D-二聚体显著升高(10.91mg/L)。HIV初筛阴性,无明确免疫缺陷病史。
2 病理检查
大体检查:
切除灰红色淋巴结组织数枚,最大径5cm,切面实性,灰红灰黄相间,伴局灶坏死(图1)。
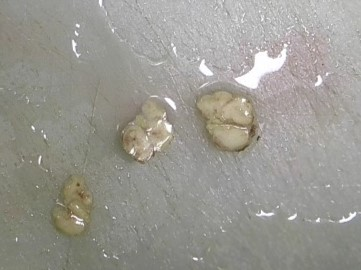
图1 大体淋巴结组织数枚,切面实性,灰红灰黄相间,伴局灶坏死
组织学检查:
(颈部淋巴结)结构破坏,见大片凝固性坏死,周围上皮样细胞增生形成肉芽肿,多核巨细胞反应显著(图2)。巨噬细胞胞浆内可见大量圆形、卵圆形及腊肠样微生物,直径2-4μm,部分可见横隔(图3、图4)。
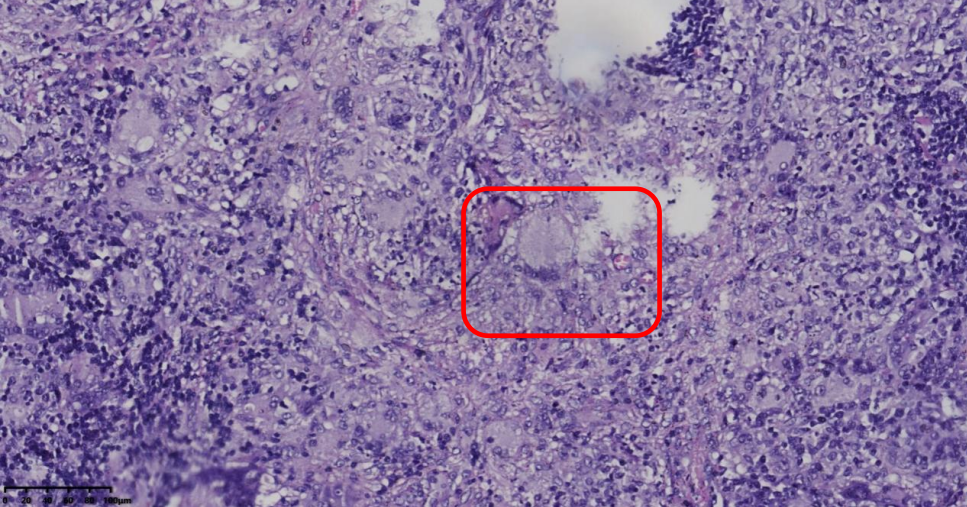
图2 肉芽肿性炎(HE,×100)
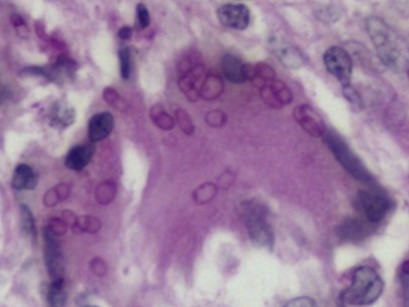
图3 PAS染色示菌体呈紫红色见大量圆形、卵圆形及腊肠样微生物,部分可见横隔(PAS,×400)
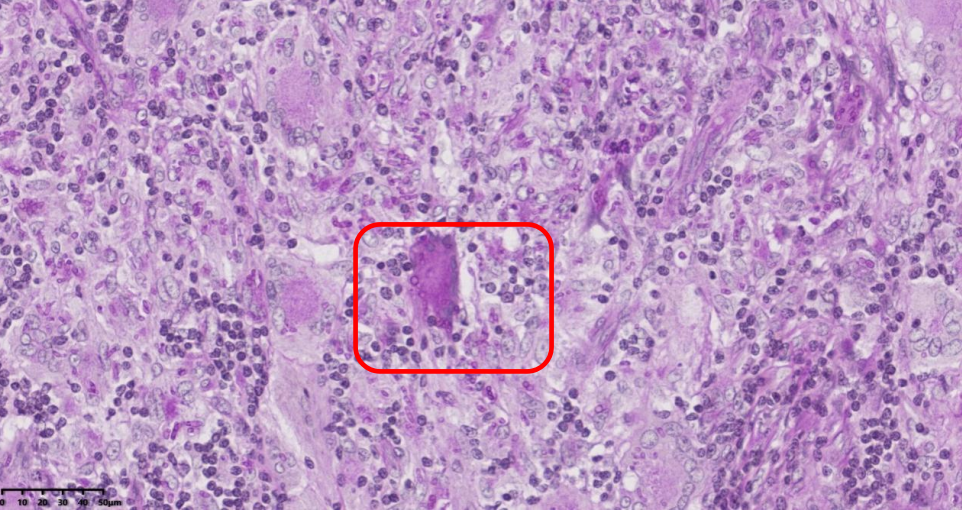
图4 PAS染色示菌体呈紫红色(PAS,×100)
特殊染色:
六胺银染色(GMS):菌体壁及横隔膜呈深黑色(图5)
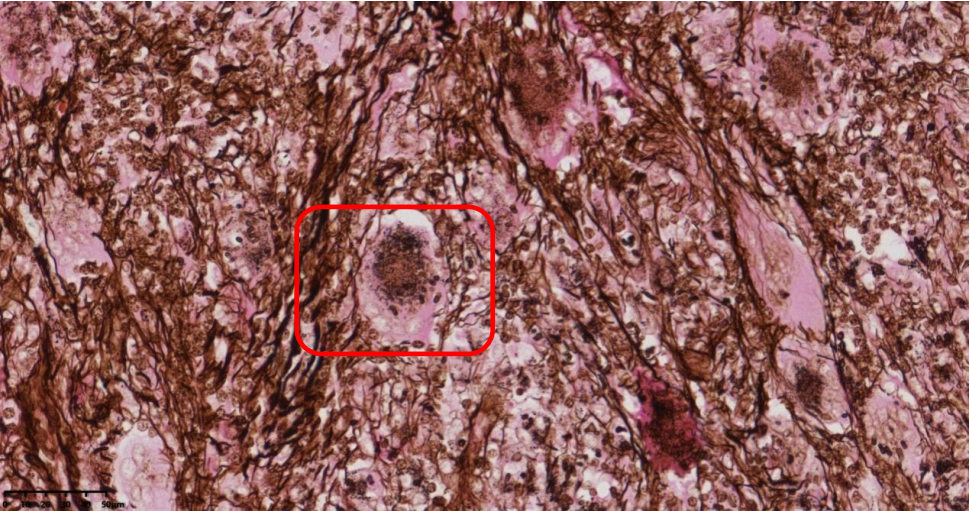
图5六胺银染色示菌体壁及横隔呈黑色(GMS,×100)
PAS染色:
菌体呈紫红色(图3、图4)
抗酸染色(-)(图6)
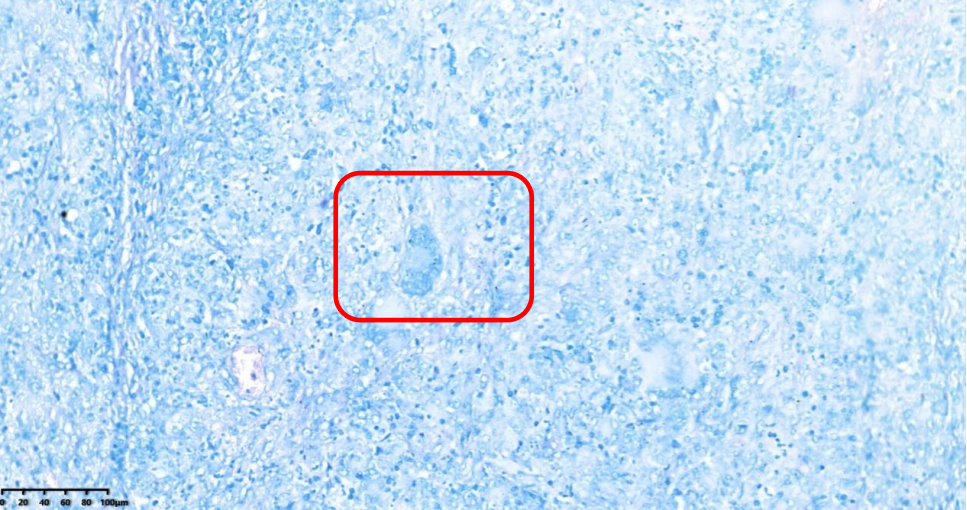
图6抗酸染色(-)×100
病原学鉴定:
经远程病理会诊确诊为马尔尼菲篮状菌(Talaromyces marneffei,TM)感染性淋巴结炎。
3 治疗与转归
确诊后即转上级医院。参考指南予两性霉素B脂质体(3mg/kg/d)诱导治疗,后序贯伏立康唑口服。随访3个月淋巴结缩小、发热消退,贫血改善。
4 讨 论
马尔尼菲篮状菌(Talaromyces marneffei)感染在东南亚及中国南方地区已成为重要的机会性真菌病。本病例作为罕见的非HIV感染儿童病例,其诊疗过程具有多重启示价值:
4.1 流行病学特征与易感因素
既往研究认为TM感染主要见于HIV感染者(CD4+<50/μL时风险显著增加)[1]。但近年非HIV病例报道增多,包括:①自身免疫病患者(如SLE)长期使用免疫抑制剂;②血液系统恶性肿瘤;③特发性CD4+淋巴细胞减少症[2]。本例的特殊性在于未发现明确免疫缺陷基础,提示可能存在未被识别的先天性免疫缺陷(如IFN-γ/IL-12通路异常),这与Zeng等[3]报道的儿童TM感染病例特征相符。值得注意的是,患儿EB病毒抗体持续高滴度阳性(VCA-IgG 561AU/ml),EBV感染可能导致暂时性细胞免疫功能抑制,成为TM感染的诱发因素。
4.2 病理诊断关键技术
本病例的确诊依赖于病理组织学与特殊染色的联合应用,其诊断价值体现在三个层面:
(1) 组织学特征:
坏死性肉芽肿性炎伴显著巨噬细胞浸润,符合局限性感染病理改变。与HIV感染者常见的"无反应性坏死"不同,本例肉芽肿结构完整,提示宿主保留一定免疫应答能力[4]。这种差异与TM菌载量密切相关——qPCR检测显示HIV感染者组织菌载量可达10^5 copies/mg,而局限性感染常<10^3 copies/mg[5]。
(2) 特殊染色技术:
六胺银染色(GMS):通过还原银盐使菌体细胞壁黑色着色,能清晰显示TM特征性的腊肠样形态和横隔(分裂繁殖标志),灵敏度达98.7%[6]。
PAS染色:真菌细胞壁多糖与Schiff试剂反应呈紫红色,与组织背景对比鲜明,特异性91.5%[7]。
二者联合应用可相互验证,避免因切片厚度、菌量等因素导致的假阴性。本病例中,两种染色均显示巨噬细胞内大量菌体,为确诊提供直接证据。
(3) 鉴别诊断体系:
建立"形态学-染色-临床"三联鉴别流程:
① 与结核鉴别:抗酸染色阴性+TM特征性菌体形态。
② 与组织胞浆菌病鉴别:GMS显示TM菌体更大(2-4μm vs 1-2μm)且有横隔。
③ 与利什曼原虫鉴别:PAS染色TM呈均匀紫红,而非利什曼原虫的动基体结构。
4.3 治疗策略优化
儿童TM感染的治疗需考虑两性霉素B的肾毒性风险。本例采用"阶梯式治疗"方案:
(1)诱导期:两性霉素B脂质体(3mg/kg/d)静脉滴注,通过脂质载体降低肾小管毒性,监测血钾、镁水平。
(2)巩固期:伏立康唑口服液(9mg/kg q12h),利用其高组织穿透性清除淋巴结内残留菌体。
(3)免疫调节:补充γ-干扰素(50μg/m2,每周2次)增强Th1型免疫应答[8]
4.4 公共卫生意义
广东省作为TM自然疫源地,竹鼠携带率高达70%[9]。本例患儿虽无明确啮齿动物接触史,但提示需要:
(1)加强基层医生培训:将TM纳入儿童不明原因淋巴结肿大的常规鉴别诊断。
(2)优化实验室检测流程:推荐病理科对所有肉芽肿性淋巴结炎常规进行GMS/PAS染色。
(3)建立区域监测网络:对非HIV的TM感染病例进行基因测序,追踪潜在新发变异株。
警示:
在华南地区(广东、广西等TM流行区),对反复淋巴结肿大伴发热、贫血的儿童,即使无HIV感染,需警惕TM感染可能。病理检查中联合应用GMS/PAS染色是快速确诊的关键技术[7]。
*本文(包括图片)均为作者投稿, 仅供行业交流学习用,不作为医疗诊断依据。
参考文献
[1] Vanittanakom N, Cooper CR, Fisher MC, et al. Penicillium marneffei infection and recent advances in the epidemiology and molecular biology aspects. Clin Microbiol Rev. 2006;19(1):95-110.
[2] 朱彤. PAS联合六胺银染色诊断局限性马尔尼菲青霉菌感染的应用. 热带医学杂志. 2012;12(8):945-947.
[3] 蒋显勇, 王柏秀, 陈晓利, 等. 马尔尼菲蓝状菌感染5例临床及实验诊断分析. 湘南学院学报(医学版). 2020;22(3):29-31.
[4] Qiu Y, Zhang J, Liu G, et al. Retrospective analysis of 14 cases of disseminated Penicillium marneffei infection with osteolytic lesions. BMC Infect Dis. 2015;15:47.
[5] Wong KF. Marrow penicilliosis: a readily missed diagnosis. Am J Clin Pathol. 2010;134(2):214-218.
[6] Sirisanthana T, Supparatpinyo K, Perriens J, et al. Amphotericin B and itraconazole for treatment of disseminated Penicillium marneffei infection in human immunodeficiency virus-infected patients. Clin Infect Dis. 1998;26(5):1107-1110.
[7] 李胜涛, 徐桂珍, 史文元. 儿童马尔尼菲青霉感染1例. 检验医学与临床. 2013;10(11):1370-1371.
[8] 李昕, 吴易, 莫冬冬, 等. 马尔尼菲青霉感染及局部Th1型细胞免疫功能的研究. 中华皮肤科杂志. 2013;46(3):181-183.
[9] Li X, Yang Y, Zhang X, et al. Isolation of Penicillium marneffei from soil and wild rodents in Guangdong, SE China. Mycopathologia. 2011;172(6):447-451.
[10] 郭鹏豪, 等. MALDI-TOF MS自建库在马尔尼菲篮状菌快速鉴定中的应用. 中国真菌学杂志. 2021;16(4):229-233.
猜你喜欢
- Phytomedicine:千年古方新突破!抵当汤双重调节肠道与大脑,助力 2 型糖尿病认知障碍治疗
- 基于全科医生视角的家庭医生团队签约现状调查研究
- 需要特别关注的“特殊人群”甲亢
- 最减肥的运动是什么?运动减肥的最好方法是什么?
- 论文解读| Bowen Yang/ Yunpeng Liu教授团队揭示CXCR3和CCL18在肝细胞癌免疫原性死亡中的关键作用
- 论文解读|Li Zhuo教授团队总结mTOR信号通路在糖尿病肾病中的研究进展及治疗潜力
- 4年疯狂健身变身宅男女神,撩到韩国小哥却被网友骂
- 医保目录再升级,受益人群再扩大
- 我国疾病控制中心流行病学首席专家吴尊友:效仿北京市工作经验解决突发性疫情
- 【病例报告】经颅多普勒超声检测颅内动脉特殊结构三例
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)