首页 > 医疗资讯/ 正文
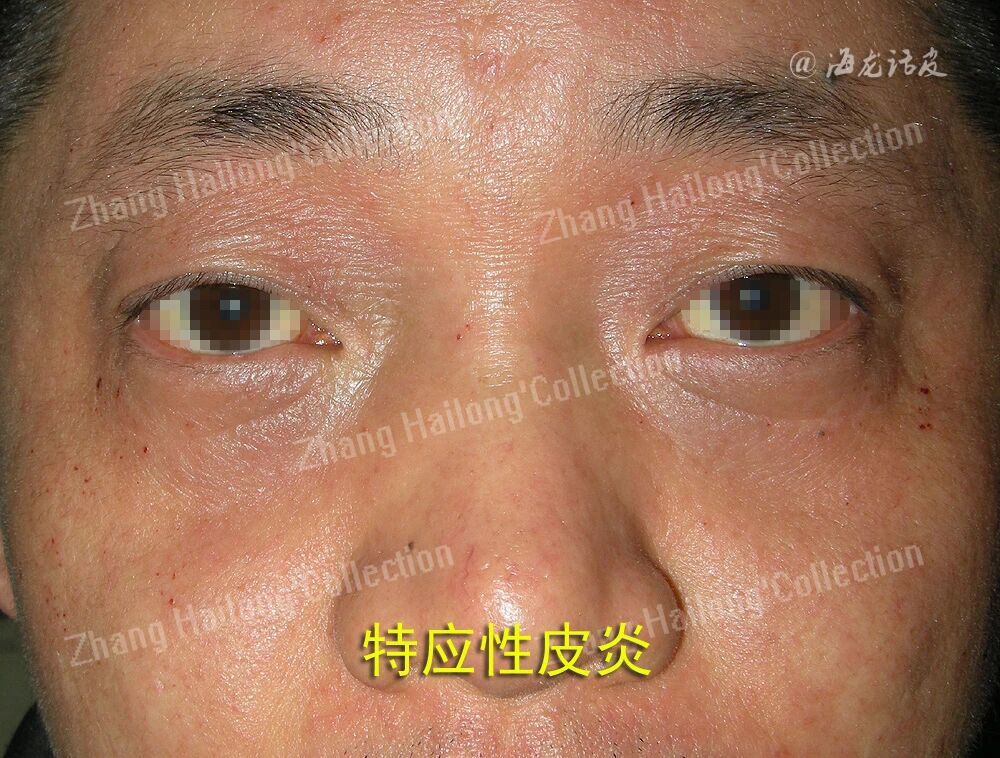
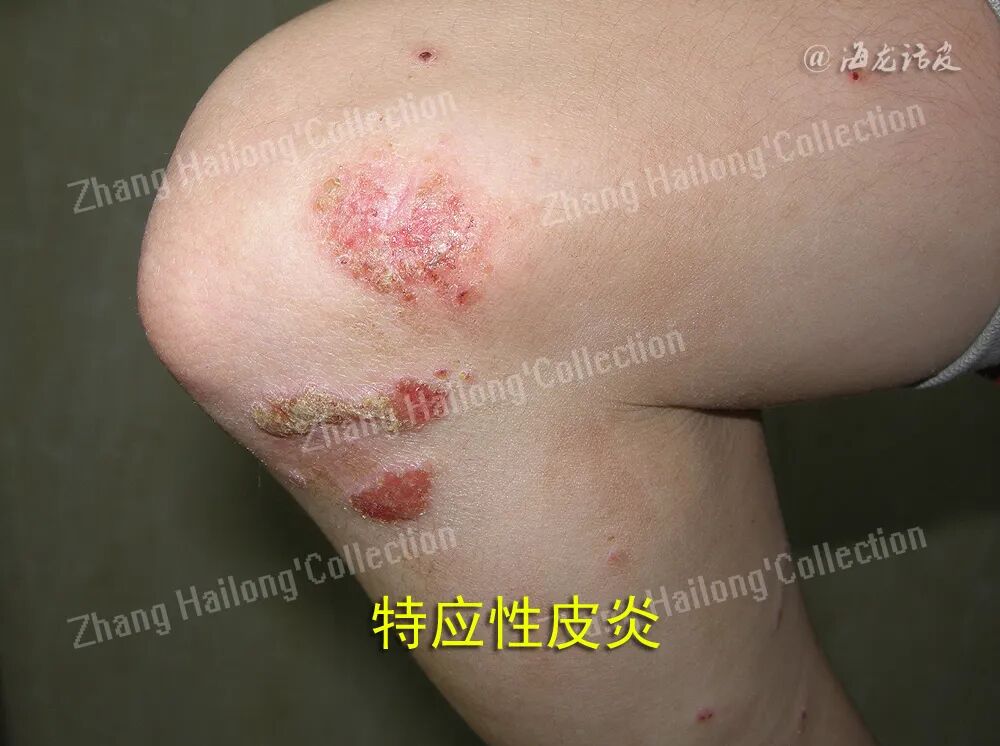
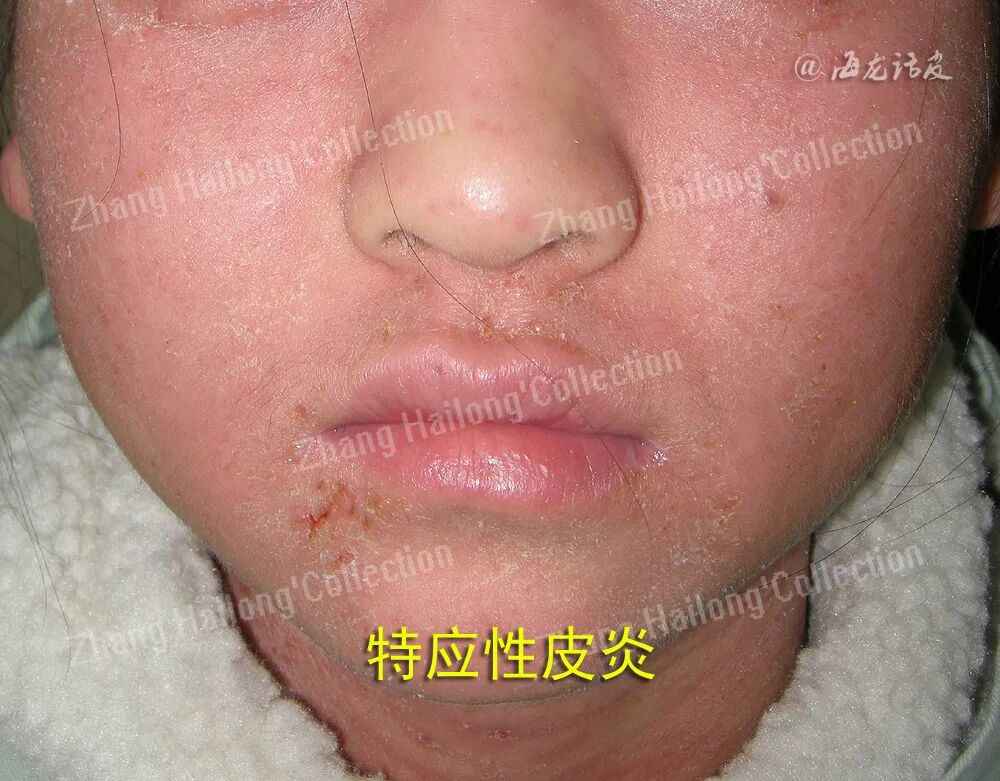
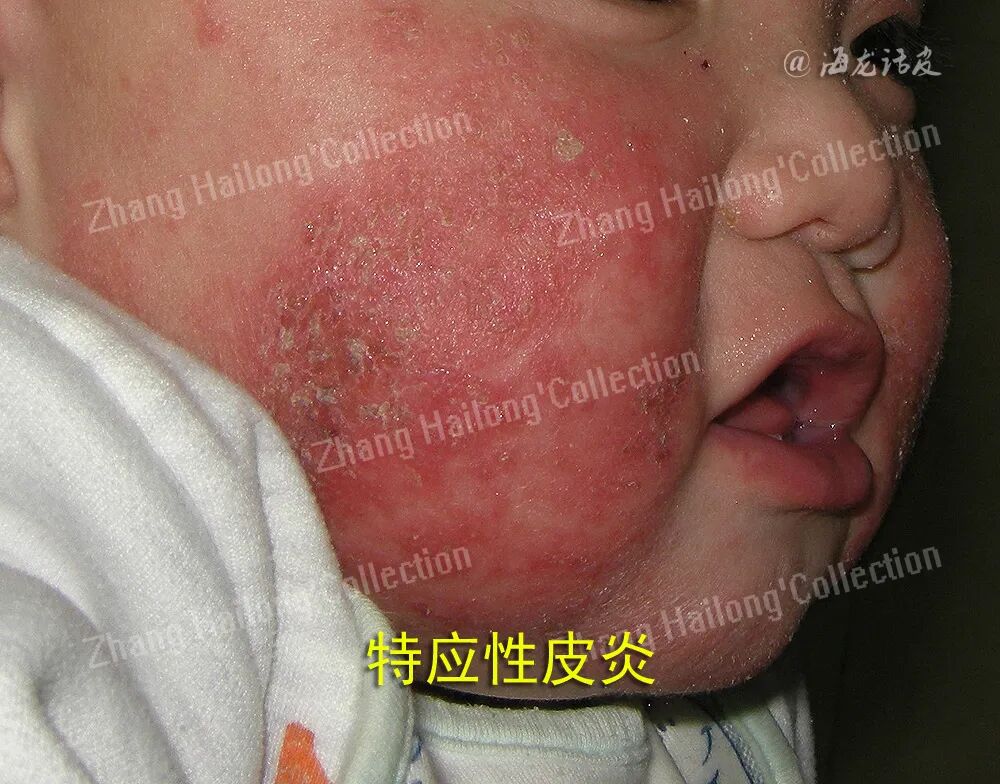
特应性皮炎(atopic dermatitis,AD)是一种慢性、炎症性皮肤疾病,其典型症状主要包括瘙痒、皮肤干燥、湿疹样皮损以及皮肤的增厚(苔藓样变)。患者常因为瘙痒抓挠而出现继发性皮损,甚至出现渗液和结痂。近年来研究表明,神经免疫交互作用、皮肤屏障功能障碍在特应性皮炎瘙痒中起关键作用。
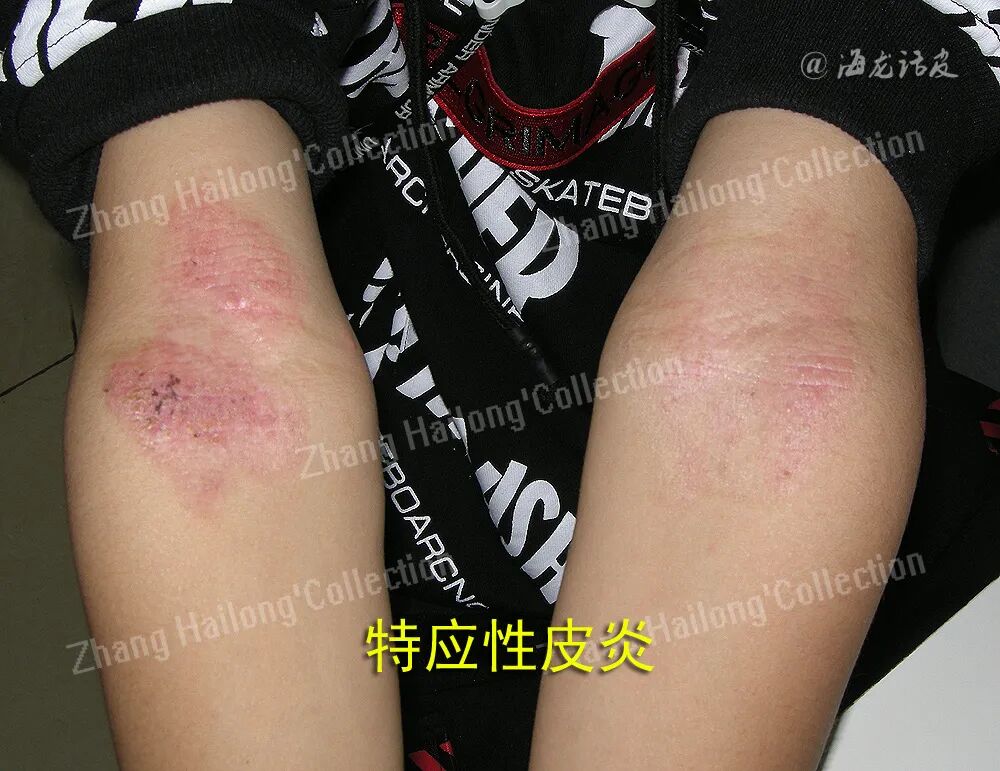
神经免疫失衡在AD瘙痒中的作用
1、外周神经离子通道在AD瘙痒中的作用
瘙痒感觉的神经传导机制涉及多种离子通道。研究表明,瞬时受体电位(transient receptor potential,TRP)通道如TRPV1、TRPA1等以及电压门控钠(NaV)通道、钾(K+)通道共同参与瘙痒信号的传导过程。这一传导通路具有重要的生理保护意义,可使机体在皮肤屏障受损前及时感知并规避环境中的潜在伤害。从分子机制来看,瘙痒信号的传导始于感觉神经元膜上特定受体与配体的结合,随后通过TRP通道等阳离子通道的开放引发膜去极化。当去极化达到阈值时,电压门控钠通道被激活,产生动作电位。初级感觉神经元胞体主要分布于三叉神经节和背根神经节,其中三叉神经节负责接收头颈部区域的信号,背根神经节则负责接收躯干和四肢的信号。
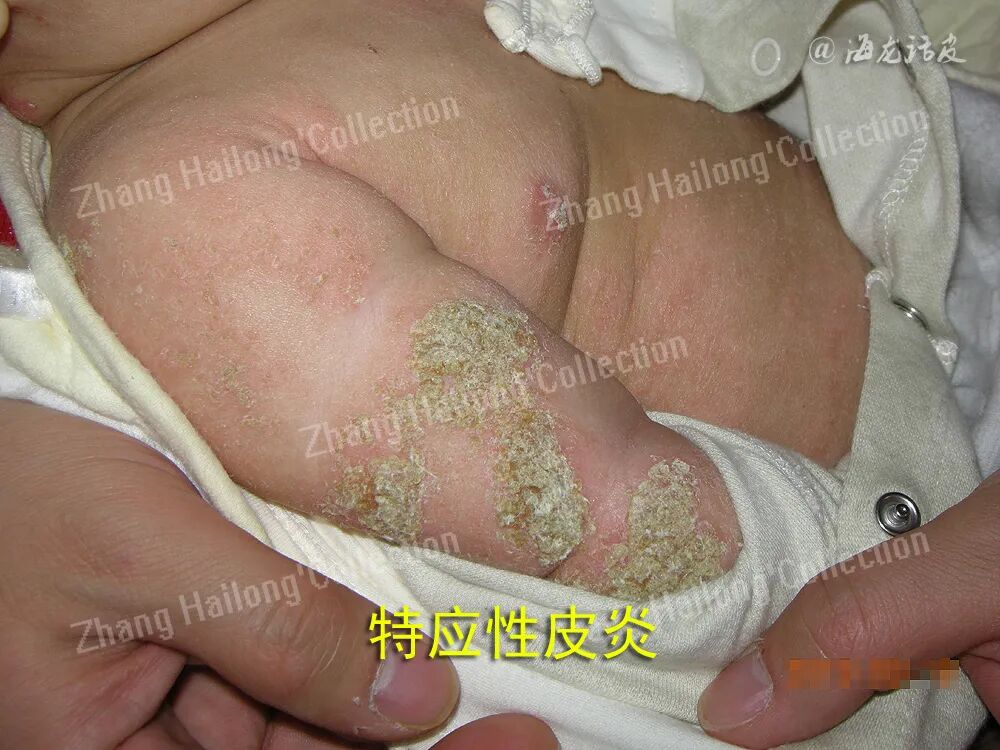
这些假单极神经元具有独特的双投射结构:其外周轴突延伸至皮肤组织,中枢轴突则投射至脑干和脊髓。 感觉信息在脊髓和脑干进行初步整合后,经上行传导通路最终到达大脑皮层,完成瘙痒感觉的感知过程。表皮中的TRP通道激活在AD瘙痒中亦有重要作用,如表皮中TRPV3通道偶联蛋白酶激活受体2介导胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin,TSLP)释放,参与神经源性炎症和影响皮肤屏障功能,在AD瘙痒的发生和维持中发挥重要作用。
2、2型免疫细胞在AD瘙痒中的作用
肥大细胞:肥大细胞在AD瘙痒中起重要作用。肥大细胞通过释放组胺、五羟色胺、细胞因子(IL-4、IL-13、IL-31)、脂质代谢产物、丝氨酸蛋白酶等多种介质,直接或间接激活外周神经末梢,引发瘙痒。在AD患者的皮肤活检组织中,TRPA1在真皮传入神 经和肥大细胞中的表达显著增强,而在健康受试者的皮肤中则没有这种表现。 这一发现提示特应性皮炎慢性瘙痒中的一种新的神经免疫学机制,强调了TR-PA1(+)真皮传入神经和TRPA1(+)肥大细胞在Th2为主的炎症环境中潜在的细胞分子互作机制。 此外,Nc/Nga小鼠是一种自发瘙痒的动物模型,在普通环境下饲养时会出现红斑、皮肤干燥、糜烂等类似人类特应性皮炎(AD)的表现,并伴有自主搔抓行为。糜蛋白酶是肥大细胞脱颗粒的关键介质,其抑制剂通过减少肥大细胞释放组胺、类胰蛋白酶等致痒因子,阻断肥大细胞与感觉神经(如P物质、神经生长因子通路)的交互作用,使皮损区神经生长因子表达降低,PGP9.5+神经纤维密度降低。口服糜蛋白酶抑制剂可改善Nc/Nga小鼠的自发性皮炎和搔抓行为,该结果证明抑制肥大细胞活化能阻断其介导的神经免疫信号传递,从而缓解瘙痒。
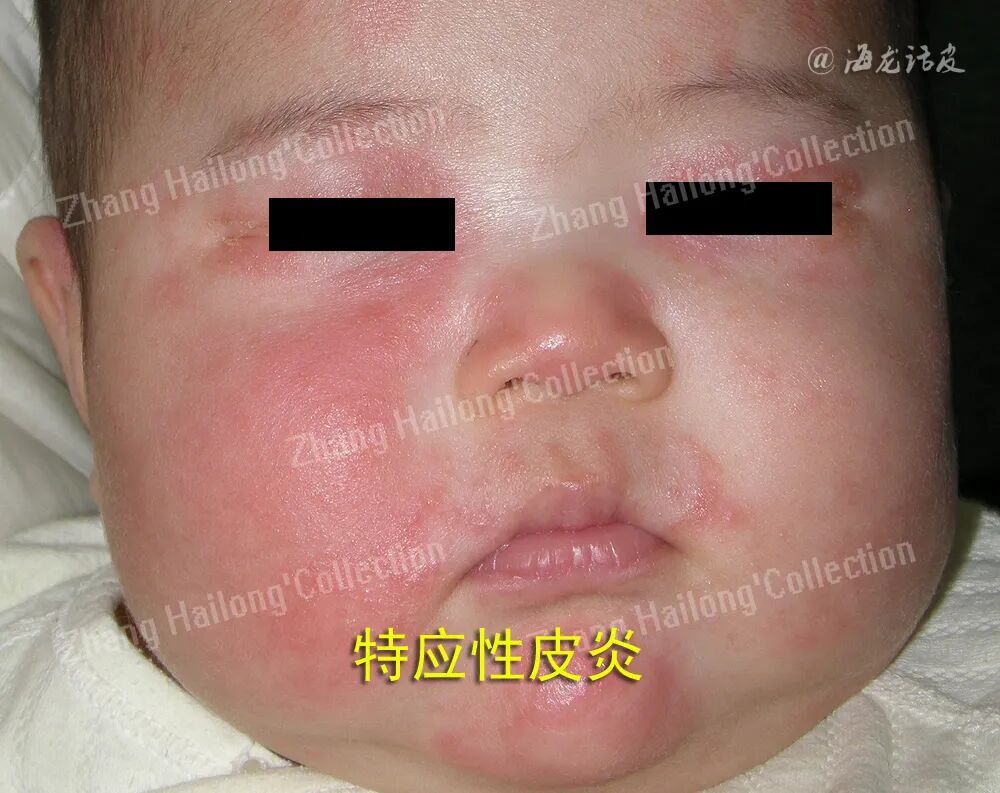
Th2细胞:AD通常伴随以Th2细胞为主的免疫反应,T细胞的发育驱动急性AD,并发展为具有Th1/Th2/Th17显性特征的慢性皮炎。在AD的初始阶段,Th2细胞被特异性激活,大量分泌白细胞介素(interleukin,IL),如IL-4、IL-5和IL-13 等特征性细胞因子。 其中,IL-4和IL-13通过激活JAK-STAT信号通路,诱导B细胞发生类别转换,产生特异性IgE抗体,从而启动I型超敏反应。Th2细胞的活化不仅促进了免疫反应,还通过分泌IL-13等因子影响皮肤的屏障功能。这种屏障功能的损害使表皮经皮水分丢失增加,对外界变应原和刺激物的敏感性显著升高。此外,Th2细胞通过分泌趋化因子(如CCL17、CCL22)募集嗜酸性粒细胞、肥大细胞等炎症细胞至皮损部位,形成局部炎症微环境。这些效应细胞释放的组胺、蛋白酶等介质进一步加重炎症反应,形成恶性循环,导致AD病情的持续进展。
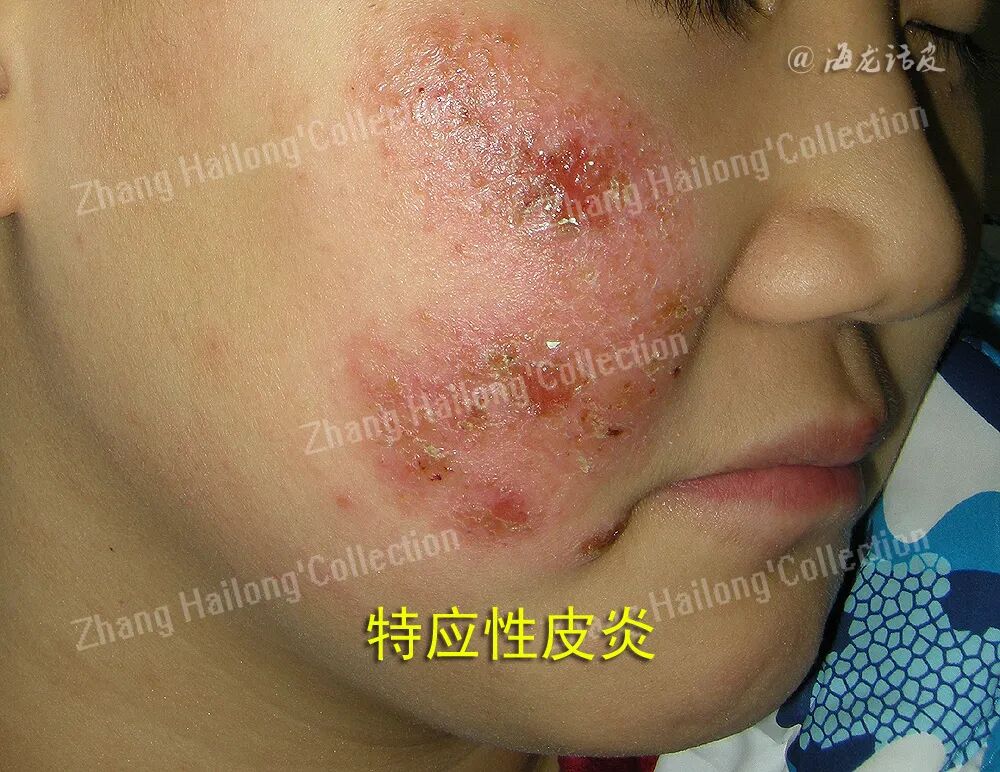
M2巨噬细胞:在AD的病理过程中,M2型巨噬细胞通过多种机制参与瘙痒的发生和发展。首先,AD患者的M2巨噬细胞处于过度活化状态,其不仅高表达基质金属蛋白酶12(matrix metalloproteinases,MMPs),而且对Th2型细胞因子IL-4和IL-13的刺激表现出更强的MMP12上调反应。MMP12作为重要的蛋白酶,可能通过降解皮肤屏障相关蛋白或激 活瘙痒相关受体,间接促进瘙痒的发生。更重要的是,M2型巨噬细胞在AD瘙痒中发挥直接作用。研究发现,AD皮损组织中存在大量IL-31+细胞群体,其中主要亚群为同时表达CD68(泛巨噬细胞标志物)和CD163(M2型巨噬细胞特异性标志物)的细胞。IL-31是近年来发现的关键致痒因子,其通过与感觉神经元上的IL-31受体结合,直接激活瘙痒信号通路。在MC903诱导的小鼠AD模型中,采用抗IL-31受体α(IL-31RA)抗体阻断IL-31信号通路可选择性清除巨噬细胞,显著减轻模型小鼠的搔抓行为,这一发现证实了M2巨噬细胞通过产生IL-31在AD瘙痒中的关键作用。
嗜碱性粒细胞:嗜碱性粒细胞是一种循环免疫细胞,能促进过敏性皮肤炎症。在AD模型的背景下,嗜碱性粒细胞被系统激活并导致免疫失调。在炎症过程中,嗜碱性粒细胞和IL-4通过作用于角质细胞分化促进表皮增生和皮肤屏障功能障碍。IL-4和嗜碱性粒细胞衍生的巨噬细胞集落刺激因子抑制皮肤中促炎细胞的积累,同时促进M2型巨噬细胞的扩张和功能以及原屏障基因的表达。抓挠小鼠皮肤中嗜碱性粒细胞依赖性IL-4表达的快速上调,且这一过程依赖于嗜碱性粒细胞的存在,表明嗜碱性粒细胞在皮肤损伤后的炎症反应中起关键作用。
3、AD瘙痒中外周神经系统与免疫系统相互作用
AD皮肤内的感觉神经元与免疫细胞之间形成了复杂的双向交互网络,这种神经-免疫相互作用在AD的瘙痒和炎症中起关键作用。已有研究证明TSLP通过激活感觉神经元上的TRPA1通道介导瘙痒行为,为AD的神经免疫机制提供了重要证据。 进一步的研究表明,感觉神经元中的IL-4Rα和JAK1信号通路在慢性瘙痒中起核心作用,删除这些分子可显著缓解瘙痒症状,凸显了神经元回路在AD病理中的重要性。神经肽在这一交互网络中起关键介导作用。神经肽由DRG神经元合成,并储存在皮肤神经末梢的囊泡中。当神经末梢被激活时,释放的神经肽,如神经递质P物质(substance P,SP)和降钙素基因相关肽(calciton gene related peptide,CGRP)不仅直接作用于免疫细胞,还刺激角质形成细胞产生神经生长因子。神经生长因子进一步促进角质形成细胞增殖,并通过逆行信号增强DRG神经元的神经肽合成,形成正反馈环路。在免疫调节方面,神经肽通过将神经信号转化为免疫细胞可识别的化学信号,加剧炎症反应。例如,CGRP广泛分布于外周和中枢神经系统,而SP作为速激肽家族成员,可直接诱导肥大细胞脱颗粒,释放组胺和蛋白酶等致痒介质。在真皮乳头层,CGRP与SP共存的薄髓或无髓感觉神经纤维通过释放这些神经肽,直接参与瘙痒信号的传递和炎症反应的放大。
皮肤屏障功能障碍在AD瘙痒中的作用
1、皮肤屏障受损机制
皮肤屏障功能障碍是AD发病的核心机制之一。正常皮肤屏障由角质层和细胞间脂质共同构成,能防止水分丢失及外界过敏原、微生物入侵。然而,在AD患者中,屏障功能受损导致经皮水分流失增加、皮肤干燥和瘙痒加剧,同时外源刺激易渗透,激发免疫炎症反应,并促进金黄色葡萄球菌等病原菌定植,进一步恶化病情。 这一过程涉及角质层结构异常(如丝聚蛋白缺失)、脂质代谢紊乱(神经酰胺减少、磷脂代谢异常)、皮肤水分动态失衡,以及皮肤微生态紊乱等多个病理因素,协同加剧AD的炎症与瘙痒表现。
2、角质形成细胞分泌的细胞因子在瘙痒中的作用
IL-33在AD患者的血清水平明显高于其他皮肤疾病患者。它作为预警素在AD患者的角质形成细胞中过度表达。当细胞受到病原微生物攻击或炎症刺激时在细胞内大量合成,在以角质形成细胞和成纤维细胞表达为主,作用于免疫细胞介导炎症反应的发生。IL-33通过刺激2型先天淋巴样细胞并产生2型细胞因子如IL-5和IL-13。IL-33还能直接刺激背根神经节的ST2受体,触发瘙痒行为。并诱导肥大细胞释放组胺和蛋白酶等致痒介质,直接参与瘙痒信号的传递。
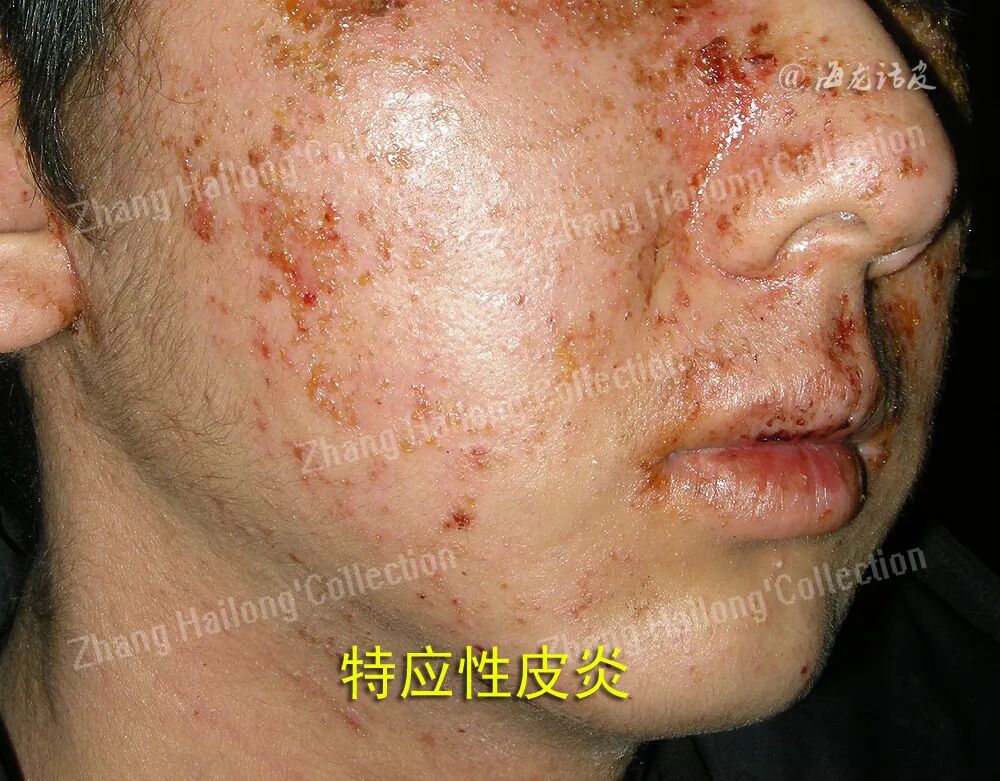
TSLP在AD中不仅通过免疫途径发挥作用,还直接刺激感觉神经元触发瘙痒。研究发现,TSLP受体在小鼠和人类背根神经节细胞中表达,并且TSLP注射到小鼠皮肤后能诱导依赖于IL-7Rα和 DRG的抓挠行为。TSLP激活感觉神经元需要TRPA1通道的激活,但与TRPV1无关。TSLP诱导的神经元激活导致脊髓中持续信号传导,促进中枢敏化。这种机制通过增加突触可塑性、上调致痒介质和改变背角的抑制性神经传递,导致AD瘙痒的长期存在。
IL-25主要由上皮细胞产生,它可以激活Th2细胞产生IL-4、IL-5和IL-13等2型细胞因子。在卵清蛋白诱导的AD小鼠模型中,IL-25能够导致小鼠表皮增厚,并促进小鼠血清IgE、IL-4、IL-5、IL-13的含量增加。既参与了Th2细胞因子免疫反应的启动和维持,也作用于表皮角质形成细胞,抑制FLG和防御素β2抗体的表达,促进棘层增生,导致皮肤屏障功能异常,加重AD的瘙痒。
除了细胞因子,越来越多的研究表明,趋化因子也有促进瘙痒的功能。CXCL10是一种调动T细胞和树突状细胞募集的趋化因子。CXCL10已被证明在AD患者的皮肤病变中表达。尽管在幼年小鼠中皮内注射CXCL10被证明缺乏唤起抓痒行为的能力,但CXCL10通过CXCR3直接激活了DRG的神经元,这表明炎症条件可能促进对CXCL10 的过敏反应,将其从非致痒分子转化为致痒信号。有研究证实CX-CL10对慢性瘙痒的贡献还依赖于中性粒细胞。这提示除了2型免疫细胞之外,其他细胞的募集在AD瘙痒的发展中可能也发挥重要作用。趋化因子可能以一种保守和协调的方式发挥作用,将免疫细胞吸引到组织中,从而调节神经元对趋化因子本身的反应。
感染与AD瘙痒
在AD中,皮肤微生物群失衡导致金黄色葡萄球菌(S.aureus)等致病菌过度增殖并高表达毒力因子。 这些菌群通过破坏皮肤屏障、释放毒素及激活Th2型免疫反应加剧炎症,进一步削弱宿主防御功能,使AD患者更易继发细菌、真菌及病毒感染。
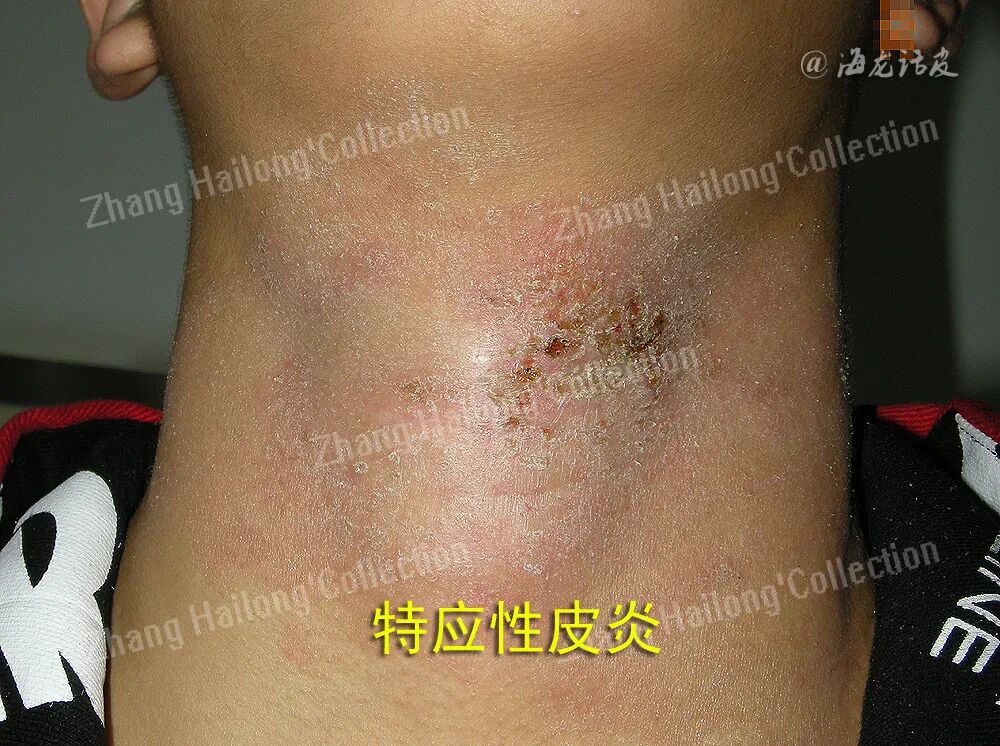
金黄色葡萄球菌已被明确证实可加重AD,其机制包括:破坏皮肤屏障功能并加剧免疫失调,导致疾病反复发作;通过IL-36/MYD88/IL-36R信号轴驱动皮肤炎症;分泌丝氨酸蛋白酶V8,直接激活感觉神经元上的蛋白酶激活受体1(PAR1),诱发瘙痒和皮肤损伤。近期研究进一步揭示V8-PAR1轴在AD瘙痒中的关键作用,在AD小鼠模型中发现V8通过切割PAR1激活感觉神经元,触发自发性瘙痒和炎症反应。基因敲除、siRNA沉默或药物抑制PAR1可显著缓解V8及金黄色葡萄球菌诱导的瘙痒和皮肤损伤,提示靶向该通路治疗AD瘙痒的潜力。
马拉色菌作为一种亲脂性酵母菌,其生长繁殖高度依赖皮肤表面的脂质成分。皮脂成分改变和屏障功能障碍,为马拉色菌的黏附定植创造了有利条件。在AD患者中,甘油三酯含量显著降低,并与疾病严重程度呈现负相关。甘油三酯是马拉色菌的主要营养来源,其含量减少可能导致菌群代谢活性改变,进而促进炎症反应。此外,研究还发现AD患者皮脂中其他脂质成分的比例失调,这些变化共同构成 了有利于马拉色菌过度生长的微环境。马拉色菌可通过多种途径激活免疫系统:一方面,其胞壁成分如β-葡聚糖可激活Th1通路;另一方面,其分泌的蛋白酶等抗原物质可促进Th2和Th17反应。临床观察显示,马拉色菌过度生长的区域往往伴有剧烈瘙痒,这提示马拉色菌可能通过诱导IL-31产生而参与AD瘙痒的发生机制。
目前关于病毒在AD发病机制中的作用研究较少,但已有证据表明疱疹病毒等病原体可能参与AD的进程。AD患者因皮肤屏障功能缺陷更易感染疱疹病毒,进而诱发疱疹性湿疹。研究发现,疱疹病毒感染可导致AD患者免疫应答失衡:II型免疫反应增强(表现为IL-4分泌显著升高及抗病毒反应亢进),而I型免疫反应则受到抑制。这些发现对于AD与菌群的关系有了更深一步的认识,为抗瘙痒治疗提供了新的思路。
AD瘙痒的临床治疗
首先,外涂润肤剂是AD瘙痒缓解的基础治疗,主要功能是抑制水分流失。当皮肤屏障受损时,润肤剂为干燥的皮肤提供水分。此外,保湿剂通过阻止水分的蒸发,有助于保持和恢复皮肤的弹性,并诱导老化的死皮细胞均匀脱落,保持皮肤表面光滑,从而减轻瘙痒。润肤剂主要通过四个步骤起效:油性成分在皮肤上形成一层薄膜;皮肤水分分布系数变化;水分从真皮层向表皮扩散;水分向表皮的分布受皮肤脂质合成和细胞间脂质分泌控制。
药物治疗方面主要概括为局部治疗、传统系统治疗及新型靶向药物治疗。传统治疗药物仍然是临床主要的治疗方案。局部糖皮质激素是治疗瘙痒的常用药物,尤其优势在于使用方便且不良反应相对较少,适合轻度至中度瘙痒患者。然而,长期使用可能会导致皮肤萎缩、毛细血管扩张等不良反应。局部钙调神经抑制剂,如他克莫司和吡美莫司,通过抑制T细胞的活化和炎症介质的释放,减轻皮肤炎症反应,从而有效缓解瘙痒症状,且不会产生糖皮质激素相关的不良反应。
克立硼罗是一种选择性磷酸二酯酶4(PDE4)的非甾体抑制剂,通过抑制环磷酸腺苷的分解,从而抑制多种炎症细胞因子,如TNF-α、前列腺素E2等,有效减轻AD的多种炎症反应。新型生物制剂在AD瘙痒的临床治疗中展现出显著疗效,其作用机制和临床效果已通过多项研究得到验证。度普利尤单抗是一种靶向IL-4受体α亚基的单克隆抗体,通过抑制IL-4和IL-13的信号传导,阻断Th2 型免疫反应。临床试验表明,度普利尤单抗可显著改善AD严重程度评分(EASI),从治疗第8周开始持续改善。第16周时,嗜酸性粒细胞水平显著升高,至第48周恢复至基线水平,同时乳酸脱氢酶和IgE水平显著下降。奥马珠单抗通过结合游离IgE,阻断其与肥大细胞和嗜碱性粒细胞表面FcεRI受体的结合,从而抑制IgE介导的过敏反应。
奥马珠单抗不仅降低游离IgE水平,还可下调循环嗜碱性粒细胞和树突状细胞的FcεRI表达,减少其被过敏原激活的能力。JAK抑制剂通过阻断JAK-STAT信号通路,抑制IL-4、IL-13等细胞因子的信号传导,从而减轻炎症和瘙痒。乌帕替尼与阿布昔替尼均为选择性JAK1抑制剂,乌帕替尼30mg在96周内显示出持续的疗效,而15mg剂量在36周后疗效略有下降。而阿布昔替尼在12周时,接受100mg和200mg剂量的患者IGA成功率分别为28.4%和38.1%,而安慰剂组为9.1%。对于中重度AD患者的治疗均有显著效果。
艾莫特利单抗是一种靶向OX40配体(OX40L)的全人源单克隆抗体,通过阻断OX40-OX40L信号通路抑制T细胞活化,从而调节Th1/Th2/Th17/Th22等多种炎症反应。目前处于治疗中重度AD的临床III期阶段。其非耗竭性机制(不耗竭T细胞)可能减少长期治疗的不良反应。在AD的IIb期试验(STREAM-AD)中,患者第16周湿疹面积和严重程度指数(EASI)改善61.5%,24周持续改善,最高剂量组IGA0/1应答率达45.5%,且耐受性良好。
曲罗芦单抗是一种特异性靶向IL-13的单克隆抗体,通过阻断IL-13信号通路,减轻Th2型炎症反应。在28周的治疗期间,曲罗芦单抗显著降低疾病严重程度相关蛋白(如TARC/CCL17和PARC /CCL18)和总IgE水平。达到EASI≤7和瘙痒评分(NRS)≤4的患者比例分别为75.8%和51.4%,但该药物目前尚未在中国上市,目前仅在美国、欧盟等地获批用于治疗成人和12岁及以上儿童的中重度AD。
Tradipitant作为一种神经激肽-1受体(NK-1)拮抗剂,通过抑制P物质介导的瘙痒信号来减少AD相关的瘙痒,对AD瘙痒具有混合作用。通过随机临床试验发现,在8周的治疗期间,所有患者对Tradipi-tant的耐受性良好,但对于严重的瘙痒没有明显的改善。然而,在轻度AD的患者中,观察到Tradipitant具有快速的止痒效果。Tradipitant可能成为一种轻度AD患者的新型口服治疗方法。
展望
由于AD瘙痒的异质性,不同亚组患者对上述治疗方法的疗效存在差异。整合基因、转录组和神经免疫特征的生物标志物驱动方法,有助于制定针对个体瘙痒症亚型的精准医疗策略。目前针对AD瘙痒的 全身性和局部治疗手段仍然有限。未来开发针对瞬时受体电位通道(如TRPV1、TRPV3、TRPA1)、G蛋白受体MrgprX2以及新型神经免疫通路的选择性抑制剂,有望为更有效和更具针对性的止痒疗法带来希望。通过填补这些研究空白,未来的研究能够增进对AD相关瘙痒症的理解,并为改善患者预后的创新治疗策略铺平道路。
参考文献:
1.孙静怡,高明萱,姚新宇,周灵萱.特应性皮炎瘙痒机制研究进展[J].中国麻风皮肤病杂志,2025,10(41):765-770.
2.徐若馨,黎静宜.神经递质受体介导特应性皮炎免疫紊乱机制的研究进展[J].中国麻风皮肤病杂志,2025,41(1):73-78.
3.赵嘉惠,杨孜冉,赵作涛,等.肥大细胞参与皮肤瘙痒的机制[J].中华临床免疫和变态反应杂志,2021,15(4):454-459.
4.其他文献略。
猜你喜欢
- European Radiology:基于MRI胎儿眼部影像学参数的人工智能辅助
- Int Wound J:白藜芦醇对促进皮肤伤口愈合、减小疤痕、延迟皮肤老化
- 徐海峰:保险业扶贫首先要充分发挥保险的基本作用
- 夏日当心游泳病
- 宫寒可以吃糖葫芦吗?女生吃糖葫芦的坏处
- Hypertension:中年到老年期间维持正常血压的临床意义
- Int Forum Allergy Rhinol:预测慢性鼻窦炎伴鼻息肉患者使用度普利尤单抗处方的真实世界因素
- 3种食物与醋一起食用,养生价值高
- 西方国家为何争相认可中国疫苗?(环球热点)
- Int J Urol:阴茎癌患者复发率和生存率的真实世界数据:肿瘤分期作为无病生存的预测因子
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)