首页 > 医疗资讯/ 正文
摘 要
国际肺癌研究协会(International Association for the Study of Lung Cancer,IASLC)于近期正式发布了第九版肺癌TNM分期。本次分期基于全新的数据库,涵盖2011—2019年间25个国家75个中心的124 581例肺癌患者的数据,在排除数据不完整的患者后,共纳入87 043例患者的资料,并基于此分析结果,对第八版肺癌TNM分期进行调整,更新成第九版肺癌TNM分期。此版中亚洲患者占比提升,中国患者占比增幅显著。第九版肺癌TNM分期将为肺癌诊治及预后评估提供更合理的参考依据。本文就IASLC第九版肺癌TNM分期标准的数据库更新、分期变化及其修订依据进行解读,为广大临床医生提供参考。
正 文
肺癌TNM分期是指导肺癌诊治及预后评估的重要依据,其发展历程可分为三个阶段。第一阶段(UICC版和AJCC版;1968—1986 年),1968 年国际抗癌联盟 (Union for International Cancer Control, UICC) 首次发布了癌症TNM分期指南[1]。随后1977 年美国癌症联合委员会( American Joint Committee on Cancer,AJCC)也发布了其第1版癌症TNM 分期,为美国医生提供实体癌诊疗参考[2]。此后,UICC版和AJCC版的TNM分期平行存在并各自更新。第二阶段(UICC/AJCC版,1987—2006 年):1987 年UICC和AJCC的TNM 分期合并统一,业内统称为UICC/AJCC癌症TNM分期,并于2002 年更新至第六版[3]。第三阶段(IASLC建议版,2007 年至今):国际肺癌研究协会(International Association for the Study of Lung Cancer,IASLC)于1997年成立了下属机构即分期和预后因素委员会(Staging and Prognostic Factors Committee,SPFC),旨在制定更科学合理的国际通用版肺癌TNM分期。该项工作得到癌症研究与生物统计学中心(Cancer Research and Biostatistics, CRAB)的协助,CRAB为其提供了巨量肺癌患者数据[4]。SPFC对这些数据进行了分析,并于2007年提出了修订TNM分类的系列建议[5-8]。这些建议被UICC和AJCC采纳并形成了第七版肺癌TNM分期。2015 年,IASLC根据1999—2010 年的77 156例有效肺癌患者的数据分析,更新了第八版肺癌TNM分期,即我们现今使用的肺癌分期标准[9-10]。
第八版肺癌TNM分期于2017 年1月1 日起正式施行,至今已有7 年。而近年来靶向治疗、免疫治疗等诸多治疗手段的创新和进步显著提高了肺癌患者预后。旧数据库中的资料难以反映当前状况,因此基于新数据库修订新版肺癌TNM分期势在必行。近期,IASLC《Journal of Thoracic Oncology》杂志上发布了全新版本(第九版)肺癌TNM 分期标准[11]。第九版分期与第八版分期的基本框架相同,第九版分期采用了近年来的病例进行分析,且增加了病例来源的多样性,尤其是大量增加了中国肺癌患者的临床数据。因此,第九版分期更贴近国人的临床现状。此外,第九版在N 分期、 M分期和TNM分期方面有多处更新,分期更科学,更符合肺癌患者预后的实际情况,为肺癌诊疗和预后评估提供重要依据。
1 第九版肺癌分期数据库
IASLC在2023 年2月发布了第九版肺癌分期数据库[12]。该数据库收集了2011 年—2019年期间来自25 个国家和75 个中心的124 581 例肺癌患者的临床资料。其中亚洲64 045 例(51.4%),欧洲30 827例(24.7%),北美洲19608 例(15.7%),澳洲5704 例(4.6%),中南美洲4225例(3.4%),非洲及中东172例(0.1%)[12]。排除不合格患者的临床资料后,纳入87 043 例有效患者的临床资料用于分析,其中浸润性腺癌52 069 例(59.8%),鳞状细胞癌15 872例(18.2%),原位腺癌1 142例(1.3%),腺鳞癌1 100例(1.3%),大细胞癌1 057 例(1.2%),小细胞癌5 530例(6.4%),大细胞神经内分泌癌689 例(0.8%)[12]。
第九版肺癌分期数据库的数据来源分为两种形式,分别是经过预处理的批量数据集和保留原始数据的病历电子数据采集(electronic data capture, EDC)系统。EDC系统支持投稿者在线提交及检索自身研究数据。该系统含有T分期、N分期及M分期的判定要素,以及在临床分期或病理分期中分类的具体理由[12]。相比批量数据集,EDC系统在实时性、准确性、可追溯性及灵活性等诸多方面具有显著优势,更适合用于临床研究数据的采集与传输。然而,由于传统习惯、成本考虑及法规要求等多重因素,第九版肺癌分期数据库中EDC所占比例仅为18.9%(23 548/124 581),大部分数据仍以批量数据集形式提交。四川大学华西医院作为国内重要的数据贡献方,共提供8 010例患者的数据,占总数据的6.4%(8 010/124 581),且全部为EDC数据,占数据库全部EDC病例的34.0%(8 010/23 548)[12]。
相较于第七版[4]或第八版数据库[10],第九版肺癌分期数据库有诸多改变(表1)。在收集时间方面,第九版肺癌分期数据库采用了2011 年后的临床数据,更准确地捕获了当前肺癌诊疗的现状。数据量方面,本次共计纳入124 581 例患者及87 043例患者的有效数据,皆创下历年之最。病例分布方面,亚洲患者所占比例稳步提升,自第七版的11.5%升至第八版的44.0%,第九版高达51.4%。其中,我国患者的比重显著增长,从第八版的0.8%升至第九版的12.1%,这意味着第九版肺癌TNM分期结果能更真实地反映我国肺癌患者的实际预后。然而,有效数据中小细胞肺癌的患者数由第七版的13 032例(16.0%,13 032/81 495)持续下降至第九版的5 530 例(6.4%,5 530/87 043)[4,12]。因此,第九版肺癌TNM分期数据库能否更准确反映小细胞肺癌预后仍需进一步观察。总的来说,新版数据库采用了近年肺癌患者的数据,并增加了患者来源的多样性,特别是我国肺癌患者例数大幅扩充。因此,第九版肺癌TNM分期数据库更科学合理的同时也更加符合我国的临床实际情况。
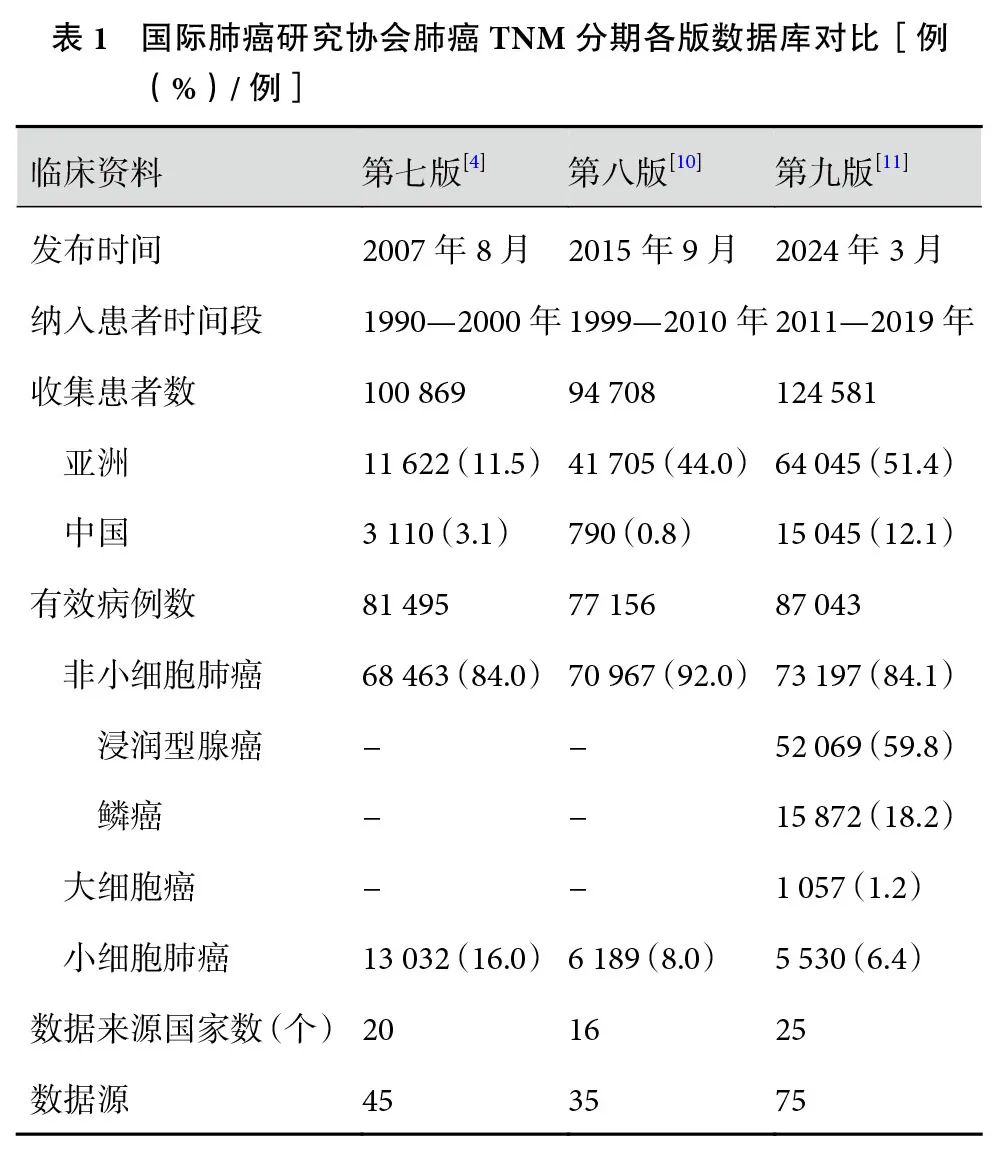
2 第九版肺癌TNM分期变化及其修订依据
2.1 T分期
T分期无改动(表2)。尽管第九版T分期的定义与前一版保持一致,但特别值得注意的是,SPFC就T3分期的不同亚型(侵犯胸壁的T3 与其他类型的T3)在预后方面的差异提出了深入的探讨。研究[13]发现,在病理分期中,pT3-侵犯胸壁组的患者预后显著差于pT3-其他类型组,甚至接近于pT4的预后情况。然而,这一预后差异在临床分期中并未得到体现,即cT3-侵犯胸壁组与cT3-其他类型组的患者在预后上并无明显差别。考虑到T3 分期在不同情境下(病理与临床)的预后差异性,第九版分期系统最终决定将侵犯胸壁或壁层胸膜的情况仍归类为T3,而并未升级至T4。我们列出了历次 IASLC 版 T 分期的演变情况(表3)。


在第九版肺癌TNM分期数据库分析结果的支持下,第九版T分期再次验证了第八版分期对肺癌患者预后评估的准确性,尤其是肿瘤最大径作为预后评估的关键因素。在近10 年的研究中,尽管我们对早期肺癌的异质性、生物学行为以及其他危险因素(如不良病理亚型、脉管癌栓、神经侵犯、气腔内播散等)有了更为深入的认识,但由于这些信息在临床治疗前的获取难度较大,因此在分期系统中的实际应用仍然有限,未能撼动肿瘤最大径在分期和预后评估中的核心地位。
2.2 N分期
新版N分期将原N2淋巴结转移细分为N2a(单站转移)及N2b(多站转移)(表2)。自2007 年IASLC首次发布第七版N分期[6]以来,该分期系统已在临床实践中广泛应用了16 年。尽管在2015 年,IASLC推出了第八版N分期[7],但其并未对第七版内容进行实质性修改。然而,随着医疗技术的不断进步和临床研究数据的积累,不少研究者呼吁对N分期进行更精细划分。第九版N 分期[15]基于对大规模临床数据的分析(包括45 032例临床N分期和35 009 例病理N分期)将N2 细分为N2a(单站转移)及N2b(多站转移)。
在N 分期的亚组分析中,研究者运用Kaplan-Meier生存分析法,对不同亚组分类间的5年生存率进行了深入评估。若所观察到的生存率差异小于5%,则该亚组分类被视为在临床上无显著意义[15]。为了更精确地揭示这些差异,研究者[15]进一步采用了多变量Cox比例风险生存模型来确定各亚组的风险比。在N分期的亚组分析中,研究者对N1a(单站N1)、N1b(多站N1)、N2a1(不涉及N1 的单站N2 或跳跃性转移)、N2a2(涉及N1 的单站N2)以及N2b(多站N2)进行了详尽的探索性分析。研究[15]结果显示,各个N1亚类之间的5 年生存率估计值差异以及N1 亚类与N2a1 之间的差异均较小,差异无统计学意义,并且在临床和病理分期上也未呈现出一致性。相比之下,N2亚组之间的差异有统计学意义。基于上述分析结果,第九版N分期决定维持对N0、N1、N3 的原有描述,仅对N2 进行细分,将其划分为N2a和N2b两个子类别[15]。这一调整旨在更准确地反映不同N2 亚组之间的生存率差异,并为临床实践提供更精准的分期指导。此外,我们列出了历次 IASLC 版 N 分期的演变情况(表4)。
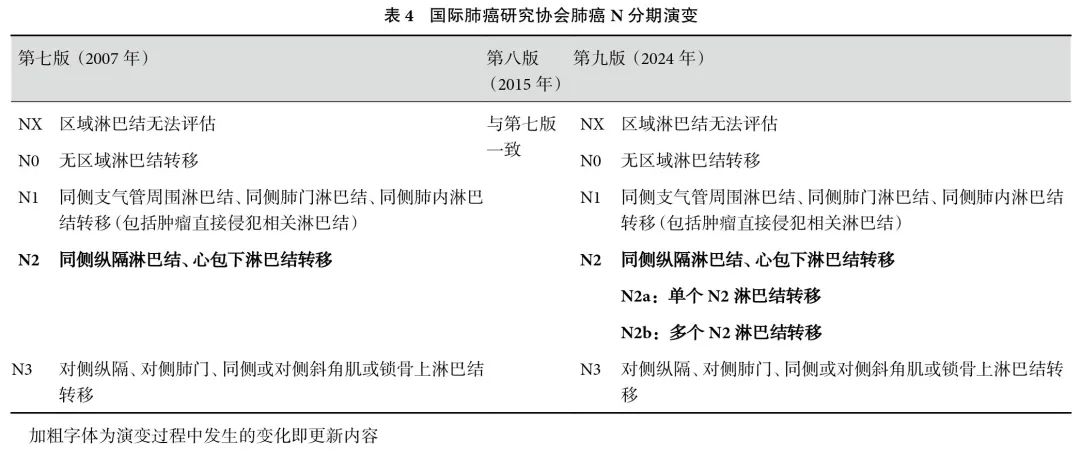
临床实践中,N分期对治疗方案的选择具有重要影响。单站与多站、融合与非融合、可切除与不可切除等因素都会直接影响治疗策略制定。过去,由于对此类患者划分不够精细,N2 患者的治疗模式存在混乱,包括诱导治疗后手术、根治性同步放化疗以及直接按晚期患者治疗等不同方法。新的TNM分期将单站N2患者单独分类,为临床医生提供了更为明确的指导,有助于实现局部晚期患者的细分和个体化治疗。对于临床医生而言,需在临床诊断期间提高正电子发射计算机断层扫描(PET-CT)、有创淋巴结活检等的使用率,以提高临床分期的准确性;对可切除或潜在可切除患者的谨慎评估,关乎外科手术在局部晚期肺癌中的参与度;对于手术患者,应规范淋巴结清扫的范围与质量控制,确保术后病理分期的准确性,以指导术后辅助治疗。
2.3 M分期
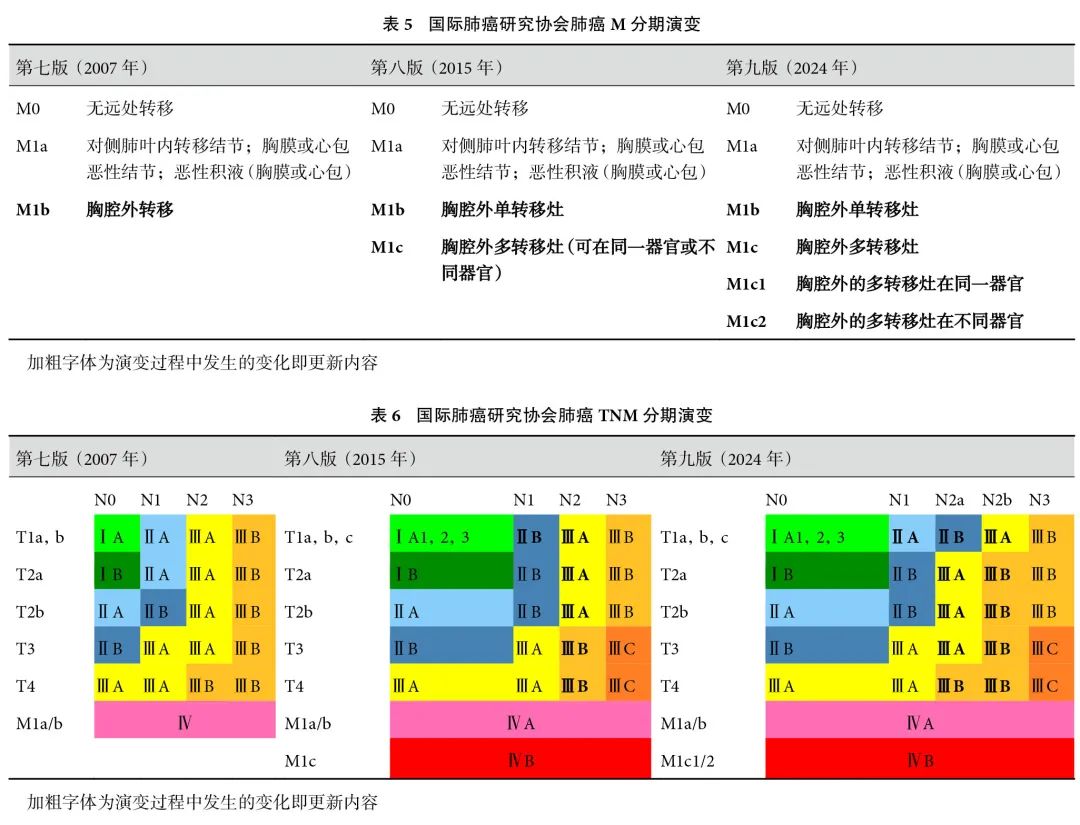
将原M1c(胸腔外多转移灶)细分为M1c1(胸腔外的多转移灶在同一器官)和M1c2(胸腔外的多转移灶在不同器官)(表2)。自2007 年IASLC首次发布第七版M分期[7]以来,M分期的修订重点在于深入探讨胸腔外转移情况。我们列出各版M分期演变情况(表5)。2015 年发布的第八版将第七版中的M1b(胸腔外转移)细分为M1b(胸腔外单转移灶)与M1c(胸腔外多转移灶)[16]。第九版将M1c(胸腔外多转移灶)进一步细分为M1c1(胸腔外的多转移灶在同一器官)和M1c2(胸腔外的多转移灶在不同器官)[11]。在M分期亚组分析中,研究人员[17]运用Kaplan-Meier生存分析法及多变量Cox比例风险生存模型探讨各M分期细分是否具有临床意义。结果显示,胸腔外多转移灶在同一器官(M1c1)的肿瘤患者生存结果[ 中位生存期1.0(0.9~1.0)年]介于胸腔外单转移灶(M1b)的肿瘤患者[ 中位生存期1.2(1.1~1.3)年]与胸腔外多转移灶在不同器官(M1c2)的肿瘤患者[ 中位生存期 0.6(0.6~0.7)年]之间,因此对M1c的细分有临床意义[17]。此外,研究者还对诸多M分期尚存困惑的情况进行了分析。临床中,部分恶性胸腔积液检测的细胞学结果呈现阴性,尽管如此,临床医生会结合临床情况将其归类为恶性胸腔积液。因此,关于恶性胸腔积液是否必须经细胞学证实这一问题存在争议。研究[17]数据表明,细胞学确诊与未确诊的恶性积液在生存率方面的差异并无统计学意义。然而,这并不意味着我们可以忽视胸腔积液的细胞学检测而仅凭医生的主观臆断。此外,研究人员[17]也尝试采用最大转移灶的最大径作为患者预后指标,发现最大转移灶最大径<1 cm的患者预后更好。
对于晚期患者,尤其是那些被归类为“寡”转移的患者,除了全身系统性药物治疗,局部治疗确实可能为患者带来显著益处。然而,如何精确定义 “寡”转移这一概念在学术界一直争议广泛[18]。目前,关于肺癌寡转移灶的具体定义尚未达成共识,不同的研究[19]在描述总转移灶数、涉及的转移器官数以及单个器官内的转移灶数时均有差异。最近对M1c分期的进一步细分为我们提供了一个新的视角。将那些能够通过整合局部治疗手段进行治疗的M1c1 病例定义为“寡”转移组,可能是一个有前景的方向。这样的定义有助于更精确地识别那些可能从局部治疗中获益的患者。然而,这一想法的实用性和有效性仍需要更多的临床研究来加以验证和支持。
2.4 TNM分期及预后
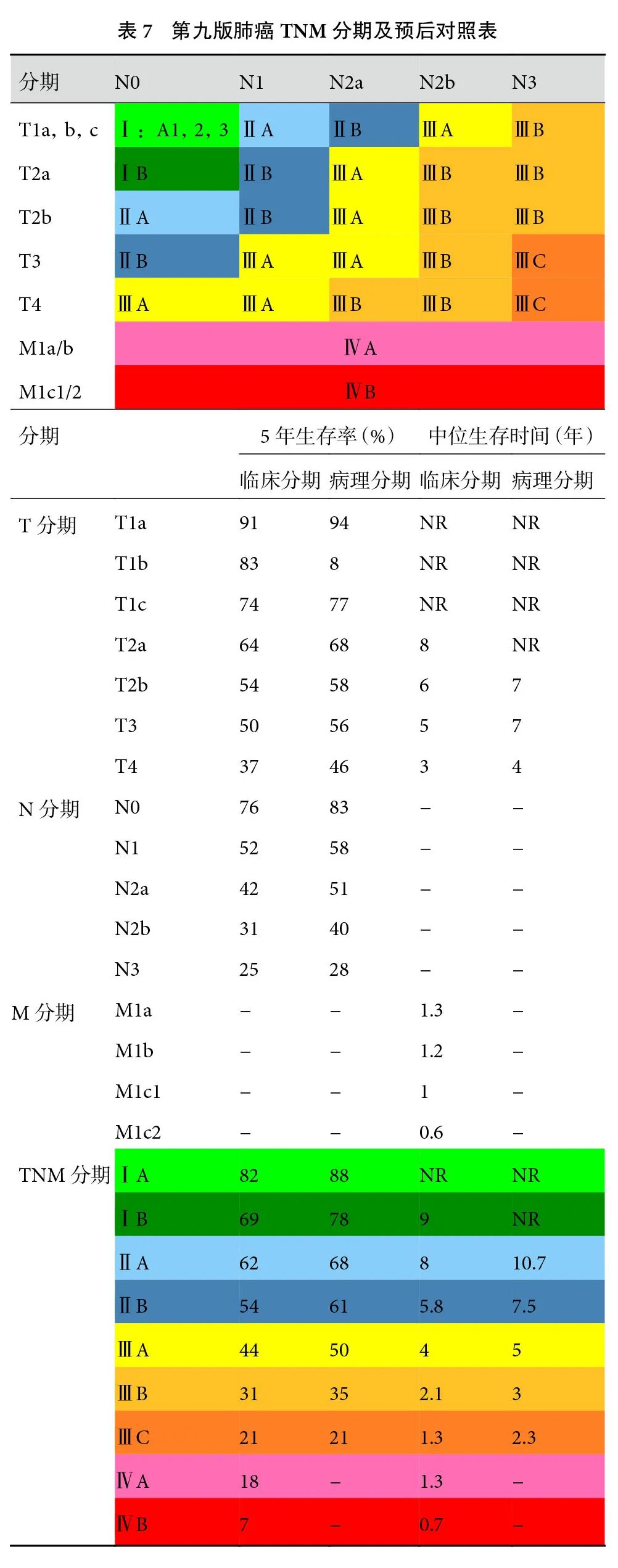
经过第九版N分期的调整,第九版TNM分期亦作相应变更。本次更新将T1N1M0 的预后由 ⅡB降为ⅡA。N2 细分为N2a和N2b后其对应关系做了如下调整:T1N2aM0归为ⅡB 期;T2a~3N2aM0及T1N2bM0 归为ⅢA期;T4N2aM0及T2a~4N2bM0 归为ⅢB期,其余分期不变。我们总结了历次IASLC版TNM 分期演变(表6)[11]。尽管更为精细的N分期带来了更精确的生存曲线,却也增加了TNM分期的复杂性和记忆难度。因此,我们为第九版肺癌TNM分期设计了一种全新的呈现形式(图1),考虑到临床实践中通常按M-N-T的顺序判断分期,故本图的设计暗合此逻辑规律。由内向外,首先确定相应的M分期情况,再确定N 分期,继而确定T分期,最终确定对应的TNM 分期。该TNM分期图清晰美观,从业者可以通过该图迅速确定相应TNM 分期及预后情况,这些数据对于医生判断预后及决定后续治疗策略都有重要参考价值。此外,第九版肺癌TNM分期表格法的呈现方式也总结至表7,以供参阅。
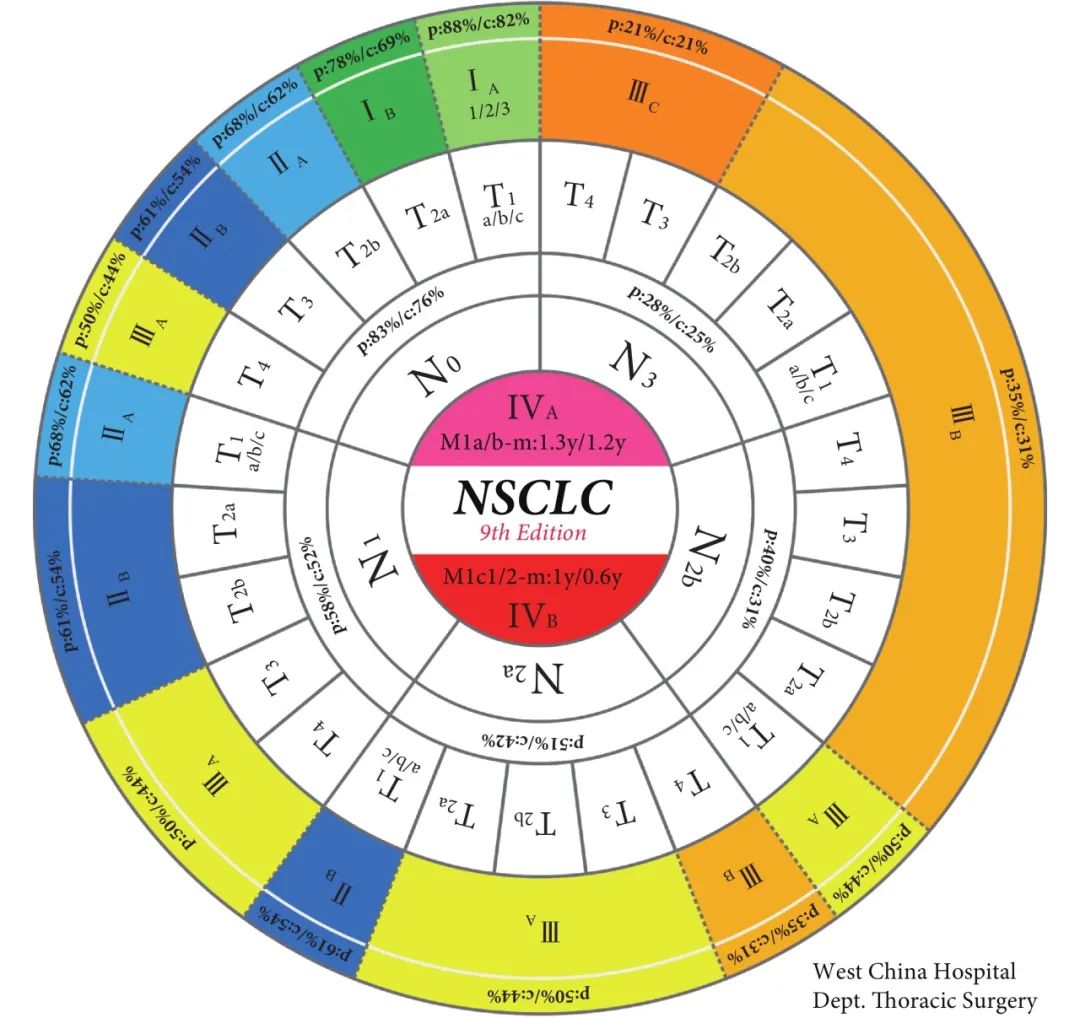
图 1 第九版肺癌TNM分期图
p:pathologic(病理分期对应的预后);c:clinical(临床分期对应的预后);m:median survival(中位生存期);y:year(年)
3 总结与展望
肺癌TNM分期是诊治肺癌的基石,其为描述肺癌提供了清晰且统一的定义,从而确保相关从业者之间可以准确无误地沟通。此外,其对患者个体分期的评估以及预后的判断均具有重要意义,因此每次肺癌TNM 分期更新都是学界重大事件。
相较第八版分期,第九版肺癌TNM分期在诸多方面取得了显著进步。尽管新数据库仍存在患者分布不均等问题,但其依然展示出以下亮点:(1)本次收录的患者总数及有效患者数均为各版本最多;(2)在患者分布上,亚洲患者占比(51.4%)稳步提升,尤其是中国患者占比从第八版的0.8%升至第九版的12.1%;(3)EDC病例占比持续增长,为后续更多可能的分析研究奠定基础,且我国EDC病例总数和占比都走在了世界前列。TNM分期的改动方面:T分期:无改动;N分期:将原N2淋巴结转移细分为N2a(单站转移)及N2b(多站转移);M分期:将原M1c(胸腔外多转移灶)细分为M1c1(胸腔外的多转移灶在同一器官)和M1c2(胸腔外的多转移灶在不同器官)。TNM分期及预后也根据上述变更做了相应调整。最后,新的TNM分期在生存曲线分层上表现优异,这种更为细致的分期不仅有助于更精确地反映疾病的进展状况和预后情况,还将进一步影响后续治疗策略的选择。
随着肺癌治疗策略的多元化发展,技术进步不断拓展治疗的边界,例如针对寡转移性疾病的局部疗法,使得部分Ⅳa期患者也获得手术机会。然而,当前肺癌TNM分期系统自1968 年首版发布以来,仍主要基于解剖学范畴进行界定,这在很大程度上已无法充分满足现代肺癌治疗,尤其是迅速发展的靶向治疗和免疫治疗等系统性治疗手段对预后判断的需求。近年来,大数据和人工智能技术在医学领域的应用日益广泛,特别是在癌症诊疗和预后评估方面展现出巨大潜力。对于肺癌TNM分期系统而言,这些技术有望带来革命性的变革。通过整合各大医院构建的肺癌大数据,我们能够获取更大规模、更具代表性的患者信息,进而使TNM 分期系统更精确地反映不同患者群体的特征。同时,结合人工智能的深度学习和数据挖掘技术,我们有望从海量数据中发掘出新的分期模式和治疗响应特征,为肺癌诊疗提供更加科学、个性化的依据。此外,我们还迫切希望找到与现有TNM分期系统相联动的生物标志物,以更准确地预测各种治疗方式下患者的预后情况。然而,目前IASLC的数据库尚未实现这一目标。虽然我们期望TNM分期能涵盖更多影响因素,以便更准确评估不同分期和治疗状况下的患者预后,但也需谨记Detterbeck(第九版分期负责人之一)[20]所言,“分期并不是为了包含所有预后和治疗选择的因素,它不是预后模型或治疗指南,只是预后评估和协助确定治疗方案的工具。”最后,我们向以Asamura博士、Nishimura博士与Ramón Rami-Porta博士为代表的众多第九版TNM分期奠基人致敬,同时感谢IASLC和CRAB对于肺癌TNM分期系统做出的卓越贡献。我们期待IASLC在未来能够继续推陈出新,不断改善肺癌TNM分期系统。
利益冲突:无。
作者贡献:赵珂嘉和刘成武负责文献检索、数据分析及文章撰写;刘伦旭负责本文构思与设计、文章修改及对审核定稿。
声明:编辑本文英文摘要时采用AiBot机器人对话(由微信号chatgpt1231注册)进行英文语言润色,并经人工核对。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)