首页 > 医疗资讯/ 正文
摘 要
目的 评估分期行颈动脉支架植入术及冠状动脉旁路移植术治疗冠状动脉粥样硬化性心脏病(冠心病)合并颈动脉狭窄的疗效。方法 回顾性分析2019年11月—2021年9月阜外医院收治的冠心病合并颈动脉狭窄患者的临床资料。所有患者均分期行颈动脉支架植入术及冠状动脉旁路移植术。分析围手术期及随访期间心肌梗死、脑梗死和死亡等严重并发症的发生率及危险因素。结果 共纳入58例患者,其中男47例、女11例,手术年龄52~77(64.2±5.6)岁。冠状动脉旁路移植术术前无严重并发症发生,术后早期发生心肌梗死1例、脑梗死1例、死亡1例,术后早期严重并发症发生率为5.2%。平均随访时间为18.3个月,随访期间发生脑梗死1例、死亡2例,整体严重并发症发生率为10.3%。Kaplan-Meier生存曲线分析显示,有症状性颈动脉狭窄(log-rank,P=0.037)和置入闭环支架(log-rank,P=0.030)患者术后发生缺血性脑血管事件的风险较高;有既往陈旧性脑梗死的患者,术后发生严重并发症的风险较高(log-rank,P=0.044)。结论 分期行颈动脉支架植入术及冠状动脉旁路移植术治疗冠心病合并颈动脉狭窄安全可行。
正 文
动脉粥样硬化常累及多处血管。据统计,约5%冠状动脉粥样硬化性心脏病(冠心病)患者合并颈动脉重度狭窄[1]。冠状动脉病变越重,合并颈动脉重度狭窄的可能性也越高[2]。研究[3]指出,出现过短暂性脑缺血发作(transient ischemia attack, TIA)或脑梗死的患者在冠状动脉旁路移植术(coronary artery bypass grafting,CABG)后发生脑梗死的风险更高。双侧颈动脉重度狭窄也是CABG 术后脑梗死的危险因素[4]。近年相关指南[5-7]进一步明确了冠心病合并颈动脉狭窄患者行颈动脉干预的手术指征。但干预方式如颈动脉内膜剥脱术(carotid endarterectomy,CEA)或颈动脉支架植入术(carotid artery stenting,CAS)的选择、与CABG 手术同期或分期干预、分期手术的间隔时间等问题,指南目前均无明确推荐意见。本研究通过回顾单中心分期行CAS及CABG治疗冠心病合并颈动脉狭窄患者的临床结果,评估影响该方案疗效和安全性的因素。
1 资料与方法
1.1 临床资料
回顾性纳入2019年11月—2021 年9月于阜外医院拟行CABG、术前筛查发现颈动脉狭窄,且经我科会诊认为存在CABG 术前颈动脉干预指征患者。除外颈动脉解剖形态不佳、存在抗凝或抗血小板治疗禁忌的病例。
1.2 手术方法
本中心行CABG 手术治疗冠心病合并颈动脉狭窄的流程见图1。所有病例均行弓上动脉CT确认颈动脉狭窄程度。分期手术指第1次手术完成单侧颈动脉血运重建,第2次手术完善CABG手术。
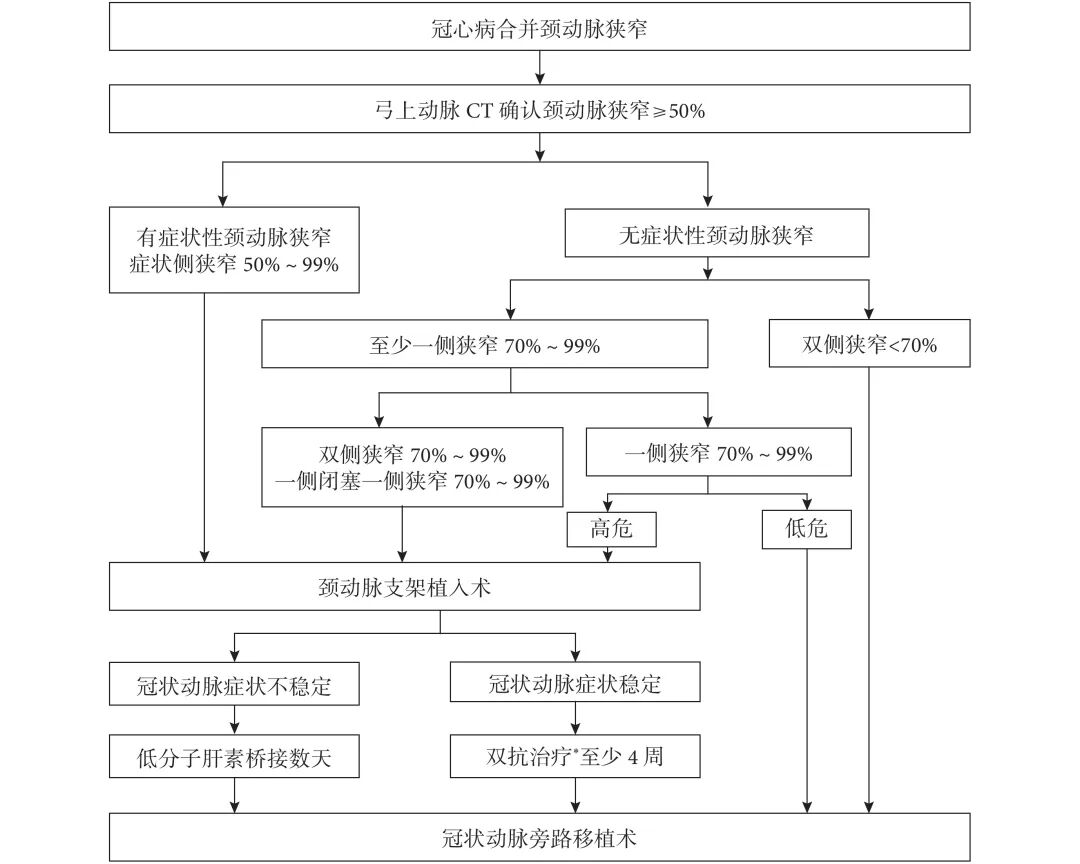
图 1 冠心病合并颈动脉狭窄治疗流程图
*:阿司匹林+氯吡格雷双抗治疗
CAS手术中,常规予肝素100 U/kg。股动脉穿刺置鞘后,高压造影确认颈动脉狭窄情况。超选-介入-拟治疗侧的颈总动脉,再次造影确认。放置颈动脉远段保护装置,球囊扩张后置入开环或闭环式自膨金属裸支架,均不行球囊后扩张。造影确认颈内动脉通畅后结束手术。如心绞痛症状控制良好,CAS手术后常规剂量阿司匹林及氯吡格雷双抗治疗至少1个月再行CABG 手术;如症状控制不佳,则治疗剂量低分子肝素抗凝桥接,尽快行CABG。
1.3 评价指标及随访
有症状性颈动脉狭窄指颈动脉狭窄病例既往6个月内有TIA、一过性黑矇、患侧颅内血管导致轻度或非致残性卒中等临床症状中的一项或多项[8]。将TIA 及脑梗死统称为缺血性脑血管事件,本次CAS术前发生的TIA及脑梗死均被定义为陈旧性缺血性脑血管事件。
随访分为3 个时间段,分别是CAS手术至CABG 术前、CABG 手术至CABG术后30 d内、后续随访。随访中关注心肌梗死、脑梗死及死亡事件,统称为术后严重并发症。心肌梗死包括冠状动脉粥样硬化相关性心肌梗死、CABG 相关心肌梗死等,诊断标准参照最新指南[9]。脑梗死根据神经系统症状和/或影像学检查确诊,不包括TIA。在院外出现的上述严重并发症,需结合外院资料确认。
将CABG手术至CABG术后30 d内定义为术后早期。此后常规每6个月进行1 次电话随访。出现死亡事件后随访终止。
1.4 统计学分析
采用SPSS 25.0 软件进行统计学分析。分类变量用频数或百分比描述;正态分布的连续变量以均数±标准差(x ±s)描述,非正态分布的连续变量以中位数(上下四分位数)[M(P25,P75)]描述。生存分析采用Kaplan-Meier 生存曲线及log-rank 检验。P≤0.05 为差异有统计学意义。
1.5 伦理审查
本研究经中国医学科学院阜外医院科研处审查,审查编号:2022-1679。本研究的实施符合《赫尔辛基宣言》要求,所有患者均签署手术知情同意书。
2 结果
2.1 患者一般资料
共纳入58例患者,所有患者均行CAS手术,其中男47 例(81.0%)、女11 例(19.0%),手术年龄52~77(64.2±5.6)岁。基础疾病方面,高血压48 例(82.8%)、2型糖尿病26例(44.8%)、高脂血症34 例(58.6%)、有吸烟史38 例(65.5%)、心房颤动3例(5.2%)、陈旧性脑梗死18 例(31.0%)、陈旧性心肌梗死23 例(39.7%)。所有病例既往均未接受过颈动脉相关手术治疗。全组患者中,有症状性颈动脉狭窄7例(12.1%),无症状性51例(87.9%)。单侧受累20 例(34.5%),均为重度狭窄;双侧受累38 例(65.5%),其中双侧重度狭窄31 例(53.4%),一侧闭塞一侧重度狭窄7例(12.1%)。术前评估冠状动脉病变,所有病例均为冠状动脉三支病变。基线高敏肌钙蛋白I 0.002~0.299 ng/mL (参考范围为0~0.034 ng/mL),左心室射血分数为30.0%~70.0%(57.9%±10.0%),左心室舒张末期内径为38.0~77.0(50.1±6.7)mm,升主动脉钙化10 例(17.2%)。
2.2 手术结果
CAS手术方面,3例(5.2%)患者在CABG术前分期处理了双侧颈动脉狭窄,55 例(94.8%)处理单侧。置入开环支架50 例(86.2%),置入闭环支架8例(13.8%)。8例(13.8%)患者CAS术后低分子肝素抗凝,转至心外科行CABG 手术,手术间隔时间5.0~16.0(8.0±4.2)d。50例(86.2%)患者术后行双抗治疗,24.0~147.0(56.0 ±26.9)d 后再行CABG手术。
CABG 手术方面,体外循环下手术3 4例(58.6%),非体外循环下手术24例(41.4%)。52 例(89.7%)完成左乳内动脉-前降支旁路,6例(10.3%)为大隐静脉-前降支旁路。体外循环下手术时间为(255.2±39.5)min,体外循环时间为(121.5± 36.0)min,主动脉阻断时间为(88.8±29.4)min。非体外循环下手术时间为(215.5±38.6)min。
2.3 术后早期及随访结果
CAS手术至CABG术前未发生心肌梗死、脑梗死及死亡事件。CABG术后早期发生1 例(1.7%)急性心肌梗死,为CABG 相关性心肌梗死,表现为术后持续性高敏肌钙蛋白I升高,伴新发室壁运动异常及射血分数降低。2例(3.4%)缺血性脑血管事件,其中1例为TIA,表现为口齿不清及右侧肢体力弱,持续约24 h后好转;1 例为急性脑梗死,表现为右侧肢体偏瘫,由头颅磁共振成像确诊,肢体症状持续。1例(1.7%)死亡,死因为术后急性A型主动脉夹层。CAS-CABG术后早期心肌梗死、脑梗死及死亡的整体发生率为5.2%。
末次集中随访时间为2022 年1月,随访率100.0%。共发生缺血性脑血管事件2例(3.4%), 1例为术后2 个月发生急性脑梗死,出现新发左侧肢体偏瘫,症状持续不缓解;1例术后12个月起反复发作TIA,表现为口齿不清及右侧肢体力弱,每次持续数小时后可自行恢复。死亡2例(3.4%), 1例为术后2 个月死于急性呼吸系统疾病;1例为术后12 个月不明原因死亡。本组病例在平均18.3个月的随访期内,心肌梗死、脑梗死及死亡的发生率为10.3%。
2.4 危险因素分析
CAS-CABG 术后共发生4例(6.9%)缺血性脑血管事件,包括2例TIA及2例脑梗死。根据神经系统定位,病灶均位于放置颈动脉支架侧,其中2例采用开环支架,2 例采用闭环支架。
分别以缺血性脑血管事件及术后严重并发症为终点事件,根据Kaplan-Meier生存分析,发现有症状性颈动脉狭窄(log-rank,P=0.037)、置入闭环支架(log-rank,P=0.030)的病例术后发生缺血性脑血管事件的风险较高。对于存在陈旧性脑梗死的病例,其术后缺血性脑血管事件风险可能增高(log-rank,P=0.058)。同时,这部分病例术后发生严重并发症,包括心肌梗死、脑梗死及死亡事件的风险显著增高(log-rank,P=0.044);见图2。
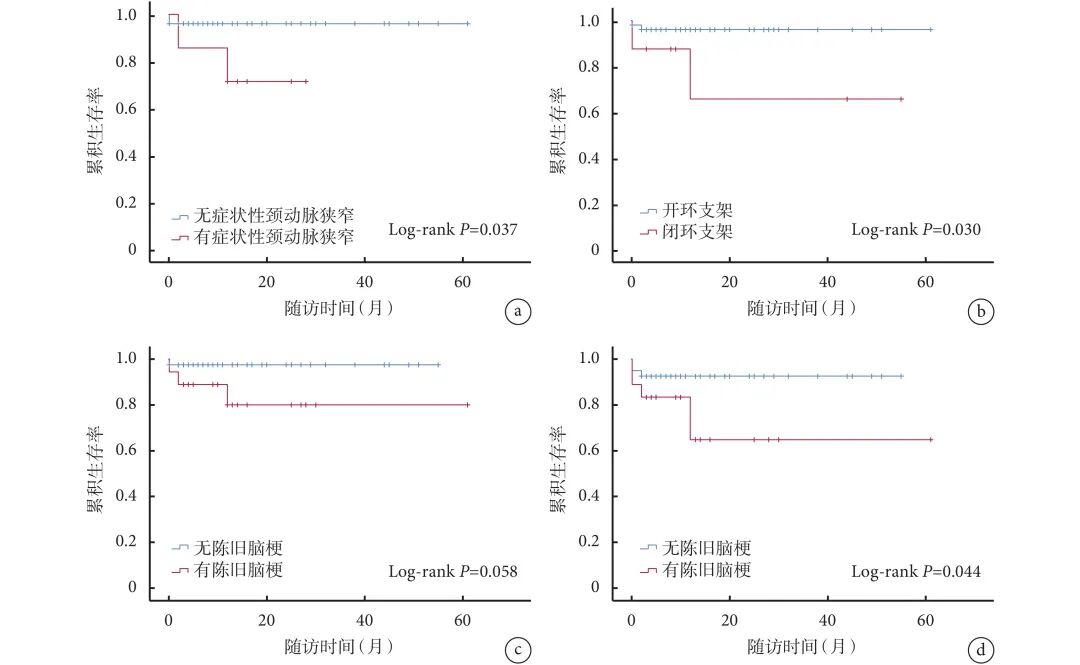
图 2 Kaplan-Meier 生存曲线图
a~c:分别为有/无症状性颈动脉狭窄、开/闭环支架、有/无陈旧脑梗死患者缺血性脑血管事件的Kaplan-Meier生存曲线图;d:有/无陈旧脑梗死患者术后严重并发症的Kaplan-Meier生存曲线图
3 讨论
冠心病合并颈动脉狭窄目前尚无“金标准” 处理方案。指南[5-7]中对同期或分期手术、分期手术间隔时间等均无明确建议。本中心在临床实践的基础上,提出分期CAS-CABG 手术治疗冠心病合并颈动脉狭窄的方案,并评估其有效性及安全性。本研究中CAS-CABG 术后早期心肌梗死、脑梗死及死亡的整体发生率为5.2%,低于近年文献[10-12]报道结果(9.4%~11.0%)。
CAS 手术中使用开环或闭环支架对预后的影响尚不明确。Müller等[13]发现开环支架再狭窄的风险低于闭环支架[5 年风险35.5% vs. 46.0%, HR=0.68,95%CI(0.53,0.88)],但脑血管事件发生的风险无显著差异。而de Vries等[14]的Meta分析发现两种类型的支架在术后脑血管事件及死亡风险上无显著差异,但磁共振成像等检查提示开环支架可能导致更多的亚临床脑梗死。本中心经验性地根据病变位置选择支架类型,颈动脉分叉处的病变多采用开环支架,而颈内动脉高位病变则多采用闭环支架。尽管本研究中闭环支架组术后脑血管事件发生率(2/8)高于开环支架组(2/50),但暂不能除外因两组样本量相差较大而存在的偏倚。有研究[15]认为非体外循环下CABG能降低合并颈动脉狭窄病例围术期脑血管事件发生的风险。本研究中非体外循环下CABG占41.4%,两组围手术期并发症差异无统计学意义,这可能提示已经完成颈动脉血运重建的病例,可以耐受体外循环过程中的血压波动。
当存在有症状性颈动脉狭窄(≥50%)、无症状性双侧狭窄(≥70%)以及无症状性一侧闭塞一侧狭窄(≥70%)等情况时,近年的指南[5- 7]均推荐在CABG前分期或同期行颈动脉血运重建。合并单侧无症状性颈动脉狭窄(≥70%)的处理仍存在争议,尽管指南[5-7]中未明确推荐进行颈动脉干预,但有研究[16]发现合并无症状性单侧重度颈动脉狭窄(≥ 90%)显著增加围手术期脑血管事件风险[OR=12.03,95%CI(1.34,108.23)]。另外两项研究[17-18]对合并无症状性颈动脉重度狭窄的病例行同期CEA或单纯药物治疗,其中一项研究[17]显示围手术期脑梗死及死亡率差异无统计学意义(18.5% vs. 9.7%, P=0.12),另一项研究[18]显示同期CEA组围手术期脑血管事件发生率更低(0.0% vs. 7.0%,P=0.008)。本研究发现,对于存在陈旧性脑梗死且狭窄侧颈动脉可疑为犯罪血管的病例,即使近6 个月未发生TIA或脑梗死等缺血性脑血管事件,仍可能从CABG 术前的颈动脉血运重建中获益。
需要行CABG治疗的冠心病是CEA 的相对禁忌证,近年的指南[5-7]都推荐对合并有症状性颈动脉狭窄的冠心病患者在CABG 手术前分期或同期行CEA(Ⅱa级推荐)。对合并无症状性颈动脉狭窄且存在手术指征的病例,指南[5]推荐根据手术紧急性、冠状动脉症状等情况综合评估后选择CEA或CAS手术方案(Ⅱa级推荐)。选择分期或同期手术以及两次手术的间隔时间等,指南均无明确推荐意见。本研究未涉及同期杂交CAS-CABG 手术病例。药物控制不佳的冠心病病例,本中心建议在CAS术后尽早行CABG手术。药物控制良好的病例,建议双抗治疗至少1 个月后再行CABG 手术。这两组病例在随访期间的并发症发生率无显著差异。Tzoumas等[19]发现,相较于分期CAS-CABG 手术,同期杂交手术术后发生早期脑梗死的风险更高,但远期心肌梗死、脑梗死及死亡风险无显著差异。本中心的经验是,CAS 术后至少1个月的双抗治疗有助于降低支架内急性血栓事件风险,但这需要大样本量试验验证。
综上所述,本中心实施的分期CAS-CABG手术是一种安全可行的治疗冠心病合并颈动脉狭窄的方案。但本研究为单中心回顾性研究,受限于回顾性研究的固有限制,可提供的证据级别不高。本研究中,有症状性颈动脉狭窄、低分子肝素桥接、闭环支架置入等相关病例均<10 例,可能会带来误差。此外,本研究中有3 例患者处理了双侧颈动脉狭窄,由于这3 例患者中无阳性事件发生,因此未拆分双侧进行计算,可能会引入偏倚。本研究中样本数偏少,阳性事件发生率低,在纳入性别、年龄、是否有陈旧性脑梗死、症状性狭窄、双侧病变、闭环支架、双抗桥接、体外循环CABG 因素进行Cox回归分析后,未发现差异有统计学意义的结果,因此结果中并未展示该部分数据。这可能是阳性事件数发生过少导致的假阴性结果,需要大样本量研究进一步验证。
利益冲突:无。
作者贡献:施焘、滕乐群负责数据收集及论文撰写;张永保、房杰负责文章审阅及修改;李佳亮负责整理数据及统计学分析;沈晨阳负责论文总体设计及修改。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)