首页 > 医疗资讯/ 正文
摘 要
目的 比较机器人辅助胸腔镜手术(robot-assisted thoracoscopic surgery,RATS)与电视辅助胸腔镜手术(video-assisted thoracoscopic surgery,VATS)治疗后纵隔肿物的围手术期疗效,探讨RATS辅助后纵隔肿物外科治疗的优势。方法 回顾性分析2019年1月—2023年1月在兰州大学第一医院胸外科同一医疗组行侧胸入路后纵隔肿物切除术患者的临床资料。按不同手术方式将患者分为RATS组和VATS组。比较两组患者的临床资料。结果 本研究共纳入85例患者,RATS组39例,其中男14例、女25例,平均年龄(47.6±13.0)岁,VATS组46例,其中男14例、女32例,平均年龄(45.3±14.7)岁。所有患者均顺利完成手术。RATS组的住院总费用高于VATS组(P<0.001);RATS组术后第1 d白细胞计数、中性粒细胞百分比均低于VATS组(P<0.05);两组患者手术时间、术中出血量、术后住院时间、术后第3 d白细胞计数和中性粒细胞百分比、术后第1 d和第3 d疼痛视觉模拟评分、止痛泵使用时间、术后12 h血氧饱和度(未吸氧)、术后开始下床活动时间、总胸腔引流量、引流管放置时间、术后相关并发症发生率差异均无统计学意义(P>0.05)。两组患者均无围手术期死亡,无中转开胸及围手术期严重并发症。结论 运用RATS辅助经侧胸入路行后纵隔肿物切除术安全可行,其近期疗效与侧胸单孔入路VATS相当,值得进一步研究其获益与性价比。
正 文
纵隔肿物是胸外科常见疾病之一,其病理类型主要以胸腺瘤、畸胎瘤、神经源性肿瘤和纵隔囊肿等为主[1],其发病隐匿,患者通常无明显临床症状,多于体检时发现。其发病机制目前仍不明确,其治疗方式包括:外科手术治疗、化疗药物治疗、射线治疗等,但以手术治疗为首选[2]。在胸腔镜尚未普及之前,传统纵隔肿物手术采用开放式入路[3-4],但具有创伤较大、出血量较多、手术耗时长、术后疼痛明显、术后并发症较多、恢复时间长等缺点[3]。自1992年Landreneau等[5]开展电视辅助胸腔镜手术(video-assisted thoracoscopic surgery,VATS)以来,由于其微创性及其预后可与传统开放式手术相媲美[6],现已于临床实践中得到广泛应用。VATS用于后纵隔肿瘤治疗时,现手术途径主要以肋间三孔和肋间单孔为主,单孔相较于三孔,其减少了手术切口和对肋间肌肉、神经的压迫损伤,因此其术后疼痛较轻[7],但手术难度也相对较大。达芬奇机器人辅助胸腔镜手术(robot-assisted thoracoscopic surgery,RATS)作为另一种微创方法,使术者可以通过铰接式器械和三维视图克服VATS存在的部分局限性。2001年Yoshino等[8]首次报道了RATS辅助前纵隔肿物切除术,此后RATS在胸外科的应用逐步推广。自2019年我科开展RATS以来,已累计行RATS 500余例,其中后纵隔手术39例。该研究旨在比较分析RATS和VATS在后纵隔肿物治疗中的围手术期疗效及安全性。
1 资料与方法
1.1 临床资料和分组
本研究为回顾性研究,收集2019年1月—2023年1月期间在兰州大学第一医院胸外科同一医疗组通过侧胸入路行后纵隔肿物切除手术患者的临床资料,依照不同手术方式将患者分为RATS组和VATS组。
纳入标准:(1)术前行胸部增强CT等相关检查后确定为纵隔肿物;(2)有明确的手术指征;(3)术前合并症经治疗后,其相关症状均控制良好,相关科室会诊提示无手术禁忌;(4)患者及家属知晓手术方式及风险,同意行手术治疗。排除标准:(1)肿物侵犯主要动静脉、气管、食管等重要结构,或瘤体巨大,经主刀医生评估后行微创手术切除困难者;(2)其他部位存在明确肿瘤;(3)术前明确诊断为恶性肿瘤并已接受放射治疗、化学治疗3个周期以上或肿瘤术后复发;(4)双侧胸膜炎病史和/或心血管、胸外科手术史;(5)术中因各种原因转为开胸手术;(6)其他不宜手术的情况;(7)术后未进行门诊随访;(8)临床资料缺失者。
1.2 手术方法
患者取前侧卧位,根据肿物的主体位置决定选择左侧或右侧入路,若瘤体位于正中,则更多倾向于选择右侧入路,在患者腋下一拳放置腋垫垫高胸部,充分暴露术区,并使患者双臂向前向上展开,增宽肋间隙,同时可避免影响机械臂操作。在开始麻醉前30 min内肌肉注射戊乙奎醚,并建立好静脉通道,开始持续性监测心电图、血压、血氧饱和度和呼吸频率等基本生命体征。使用双腔气管插管全身麻醉,术中采用单肺通气,并尽可能使术侧肺叶萎陷。麻醉维持使用静脉泵入瑞芬太尼[5~10 μg/(kg·h)]、丙泊酚[2~4 mg/(kg·h)]和1%~2%七氟烷气管吸入,术中根据患者情况可追加舒芬太尼(5 μg/次)、顺式阿曲库铵(5 mg/次)。
RATS:麻醉满意后开始手术,根据肿瘤位置在术侧选择合适的3个肋间隙,分别在相应肋间隙腋后线后方作一约1 cm皮肤切口,前方做2个约1 cm皮肤切口,形成以后方切口为顶点的三角,嘱麻醉医师单肺通气,经3个切口分别放置8 mm Trocar。RATS系统定位后,调整机械臂位置并连接戳卡与机械臂,调整3个机械臂位置,使各个机械臂有一定活动空间,三角顶点处8 mm Trocar放置5 mm内窥镜。主刀医生为右利手,故视野右侧8 mm Trocar放置达芬奇电钩、左侧8 mm Trocar放置双极镊,术中可根据需要调换器械位置。使用达芬奇双极镊暴露肿瘤基底部,使达芬奇电勾沿肿瘤外层分离肿瘤与正常组织,术中注意避免损伤大动脉、食管、胸导管、奇静脉及重要神经等重要结构。如果肿瘤的滋养血管较大,需完全游离血管并使用血管夹夹闭后,再离断血管。手术应尽可能完整切除肿物,部分神经源性肿瘤呈哑铃状,部分位于椎间孔、椎管内,则完整切除位于胸腔内部分,切忌暴力拉扯,可后期于神经外科再行切除。
手术完成后,择一合适切口放入标本袋,将肿物装入标本袋中再从手术切口取出。如标本过大,可分段取出或必要时再扩大手术切口后取出。手术部位严密止血,于术侧第7肋间隙置入10Fr引流管,调整引流管方向,嘱麻醉师鼓肺,使肺叶充分复张。逐层关闭胸壁,外层皮肤采用皮下缝合,将引流管与负压瓶连接,进一步排除胸腔内残气后连接引流瓶;见图1。
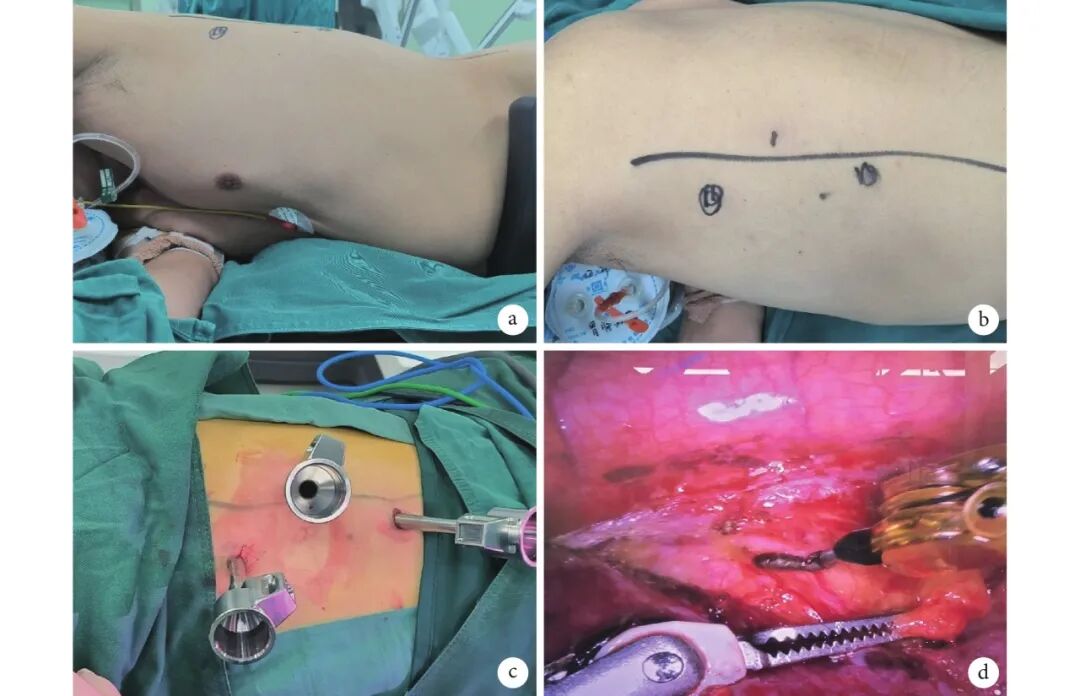
图 1 机器人辅助后纵隔肿物手术
a:患者体位;b:手术切口标记;c:戳卡布局;d:术中分离后纵隔肿物
1.3 术后处理
(1)手术后所有患者均常规给予补液、止痛、抗菌、雾化、化痰等一般对症支持处理;(2)术后患者意识恢复正常,并无恶心、呕吐等症状后,患者可自主饮水、进食,并嘱患者早期进行下床活动、呼吸锻炼;(3)术后第1、3 d行胸腔积液B超和胸部X线片检查,若不存在较多积气、积液,则拔除胸腔引流管后准予出院。若其胸腔积气和/或积液深度≤3 cm,患者无胸闷、气促等不适,鼓励加强活动及锻炼,促进积液、积气吸收。若胸腔积气和/或积液>3 cm,且患者存在相关临床症状,则在相应肋间放入引流管进行胸腔闭式引流。后期再复查胸部X线片,待其双肺复张完全且胸腔引流量<100 mL/d,并排除血性、脓性引流液后拔除引流管。
1.4 观察指标
观察指标包括手术时间、术中出血量、术后住院时间、住院总费用、术后并发症等。应用疼痛视觉模拟评分(visual analogue scale,VAS)评价患者术后疼痛情况。VAS用0~10分表示:0分为无痛,1~3分为轻度疼痛,4~6分为中度疼痛,7~10分为重度疼痛。
1.5 统计学分析
采用SPSS 26.0软件进行统计学分析。符合正态分布的计量资料以均数±标准差(±s)描述,进一步行方差齐性检验,如方差齐两组间比较使用t检验,如方差不齐则两组间比较采用t'检验;不符合正态分布的计量资料采用中位数(上下四分位数)[M(P25,P75)]描述,两组间比较采用Mann-Whitney U检验。计数资料以频数和百分比(%)描述,两组间比较采用χ2检验或Freeman-Halton检验(Fisher确切概率法的拓展方法)。P≤0.05为差异有统计学意义。
1.6 伦理审查
本研究已通过兰州大学第一医院伦理委员会审批,审批号:LDYYLL2023-77。
2 结果
2.1 患者一般资料
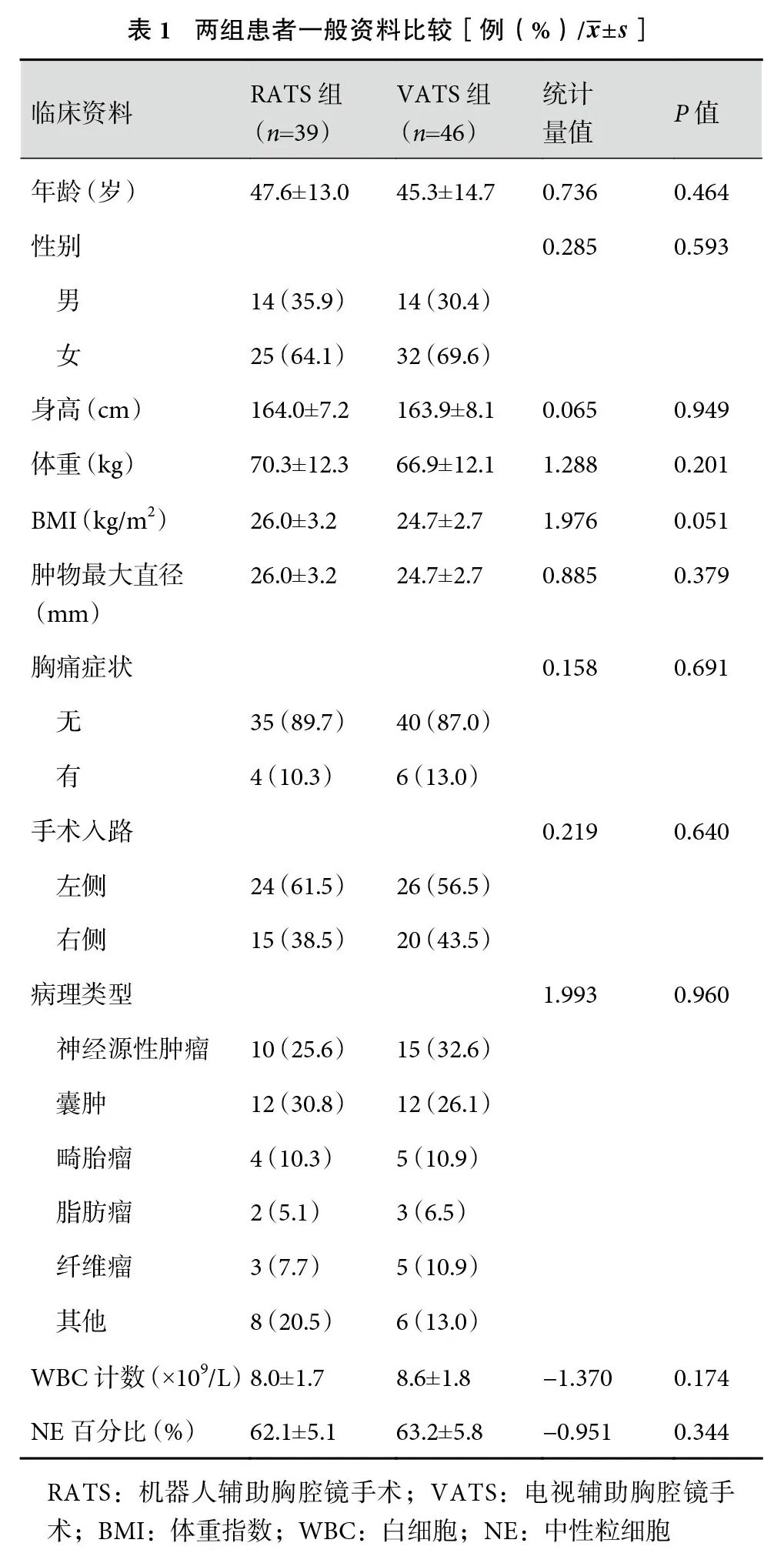
共纳入患者85例,其中RATS组39例,VATS组46例。两组患者在年龄、身高、体重、性别、肿瘤最大直径等方面差异均无统计学意义(>0.05);见表1。
2.2 围手术期资料
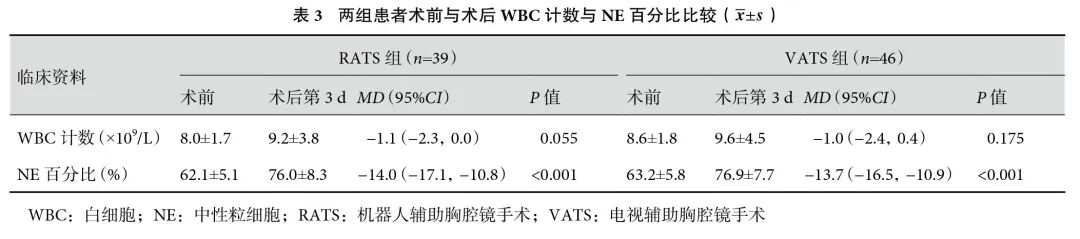
RATS组的住院总费用明显高于VATS组,RATS组的术后第1 d白细胞(white blood cell,WBC)计数与中性粒细胞(neutrophils,NE)百分比较低(P<0.05)。RATS组与VATS组在手术时间、术中出血量、术后住院时间、术后第3 d WBC计数和NE百分比、术后第1 d和第3 d VAS评分、术后止痛泵使用时间、术后12 h血氧饱和度(未吸氧)、术后开始下床时间、总胸腔引流量、引流管放置时间方面差异无统计学意义(>0.05);见表2。两组患者手术前后WBC计数和NE百分比变化见表3。
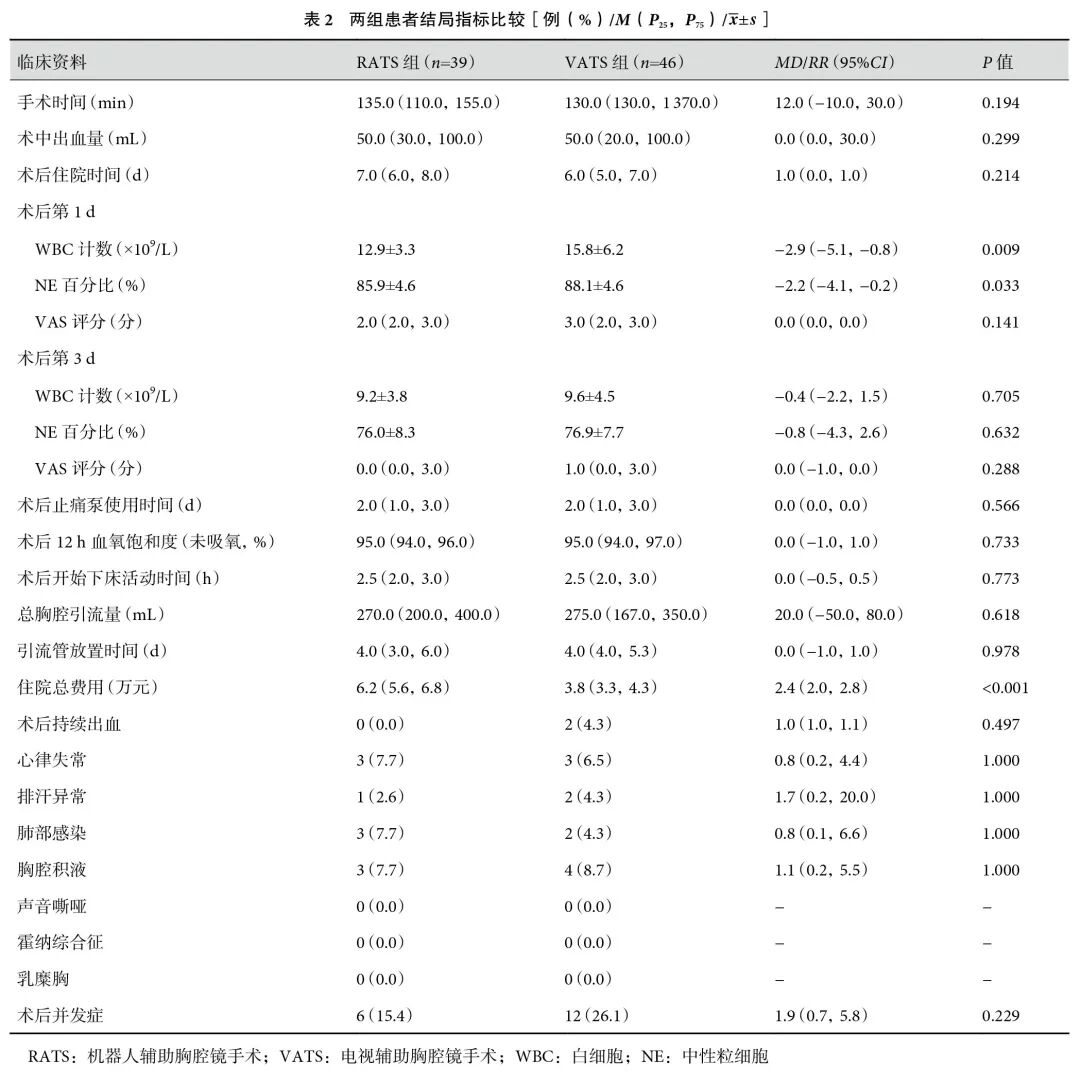
全组患者手术均顺利完成,无中转开胸,无围手术死亡或其他重大并发症。两组患者于出院后1个月和3个月在门诊随诊行胸部CT检查,均未发现复发、转移等。RATS组共有6例患者术后出现并发症,VATS组共有12例患者术后出现并发症,在经过对症支持等相关治疗后,两组患者症状均好转后出院。两组患者在各个相关并发症及总并发症发生率上差异无统计学意义(>0.05);见表2。
3 讨论
纵隔包含了心脏、气管、主动脉、食管等多个器官和组织,其结构复杂。由于其发育胚层来源于多个胚层,故其肿物类型繁多,但以良性肿物为主,恶性肿瘤较为少见[9]。纵隔以前后心包为界限,分为前、中、后纵隔3个部分。其中后纵隔肿物主要以神经来源性为主,其次为各种前肠囊肿,大多为良性肿物。后纵隔肿物患者通常无明显症状或特异性体征,多于体检中发现,然而由于其位置特殊,为避免其侵犯或压迫后纵隔心脏、大血管、淋巴等重要组织,故除恶性淋巴瘤可行放射治疗外,在无手术禁忌证的情况下,均应行手术治疗。
随着外科技术的发展,后纵隔肿物切除术存在多种方式[10]。传统经肋间开胸手术创伤大、术中出血多、术后疼痛明显、并发症较多,故现在多用于巨大肿瘤的切除或胸膜腔闭锁而无法行微创手术患者[11]。自1992年VATS开展以来,从最初的四孔发展到三孔,到现在的单孔。该微创手术方式不仅缩短了手术切口长度,其术中及术后指标也更优,弥补了经肋间开胸手术的缺点[12]。VATS现已成为主流的手术方式。近年来,随着RATS技术的兴起,于2001年首次使用于纵隔手术后[8],其在胸外科应用逐渐广泛。我科自2019年开展RATS以来,已进行500余台达芬奇手术,其中后纵隔肿物切除术39例,手术均顺利完成,无术中中转开胸、术中大出血、围手术期死亡及严重并发症。
本研究纳入了在我科行后纵隔肿物切除术的39例RATS患者和46例VATS患者。两组患者年龄、身高、体重、性别、肿物大小、手术入路、病理类型等差异均不显著(P>0.05),均衡性良好,具有可比性。此外,两组患者均在同一医疗组进行手术和治疗,避免因术者手术和术后治疗习惯不同产生的差异,提高了比较结果的可信度。根据围手术期资料统计分析结果显示,RATS组相较于VATS组,其术后第1 d的WBC计数和NE百分较低,但其住院总费用较高,差异有统计学意义(P<0.05),其余资料差异无统计学意义(P>0.05)。
研究[13]显示,RATS手术时间均长于VATS。已有研究[14]表示,RATS术者一般至少需要19台手术经验才能适应手术操作技巧。在本研究中,RATS组和VATS组手术时间差异无统计学意义,可能原因如下。第一,术者具有多年手术经验,对后纵隔的组织结构具有清晰的认识,并且已完成了多台RATS手术,已熟练掌握RATS手术的操作技巧;第二,该研究纳入的患者中肿物最大直径>6 cm的患者只有13例,使手术难度降低,手术时间差异不显著;第三,相关手术室人员进行了多次专业化培训,流程也多次进行优化,缩短了手术时间。第四,后纵隔空间狭小,特别是靠近膈肌和颈部区域。RATS系统视野为3D高清立体成像,并可放大10~15倍[15],其解剖层次更清晰。此外,RATS的双极镊和电钩具有能够模仿腕关节活动的7个自由度的“EndoWrist”仿真手腕[16],此结构使术者通过尖端转向在肿瘤与正常组织夹缝中进行游离,缩短了VATS中的角度调整时间,手术流程更加顺畅。第五,RATS系统的视野及操作器械均由术者控制,其配合更加密切。此外,RATS可明显降低术者的体力消耗[17],这无疑会提高手术效率。RATS前纵隔手术相关研究[1]表示,RATS可减少患者术中出血量和术后胸腔引流量,而本研究中两组患者并无显著差异,考虑是由于后纵隔大部分肿瘤为外凸型生长,其供血血管较少,粘连面较小,并且只进行了肿物切除,手术创面小,故两组术中出血量和术后引流量无显著差异。有研究[18]显示,在VATS中,肋间三孔入路术后疼痛比肋间单孔明显,而本研究两组患者的术后疼痛无明显差异。VATS器械为硬性直杆,术中难免以手术切口为支点进行操作,其需要承受器械两端的压力。RATS的操作臂由远端提供动力,不需以切口为支点,避免了对肋间神经和肋间肌肉的压迫损伤,减轻了术后肋间神经痛。术后12 h两组血氧饱和度(未吸氧)无明显差异也提示,RATS组虽为肋间三孔入路,但其肋间损伤更轻,故对呼吸影响无显著差异。此外,RATS系统能过滤术者在操作过程中的肌肉震颤[1],VATS器械均为长杆型,手持端距支点更近,故术者的肌肉震颤会在器械末端放大,造成副损伤。在暴露和分离肿物时,RATS中“EndoWrist”仿真手腕使术者可通过尖端转向在肿瘤与正常组织夹缝中操作,从而减少了牵拉性损伤。RATS组术后第1 d WBC计数及NE百分比较VATS组更低,可能与RATS减少了术中副损伤和牵拉损伤,进而减轻了术后应激反应和生理改变有关。此外,RATS可以无接触式进行手术,这也降低了患者的感染风险[19]。两组患者术后第3 d WBC计数和NE百分比差异不显著,可能为患者术后第3 d应激反应部分恢复所致[20]。两组患者术后第3 d WBC计数与术前差异均无统计学意义,术后第3 d NE百分比与术前差异有统计学意义,考虑为术后创面炎症反应使其恢复较慢。RATS组平均住院费用比VATS组高3万元左右,这由设备进口成本高导致。但随着国产手术机器人的兴起和医保覆盖范围的扩大,相信后期其费用可以逐渐下降。两组患者各种术后相关并发症差异均无统计学意义,这说明RATS在围手术期具有可靠的安全性。
随着5G通信技术的发展,大大降低了网络延迟,现已有远程操作的报道[21],后期可实现基层医院患者无需转院即可完成整个诊疗过程,特别在行抢救性手术上,节约了转院时间,可获得更多抢救时间。不仅可缓解上级医院的就诊压力,也合理利用了基层医院的医疗资源,患者诊疗体验也更佳。
本研究为回顾性研究,存在一定局限性:(1)本研究只纳入了我院胸外科同一医疗组的患者,此外,手术方式为患者根据自身经济承担能力选择,这可能存在一定的选择偏倚。后续还需纳入多个医疗组、多个中心患者,从而进行多中心的大样本量研究,进一步探究和证实RATS的优缺点;(2)本研究的达芬奇系统还未跟进其最新的单孔器械,故RATS组和VATS组在入路上还未完全统一,可在后续采购单孔器械后再进行对比研究,进一步验证RATS在减轻术后疼痛上的优势;(3)本研究只进行了术后第1个月和第3个月的门诊随访,并未进行长期随访,了解远期并发症及肿物复发、转移情况,还需进一步随访。
综上所述,RATS不仅安全有效,相对于VATS,具有一定的优势。伴随着手术机器人的国产化和医保的普及,RATS将拥有更广泛的应用前景,应进一步在临床推广应用,并进行前瞻性研究,进一步探究其优劣、应用方法和改进方向。
利益冲突:无。
作者贡献:王锋负责收集病例资料,撰写论文;胡文滕负责设计论文,临床操作实施;袁宇航、王晨晗、何立、杨文文、孙硕、张敏负责收集数据,论文修改;韩彪负责稿件审查及确认。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)