首页 > 医疗资讯/ 正文
糖尿病是严重危害人类健康的公共卫生问题。根据国际糖尿病联盟(IDF)最新统计数据显示,全球成人糖尿病患者(20~79岁)总数约为5.89亿;2024年,糖尿病导致全球340万人死亡。中国是糖尿病患者数量最多的国家,成人糖尿病患者总数约为1.48亿。糖尿病引起的微血管及大血管并发症是导致患者致死、致残的主要原因。临床上,单一的降糖治疗并不能完全消除糖尿病患者各类血管并发症的发生风险。因此,深入理解糖尿病血管并发症的发病机理并寻找潜在干预手段,开发联合治疗策略,对于临床治疗具有重要意义。
内皮细胞作为调节血管功能的“第一应答”效应细胞,其功能障碍是糖尿病血管并发症的始发因素和病理生理学基础。体内高糖应激环境会引起血管内皮细胞间连接破坏,血管通透性增加;并导致内皮细胞的血管新生能力受损,舒张功能障碍,同时引发内皮炎症反应,进而导致各类血管并发症的发生。针对糖尿病血管内皮功能障碍,目前临床上缺乏有效的治疗手段和干预靶点。亚硝基谷胱甘肽还原酶(GSNOR)是亚硝基谷胱甘肽(GSNO)代谢的关键酶,其在调控细胞内一氧化氮和蛋白质巯基亚硝基化修饰的稳态平衡中发挥重要作用。但是,GSNOR在糖尿病血管内皮功能障碍中的具体作用尚未明确。
2025年10月1日,哈尔滨医科大学和南京医科大学的季勇教授、谢利平教授、韩艺教授团队,在Science Translational Medicine发表了题为“S-nitrosoglutathione reductase as a therapeutic target for diabetic vascular complications in rodent models”的研究论文。该研究首次揭示亚硝基谷胱甘肽还原酶(GSNOR)通过非酶活依赖的方式参与糖尿病血管并发症的新机制,并创新性研发了口服小分子化合物NYY-001,通过靶向GSNOR改善糖尿病血管内皮功能障碍。

研究团队基于临床样本,通过蛋白质组学联合基因富集分析筛选发现,GSNOR与糖尿病血管内皮功能障碍密切相关,并且进一步通过实验证实GSNOR在糖尿病患者及糖尿病模型小鼠的血管内皮细胞中表达显著升高(图1)。
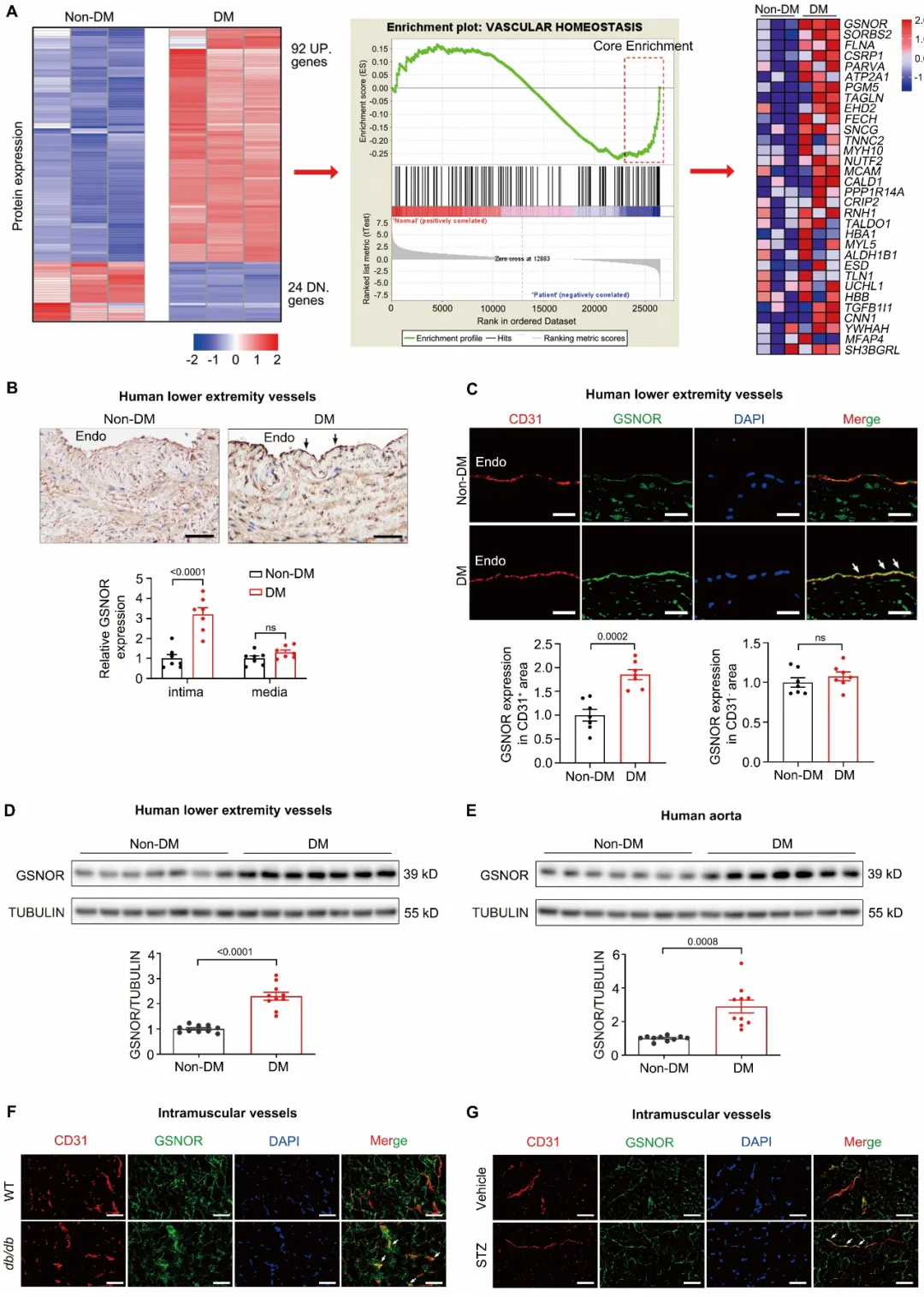
图1. 糖尿病导致血管内皮细胞中GSNOR表达升高
为了确定内皮细胞中GSNOR在糖尿病血管内皮功能障碍中的作用,该研究团队构建了内皮细胞特异性敲除GSNOR的小鼠。实验证据显示,内皮细胞特异性敲除GSNOR可促进糖尿病小鼠缺血侧肢的血流恢复和血管新生,并有效改善血管通透性(图2),表明内皮细胞中GSNOR在糖尿病血管内皮功能障碍中发挥重要作用。
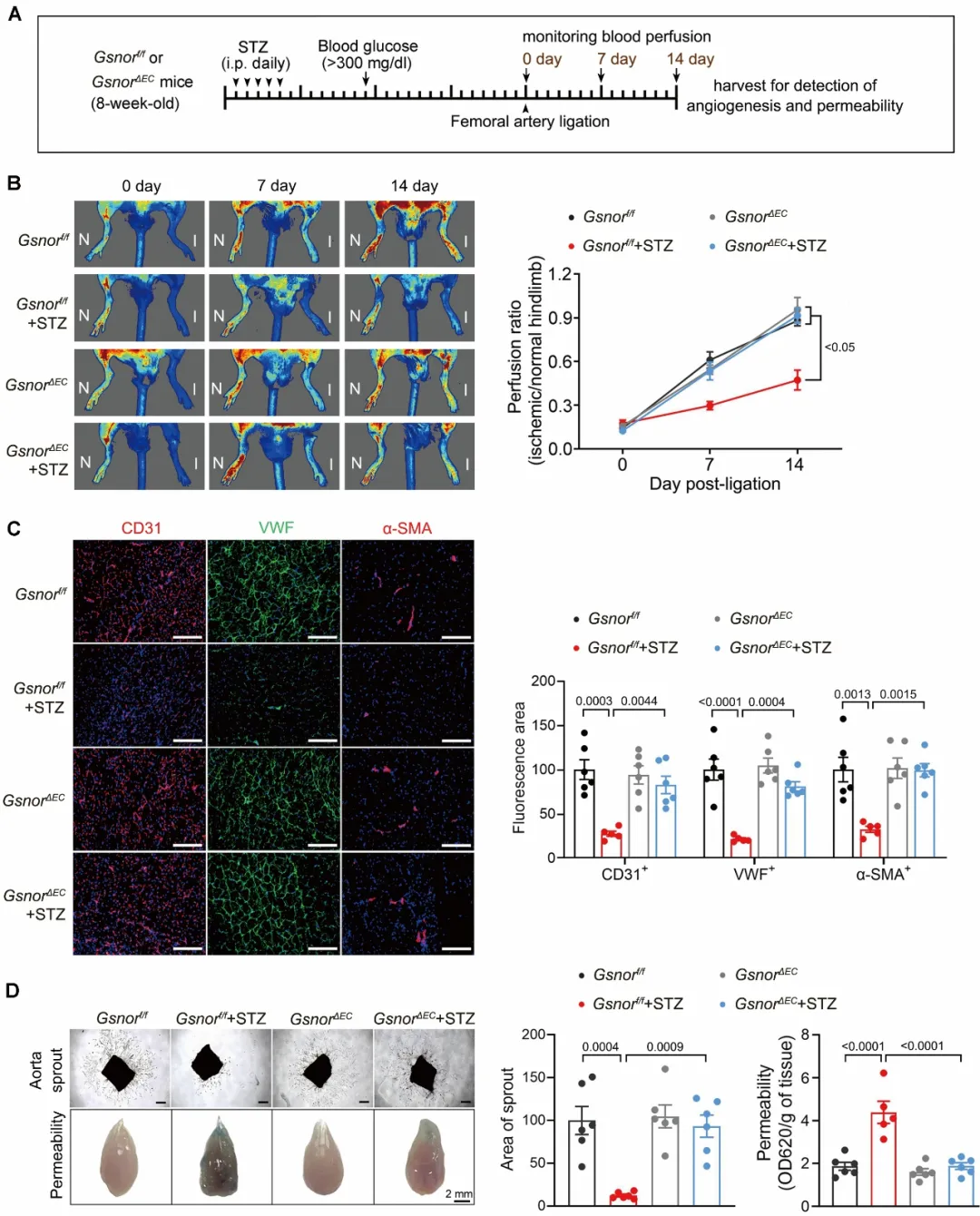
图2. 内皮细胞特异性敲除GSNOR改善糖尿病小鼠血管内皮功能障碍
为了阐明GSNOR参与糖尿病内皮功能障碍的具体机制,研究团队对GSNOR的两个关键酶活位点E67 (谷氨酸)和R368 (精氨酸)进行突变,构建了GSNOR活性位点突变小鼠,但是实验证实,活性位点突变对糖尿病小鼠血管内皮功能障碍并没有改善作用(图3),说明GSNOR介导的糖尿病血管内皮功能障碍不依赖其酶活功能。
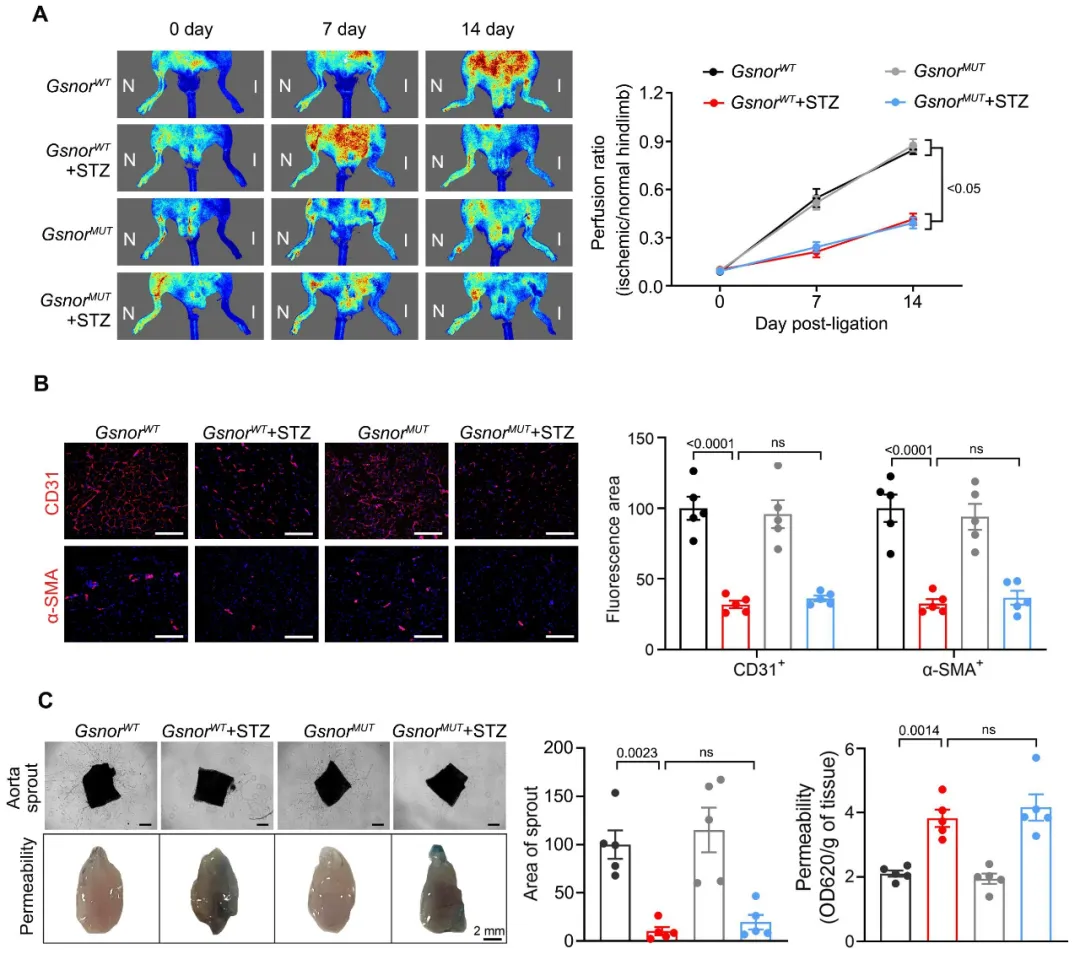
图3. GSNOR活性位点突变不能改善糖尿病小鼠血管内皮功能障碍
因此,研究团队又通过免疫共沉淀联合质谱筛选能与GSNOR发生互作的潜在下游靶点,进一步联合实验结果证实GSNOR能够与内皮细胞功能相关的转录因子ERG结合,并且研究团队发现GSNOR通过核输出蛋白CRM1依赖的通路,介导转录因子ERG的出核转运,进而抑制ERG下游血管稳态相关基因的表达,从而导致血管内皮功能障碍(图4)。该作用不依赖于GSNOR的酶活功能。
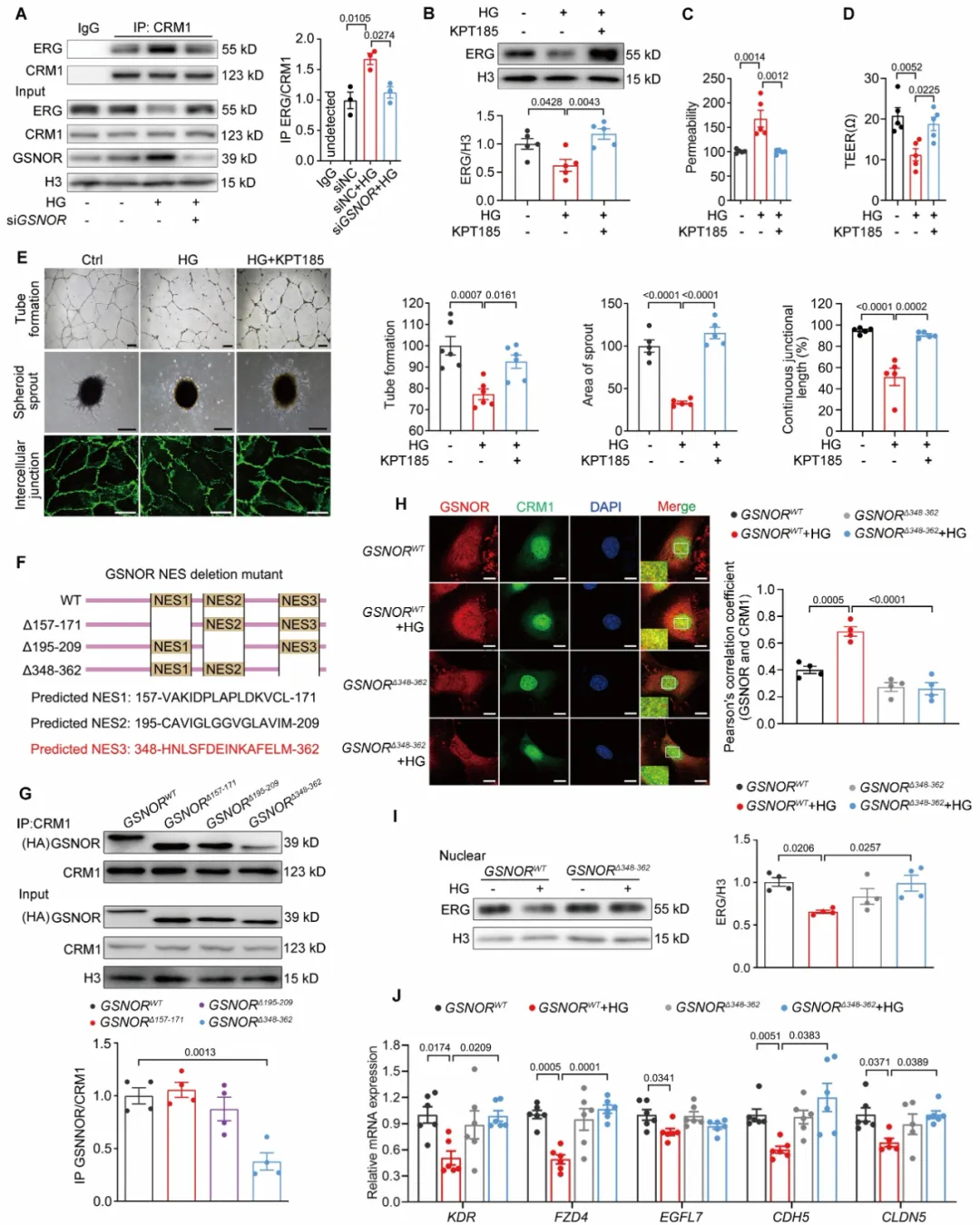
图4. GSNOR通过出核蛋白CRM1介导转录因子ERG的出核转运
基于该机制,研究团队设计并合成了口服小分子化合物NYY-001。通过蛋白质结构解析以及体外结合实验证实,该化合物可直接结合于GSNOR,进而有效阻断GSNOR与ERG的结合。细胞水平证实,NYY-001可有效改善高糖引起的内皮细胞成管能力、出芽能力和迁移能力的下降,以及细胞间连接的受损,并改善内皮细胞通透性(图5)。动物实验结果也证实,通过灌胃给予NYY-001能有效促进糖尿病小鼠下肢缺血后的血流恢复,促进缺血侧肢的血管新生,改善血管通透性。
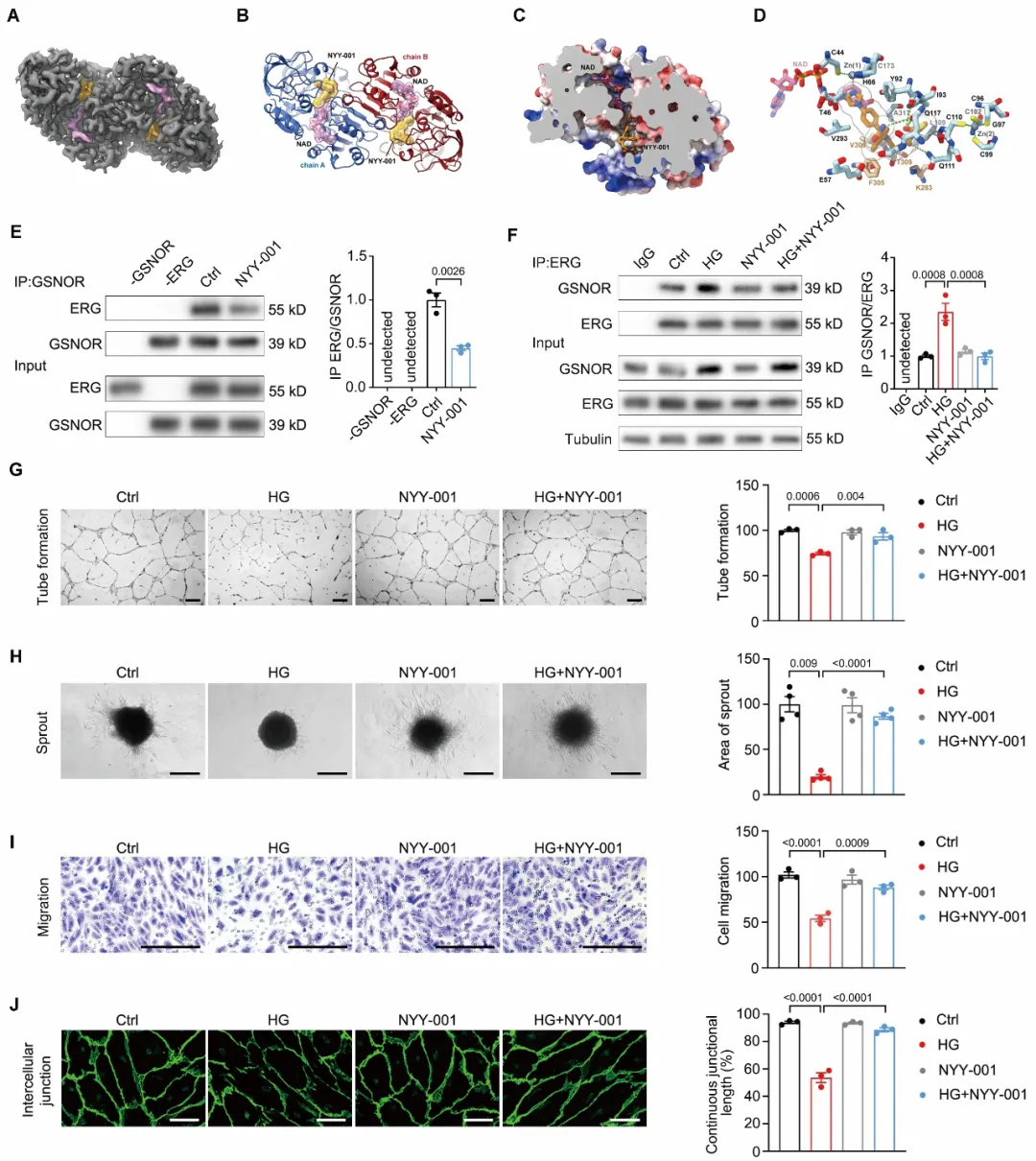
图5. NYY-001抑制GSNOR与ERG互作,改善高糖导致的内皮细胞功能障碍
季勇教授团队长期致力于GSNOR在心血管疾病中的作用研究,取得了一系列重大发现。团队前期研究揭示了GSNOR在心脏重构中的关键调控作用:首次阐明GSNOR通过调控LIM结构域肌蛋白(MLP)和热休克蛋白90 (HSP90)的巯基亚硝基化修饰,参与病理性心肌肥厚(Circulation. 2020;141(12):984-1000; Acta Pharmacol Sin. 2022;43(8):1979-1988);进一步发现E3泛素酶NEDD4介导的GSNOR泛素化降解在病理性心肌肥厚中发挥关键调控作用(Circ Res. 2025;136(4):422-438);此外,团队首次报道了GSNOR定位于心肌细胞线粒体,并通过调控腺嘌呤核苷酸转位酶1 (ANT1)的巯基亚硝基化修饰参与心力衰竭(Circ Res. 2023;133(3):220-236)。在此基础上,本研究进一步取得突破性进展,首次揭示GSNOR以非酶活依赖的全新方式,在糖尿病血管重构中发挥核心作用。这一发现不仅拓展了GSNOR的生物学功能认知,更为全面阐释其在心血管疾病中的多重角色提供了关键科学依据。该研究从全新视角解析了糖尿病血管并发症的分子机制,为临床干预提供了具有重要转化价值的新策略(图6)。
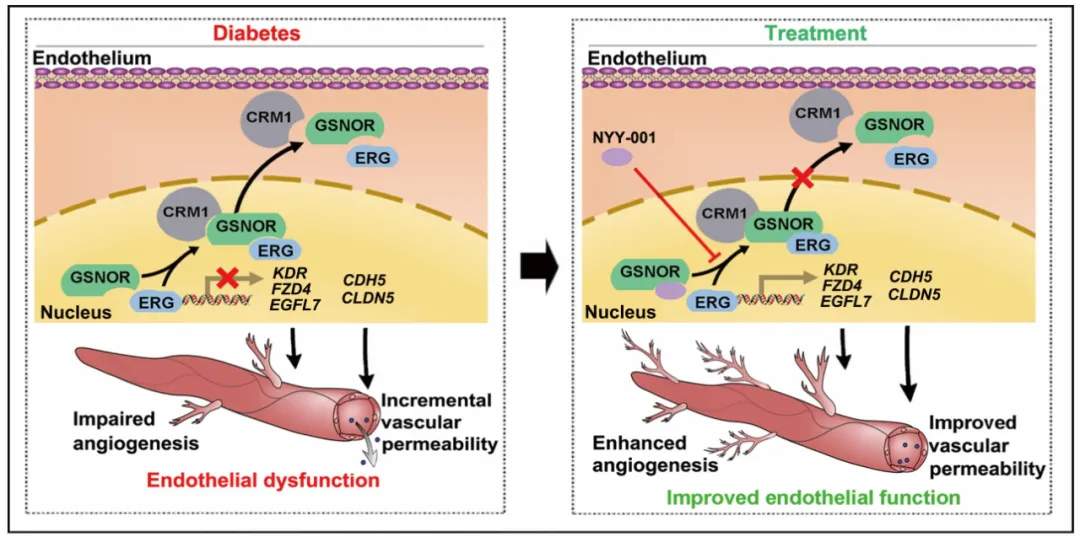
图6. NYY-001靶向GSNOR改善糖尿病血管内皮功能障碍机制图
哈尔滨医科大学寒地心血管病全国重点实验室和南京医科大学心脑血管疾病药物靶点与转化医学重点实验室的季勇教授、南京医科大学谢利平教授、哈尔滨医科大学附属第二医院韩艺教授为该论文的共同通讯作者。南京医科大学赵爽副教授、宋天宇博士、唐欣副教授为该论文共同第一作者。该工作得到了中国人民解放军北部战区总医院韩雅玲院士、闫承慧教授,南京医科大学陈峰教授、陈宏山教授、殷国勇教授、王连生教授、高原青教授,南京大学医学院附属鼓楼医院王东进教授,Temple University王虹教授,上海交通大学医曹禹教授,中国科学院遗传与发育生物学研究所王秀杰教授,哈尔滨医科大学于波教授、张志仁教授的大力支持。
原文链接:
https://www.science.org/doi/10.1126/scitranslmed.adn9216
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)