首页 > 医疗资讯/ 正文
肺是眼内转移性肿瘤的第二常见原发部位,转移性肺癌最常见的转移部位为脉络膜。然而,肺癌眼内转移表现为前葡萄膜炎或继发性青光眼的病例罕见,且常被误诊。本文报告 1 例IV期肺腺癌患者,其首发症状为前葡萄膜炎,无呼吸道症状。经过 28 个月的随访,患者接受了盐酸阿来替尼胶囊靶向治疗及一系列及时的眼科手术。经上述治疗后,患者眼内及颅内转移灶消失,肺部原发灶明显缩小,最佳矫正视力(BCVA)从手动(HM,仅能感知眼前手部晃动)/30 cm提高至 1.0。治疗期间未观察到明显毒副作用,预后良好。患者目前正常生活和工作,无并发症。本病例强调了在难治性前葡萄膜炎患者中考虑转移性肿瘤的重要性。联合多模态影像学检查和液体活检可提高眼内转移的早期诊断率。基于基因突变检测的靶向治疗联合恰当的眼科手术时机,对改善患者预后至关重要。

▲摘自《我国急性前葡萄膜炎临床诊疗专家共识(2016年)》
背 景
肺是眼内转移性肿瘤的第二常见原发部位,转移性肺癌占所有眼内恶性肿瘤的 39%-49%。这些眼部转移灶大多位于脉络膜(88%),小部分位于虹膜(9%)和睫状体(2%)。临床表现多样,包括虹膜肿块、虹膜睫状体炎和继发性青光眼。这给此类罕见病例的早期准确识别和制定合适的治疗策略带来了重大挑战。需要进行全面的眼部和颅脑检查,诊断可通过组织学或细胞学分析确认。此外,磁共振成像(MRI)和正电子发射断层扫描/计算机断层扫描(PET/CT)等影像学检查手段属于无创技术,不会对组织造成机械性损伤,从而最大限度降低肿瘤细胞扩散或种植的潜在风险。因此,它们可作为有创诊断操作的有效替代方案或补充工具。
人类肿瘤基因突变检测是指导癌症靶向治疗的重要工具。间变性淋巴瘤激酶(ALK)融合是非小细胞肺癌(NSCLC)的关键驱动基因之一。ALK酪氨酸激酶抑制剂(ALK-TKIs)已对ALK阳性NSCLC患者显示出显著的治疗效果。然而,基于ALK基因检测对NSCLC患者虹膜和睫状体转移灶进行靶向治疗的报道较为罕见。本病例报告讨论了 1 例最初以右眼前部葡萄膜炎为症状就诊的肺腺癌患者,该患者接受了ALK抑制剂盐酸阿来替尼胶囊治疗。本研究旨在为合并虹膜和睫状体转移灶的NSCLC的管理提供见解和有价值的信息。
病 例
患者女,36 岁,右眼前葡萄膜炎病史 28 个月,继发性青光眼病史 2 个月。患者同时有右眼视力下降、眼红及眼痛病史,无其他不适,无系统性疾病史。眼部检查显示,右眼最佳矫正视力为手动/30 cm;右眼眼压 43 mmHg。右眼前炎症明显,伴角膜水肿、角膜后沉着物(KP++)、前房反应(+)、细胞(++),前房变浅。瞳孔不规则,散大约 5 mm,无光反射,虹膜完全后粘连;虹膜纹理不清,表面可见多发灰白色结节。晶状体部分混浊,眼底不清(图1)。瞳孔阻滞和房水流出道阻塞被确定为该患者眼压升高的主要原因。然而,经抗炎药物、散瞳药物及降眼压药物治疗后,效果不佳。胸部X线片显示右肺门区结节,进一步胸部CT示右肺中叶(内段)结节,大小约 16.6×12.1 mm,边缘分叶、毛刺状(图1)。为明确病变性质,行支气管镜下活检,取肺内病变组织进行病理检查。组织学检查显示,肺标本可见散在的异型细胞团,伴出血背景(图2)。免疫组化染色显示P-CK、CK7、TTF1、CD44V6及Ki-67阳性表达,P40及CK5/6阴性表达。诊断为IV期肺腺癌。
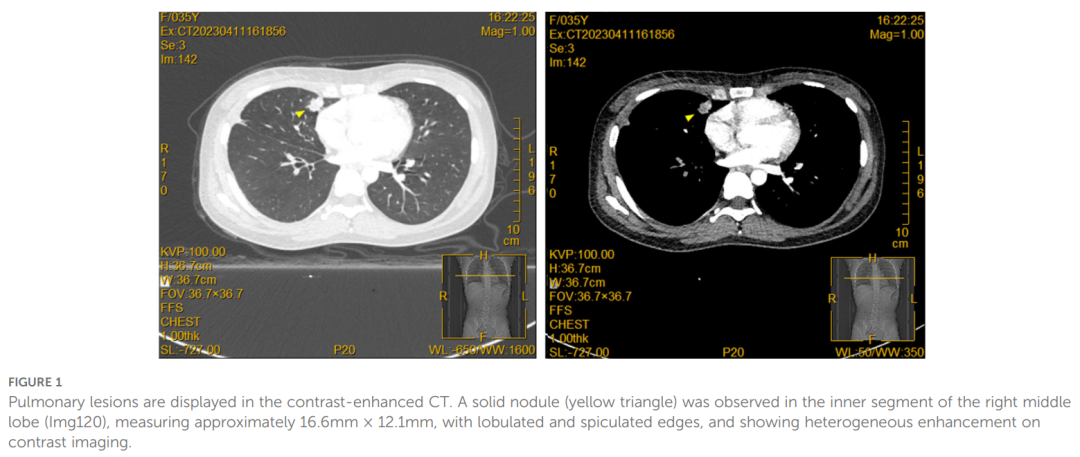
▲图1 增强CT显示肺部病变,右中叶内段可见一实性结节
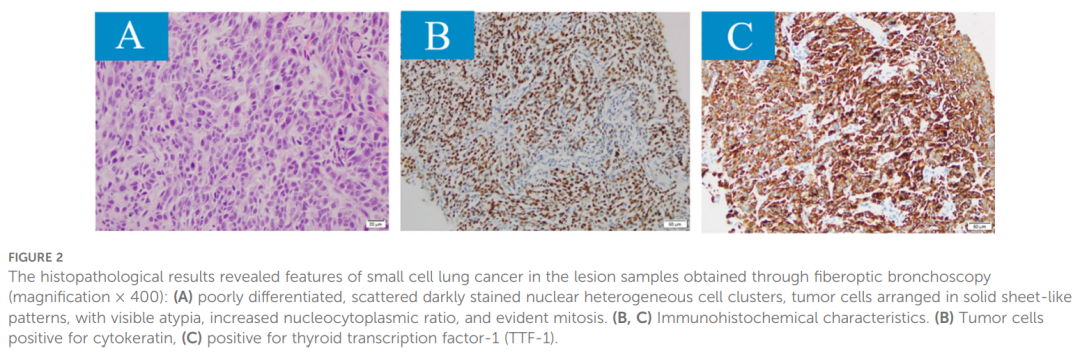
▲图2 组织病理学结果显示,经纤维支气管镜检查(放大×400)获得的病灶标本具有小细胞肺癌的特征
鉴于肺癌眼部转移的罕见性,对右眼房水进行涂片检查(图3),涂片可见少量肿瘤细胞及小的异型细胞团;核质比增高,细胞及细胞核均显示异型性特征。颅脑MRI亦证实(图4)右眼球前下壁结节状病变,T1加权像呈等信号,T2加权像呈稍高信号。根据眼解剖学定位,病变位于右眼虹膜下颞侧及睫状体。此外,左侧脑桥、双侧小脑半球、额顶叶及左侧颞叶可见多发结节状异常信号,T1加权像呈稍低信号,T2加权像呈稍高信号。上述表现符合肺癌眼内及颅内转移。
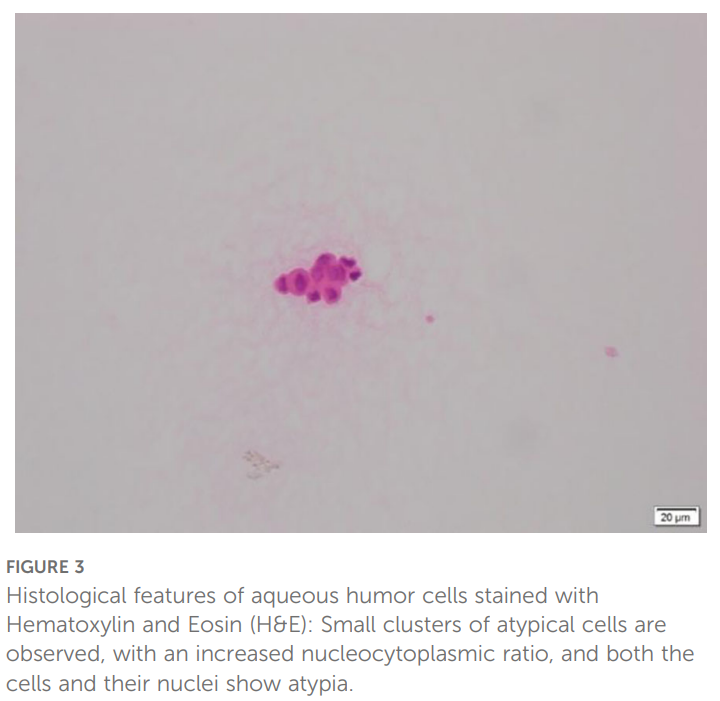
▲图3 房水细胞HE染色的组织学特征
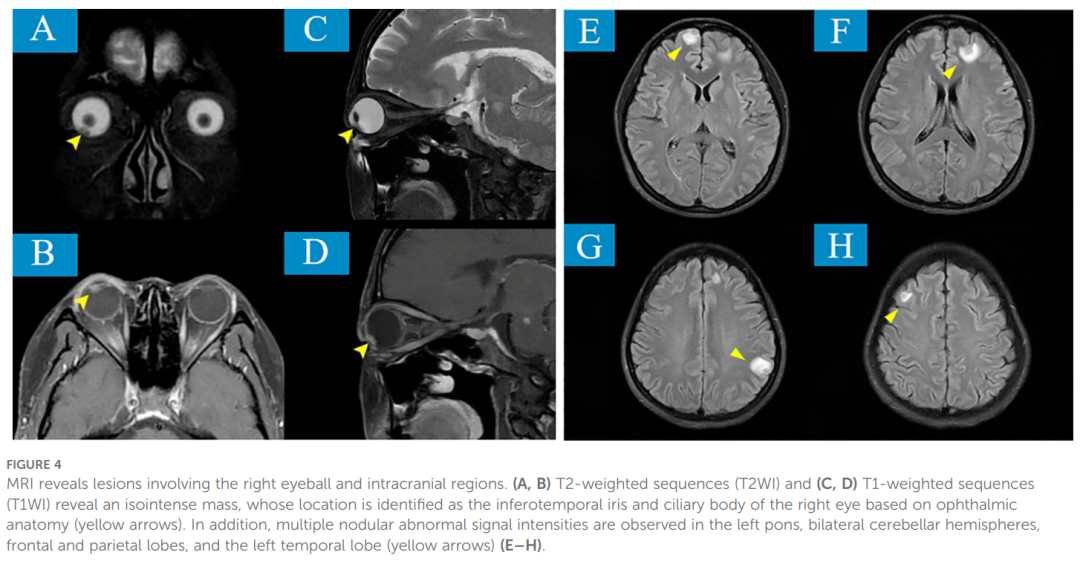
▲图4 MRI显示病变累及右眼球及颅内区域
为排除其他可能病变,遂行正电子发射断层扫描/计算机断层扫描(PET/CT)检查。结果证实存在颅内及眼部转移:右眼前下壁可见稍高密度结节,边界不清,糖代谢增高,最大标准摄取值(SUVmax)约为 4.6;左额叶可见环形高密度结节,大小约 8×8 mm,最大标准摄取值(SUVmax)约为 12.3。此外,右腋窝尾部可见小淋巴结肿大,最大标准摄取值(SUVmax)约为 2.0(图5)。
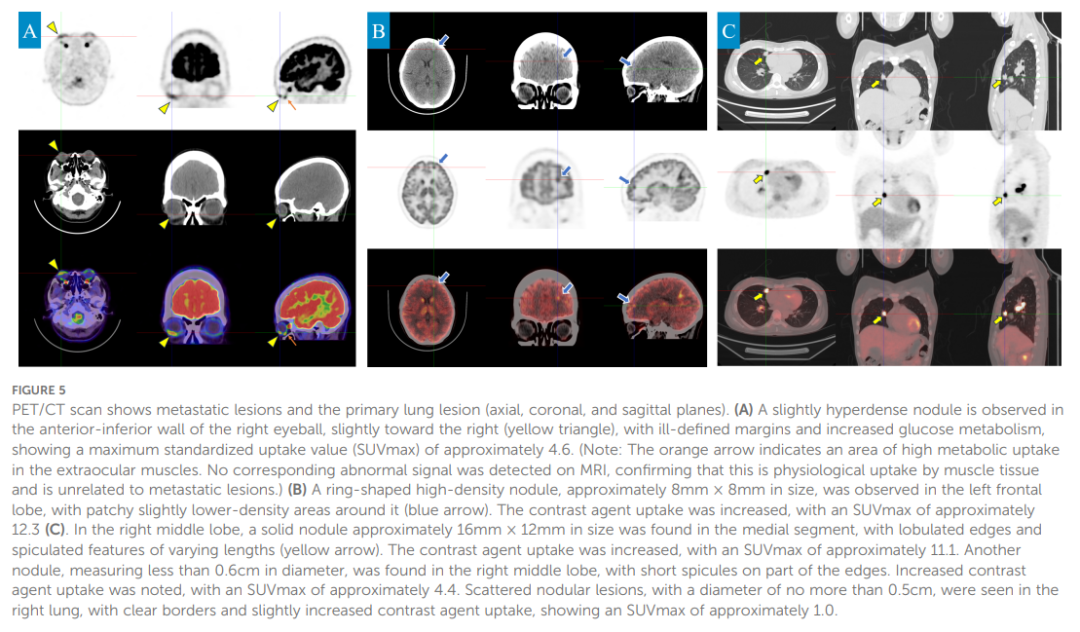
▲图5 PET/CT扫描显示转移性病灶及原发性肺病灶(轴位、冠状位、矢状位)
进一步行肿瘤基因突变检测,结果显示ALK融合基因阳性。2023 年 6 月 19 日,患者开始接受一线抗癌治疗,口服盐酸阿来替尼胶囊 600 mg,每日两次。治疗两个月后,疗效显著:眼部转移灶完全消退(图6);右下肺胸膜下病灶明显吸收,右肺中叶内侧段实性结节体积显著缩小,右肺门淋巴结明显缩小,达到部分缓解(PR)。截至 2025 年 3 月 25 日,右肺中叶结节已从 16.6×12.1 mm缩小至7mm×3mm(图7)。
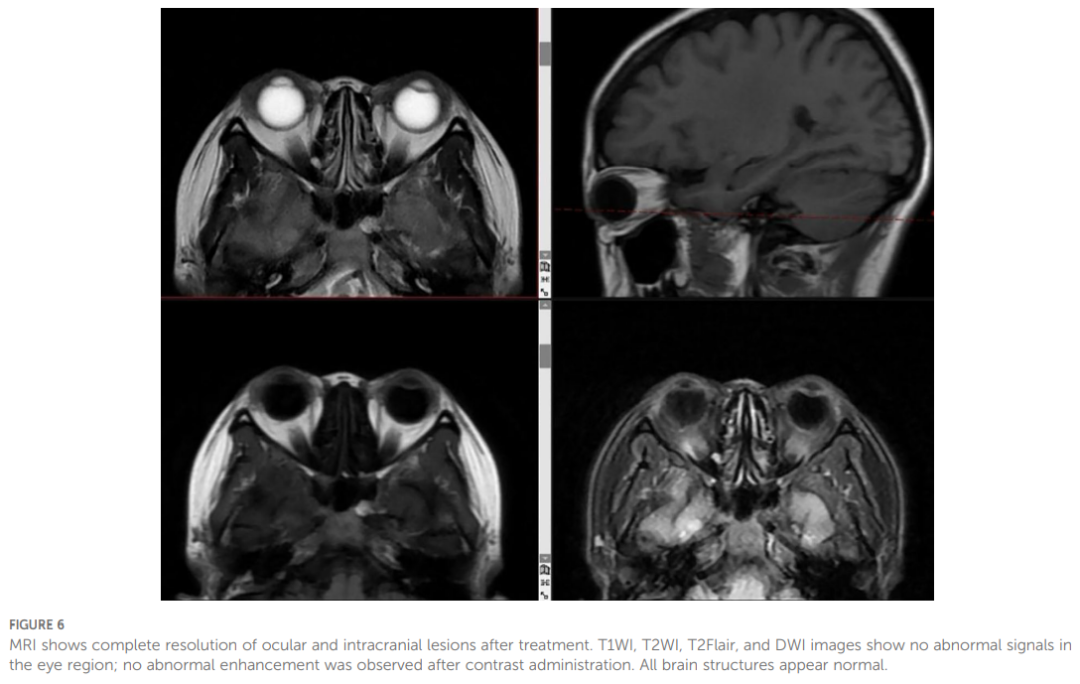
▲图6 MRI检查显示治疗后眼部及颅内病变完全消退
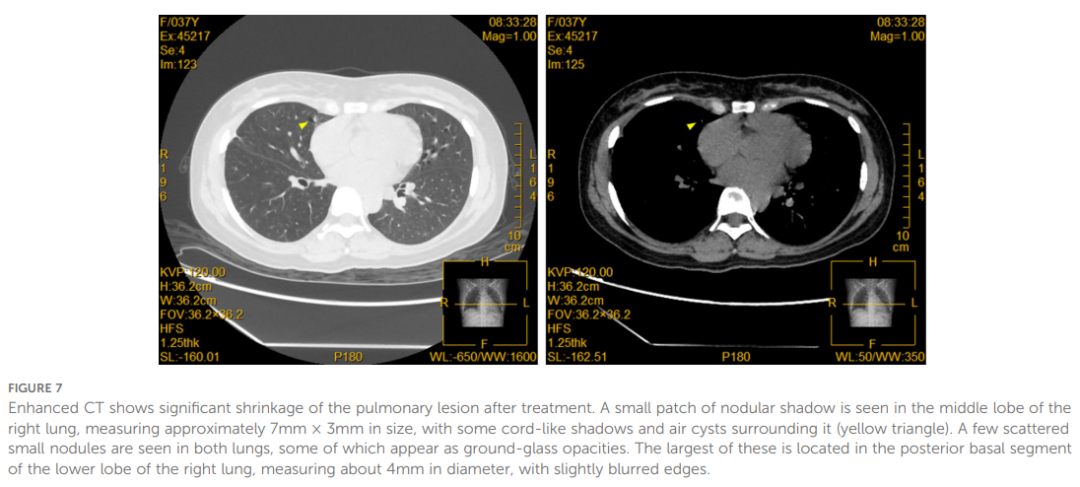
▲图7 增强CT示治疗后肺部病灶明显缩小
此外,患者右眼发生继发性青光眼伴虹膜完全后粘连。尽管使用了妥布霉素-地塞米松滴眼液、毛果芸香碱滴眼液、硫酸阿托品滴眼液、噻吗洛尔滴眼液及口服乙酰唑胺,眼压(IOP)仍持续维持在 40 mmHg左右。2023 年 5 月 10 日,患者接受右眼周边虹膜切除术、房角分离术及前房成形术,术后眼压稳定在 35 mmHg左右。患者右眼还发生了继发性白内障,最佳矫正视力(BCVA)为 0.05。待眼部炎症相对稳定且与患者充分沟通后,于 2023 年 10 月 21 日行白内障超声乳化联合人工晶状体植入术。术后,最佳矫正视力提高至 0.4,眼压维持在 27 mmHg左右。由于眼压控制不佳,2024 年 1 月 28 日患者接受右眼青光眼阀植入术及前房成形术。术后眼压降至 18 mmHg,最佳矫正视力恢复至 0.15。患者还接受了非甾体类和糖皮质激素滴眼液以控制炎症,β受体阻滞剂、α2肾上腺素受体激动剂及前列腺素F2α类似物以降低眼压,以及硫酸阿托品凝胶以散瞳并预防虹膜-晶状体粘连。眼压稳定在 18-20 mmHg。2024 年 11 月 18 日,患者出现明显的后发性白内障。在主治医师的鼓励下,患者接受了后囊膜切开术,术后最佳矫正视力提高至 1.0。此后,最佳矫正视力一直稳定在1.0(靶向治疗前后眼前段对比图像见图8)。
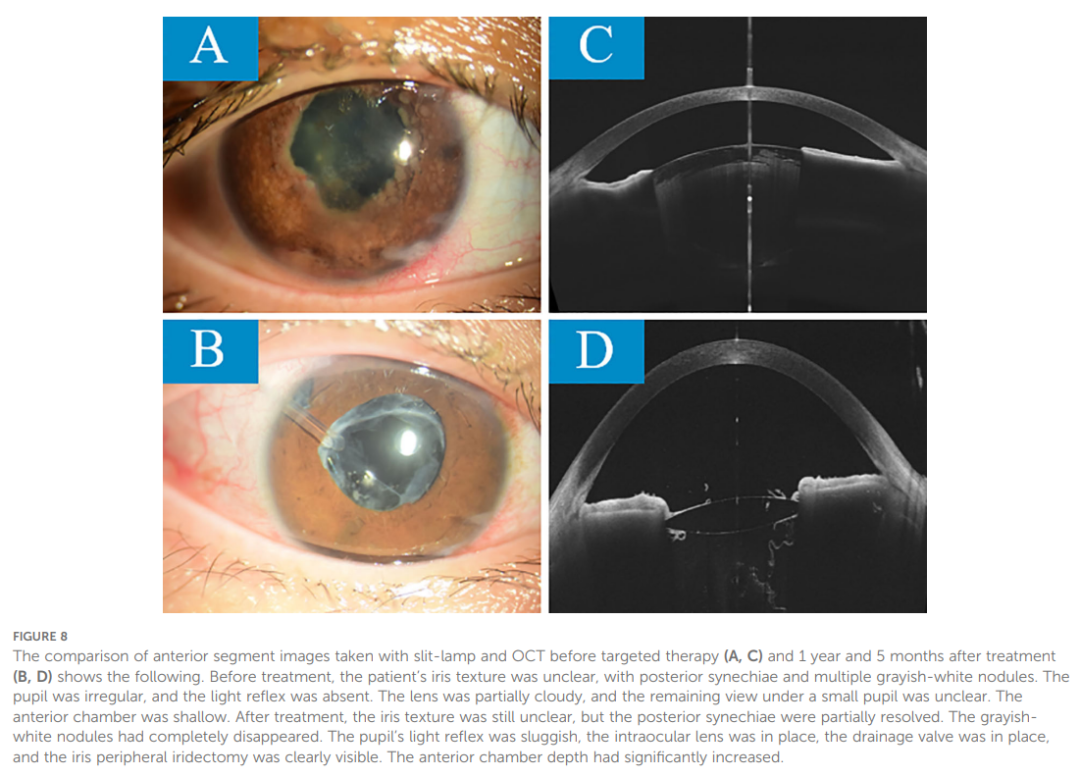
▲图8 靶向治疗前(A、C)及治疗后1年5个月(B、D)裂隙灯及OCT眼前节图像对比
总体而言,患者表现出良好的治疗耐受性。在接受盐酸阿来替尼胶囊靶向治疗期间,未观察到明显的毒性反应。患者身体状况良好,无明显免疫毒性或过敏反应。
讨 论
本病例报告描述了一名 36 岁女性患者,最初表现为右眼前葡萄膜炎和继发性青光眼,最终诊断为IV期肺腺癌伴眼内及多系统转移,属于罕见病例。该病例的临床演变、诊断挑战及治疗反应为肿瘤转移机制和靶向治疗的临床应用提供了重要见解。
眼内转移占所有恶性肿瘤的 2-9%,其中多数起源于乳腺癌和肺癌,9-23% 来源于肺部原发灶。然而,肺癌转移至眼部并表现为前葡萄膜炎和继发性青光眼的情况尤为罕见,且易被误诊为特发性炎症性疾病。本病例的独特性在于:①患者为年轻女性,无吸烟史,不符合传统肺癌高危人群特征;②患者表现为孤立性前葡萄膜炎,无典型呼吸道症状。患者最初表现出右眼前葡萄膜炎的典型体征(角膜水肿、角膜后沉着物(KP++)、前房反应(+)、细胞(++)、约0.5mm前房积脓、瞳孔不规则散大(约 5 mm)、光反射消失、虹膜完全后粘连、虹膜纹理不清、表面散在灰白色结节)及显著眼压升高(43 mmHg),常规抗炎及降眼压治疗无效,提示需考虑非炎症性病因。胸部CT显示肺部原发灶,经支气管镜活检证实为肺腺癌(TTF1+/CK7+)。最终通过房水细胞学检查和脑部MRI证实眼内及中枢神经系统转移。这一过程凸显了眼部症状作为系统性恶性肿瘤“哨兵表现”的重要性,尤其是在难治性前葡萄膜炎患者中,应积极排除肿瘤相关病变。在眼内转移所致的伪装综合征中,脉络膜血流丰富,是最常见的转移部位。相比之下,前房血流较少,故前房转移更为罕见,仅占眼内转移的 7-14%。值得注意的是,在罕见情况下,眼痛及类似巩膜炎的症状可能提示潜在转移,甚至作为隐匿性恶性肿瘤的初始表现,其机制与肿瘤细胞经血行播散至虹膜血管或睫状前动脉有关。
本病例的诊断突破依赖于多模态影像的互补整合及分子病理学检测。影像方面,胸部CT显示的毛刺状和分叶状特征(图1)提示恶性可能,而PET-CT显示的病灶代谢异质性(最大标准摄取值 4.6-16.9)为转移灶定位提供了功能学证据。分子病理学方面,肿瘤细胞表达TTF-1/CK7且P40阴性,符合肺腺癌特征,而ALK融合基因的检出直接改变了治疗策略。ALK融合约占非小细胞肺癌(NSCLC)的 5%,最常见于肺腺癌。既往研究表明,ALK重排肿瘤具有高度侵袭性,易早期转移,尤其是中枢神经系统和眼部,转移率显著高于其他亚型。本病例中,除眼内转移外,患者还存在多发脑实质病变(脑桥、小脑、额顶叶),PET-CT进一步显示纵隔及腋窝淋巴结受累,符合ALK阳性肿瘤“多灶转移”的特征。
接受盐酸阿来替尼胶囊治疗 2 个月后,患者眼部病变完全消退(图6),原发灶缩小(部分缓解,PR),验证了该药物良好的中枢神经系统穿透性。值得注意的是,靶向治疗后眼部转移灶迅速缓解,为后续视力重建手术(白内障超声乳化联合人工晶状体植入等)创造了条件,最终取得理想效果(最佳矫正视力 1.0)。28 个月持续随访显示,原发灶稳定在 7×3 mm(图7),远超传统化疗的中位无进展生存期(PFS)。这为转移性肺癌的长期管理提供了新范式。
本病例成功的关键还在于及时选择眼科干预措施:患者在全身肿瘤控制前接受了周边虹膜切除术+房角分离术+前房成形术。术后眼压控制不佳。然而,在靶向药物治疗后,待眼部炎症稳定,患者接受了白内障超声乳化术+人工晶状体植入术及青光眼阀植入术+前房成形术。术后患者眼部情况得到有效控制,未观察到眼内转移复发。此外,患者对治疗的依从性及定期随访体现了医患关系的价值。这种序贯治疗策略使患者在控制肿瘤的同时维持了功能性视力,该经验或可适用于其他眼内转移性肿瘤患者。
本病例强调,在难治性前葡萄膜炎的鉴别诊断中需纳入转移性肿瘤。联合多模态影像和液体活检可提高眼内转移灶的早期诊断率。基于NGS检测指导的靶向药物应用凸显了精准治疗的重要性。眼科手术时机应遵循“全身控制优先,功能重建在后”的原则。未来需进一步研究阐明眼内转移的分子机制及靶向药物在眼内的药代动力学特征,以进一步优化治疗策略。
参考文献:
Zhao C, Chen J, Liu H, Dai Y. Case Report: Ocular metastasis from ALK-rearranged pulmonary adenocarcinoma presenting as a pseudo-syndrome of anterior uveitis. Front Oncol. 2025 Aug 13;15:1619667. doi: 10.3389/fonc.2025.1619667. PMID: 40881885; PMCID: PMC12380888.
猜你喜欢
- 接种了新冠疫苗,哪些人仍容易患重症?
- JAMA子刊:俯卧位心电图中容易被忽视的表现
- 输卵管堵塞哪些治疗误区需警惕
- European Radiology:双灶性肝细胞癌术后预测远期预后的影像学因素
- Rheumatology (Oxford):Deucravacitinib 16周显著改善PsA患者最小疾病活动达标率及关节、皮肤和患者报告结局
- 关不掉的手机APP广告,该治
- 儿科7个医生,4个送外卖被热议!一市卫健局发文:人民医院、各乡镇卫生院全部撤销产科和儿科!年轻医生有3大压力!有人托底是一件幸事
- 新冠疫苗第二代来了,比第一代有何进步?服贸会全球首发
- 实体肿瘤临床疗效评价标准(RECIST 1.1) | 干货收藏
- 医美行业也该来一次大“整形”
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)