首页 > 医疗资讯/ 正文
术后复发是非小细胞肺癌(NSCLC)治疗中的主要难题。其肿瘤微环境往往呈现“T细胞功能耗竭 + M2型巨噬细胞占主导”的深度免疫抑制状态,导致免疫治疗反应率低、效果难以持续。要打破这一僵局,不仅需要增强肿瘤免疫原性、有效激活先天免疫,还必须解除肿瘤相关巨噬细胞(TAM)引起的免疫抑制,将其重塑为抗肿瘤M1表型。
香港理工大学与广东省人民医院团队报道了一种一体化联动平台:以FePt为核心的生物仿生纳米囊泡(FP/Vad@CC-aT2),其外覆肺癌细胞膜(CCM)以实现同源归巢与免疫伪装,膜表面通过Sulfo-SMCC偶联anti-TREM2抗体以精准干预TREM2+ TAM,平台内载小分子STING激动剂Vadimezan(DMXAA),并借助FePt在X射线照射下催化Fenton反应产生•OH,从而在肿瘤局部同时触发铁死亡、激活cGAS-STING通路并重塑TAM表型,形成“铁死亡—先天免疫—适应性免疫”的级联放大。
该研究以题为“Anti-Triggering Receptor Expressed onMyeloid Cells 2 - Conjugated NanovesiclesLoaded Vadimezan Reprogram TumorAssociated Macrophages to Combat RecurrentLung Cancer”发表在《ACS Nano》期刊上。

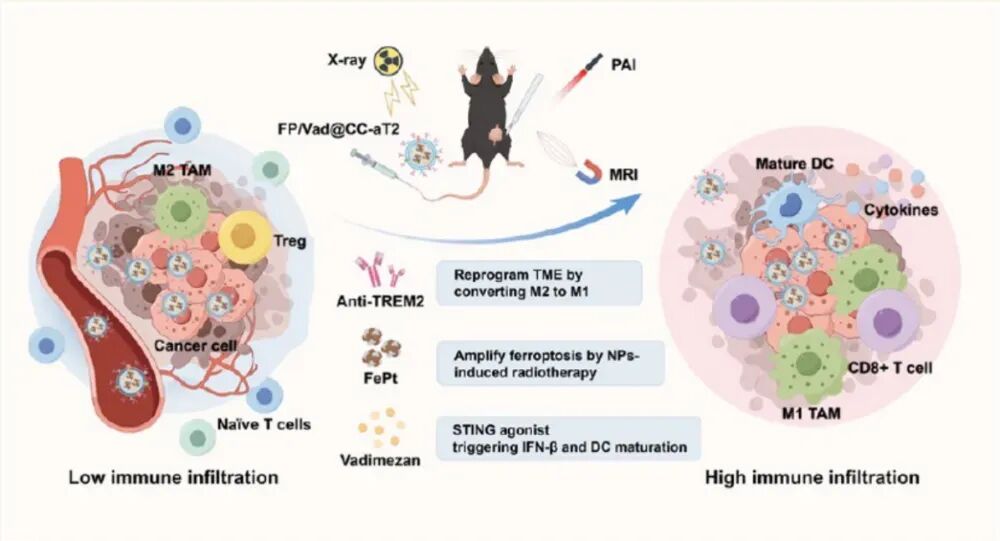
机制上,这一平台的协同逻辑高度耦合:CCM(保留Galectin-3、CD44、E-cadherin等分子)提供肿瘤同源黏附,确保药物在TME高效蓄积;X射线触发FePt释放Fe2+并放大Fenton化学,显著提升胞内ROS与脂质过氧化(LPO),抑制GPX4、升高4-HNE并诱导免疫原性细胞死亡(ICD),同时线粒体损伤产生的胞质dsDNA提高cGAS对mtDNA的感受性,增强cGAMP合成与STING亲和力。
与此并行,囊泡内包载的Vad在微酸性TME加速释放,直接驱动STING-TBK1-IRF3轴磷酸化放大,协同上游铁死亡信号实现“内外双通道”激活STING的先天免疫体系;而表面anti-TREM2阻断了TREM2介导的免疫抑制网络,推动TAM向CD86+的M1样表型转化,提高抗原呈递与促炎细胞因子分泌,最终促进树突状细胞(DC)成熟(CD80+CD86+)与CD8+细胞毒T淋巴细胞(CTL)深度浸润,并伴随Treg下调与IFN-γ/TNF-α显著升高,使术后“冷”肿瘤转热。
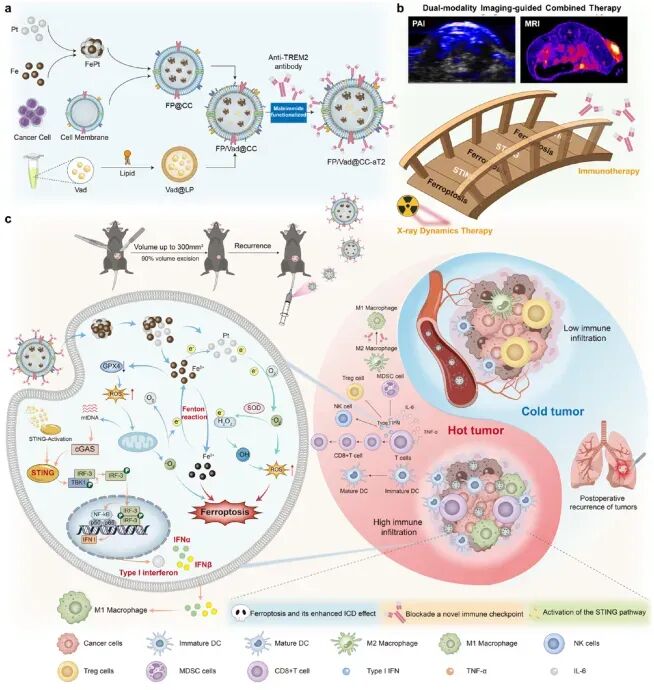
图1. FP/Vad@ CC-aT 2纳米囊泡的构建及其改善抗肿瘤放射免疫疗法的潜在能力的示意图
材料学与成像层面,多功能纳米囊泡 FP/Vad@CC-aT2 成功合成。它由核心(FePt纳米颗粒、STING激动剂Vadimezan)、伪装层(癌细胞膜CCM)和表面功能分子(抗TREM2抗体)构成。通过一系列表征技术(如电镜、电位分析、EPR谱等)证实了其稳定的形貌、成功的抗体修饰、pH响应性药物释放能力、高效的羟基自由基(·OH)产生能力以及作为MRI/PAI双模态成像探片的潜力。
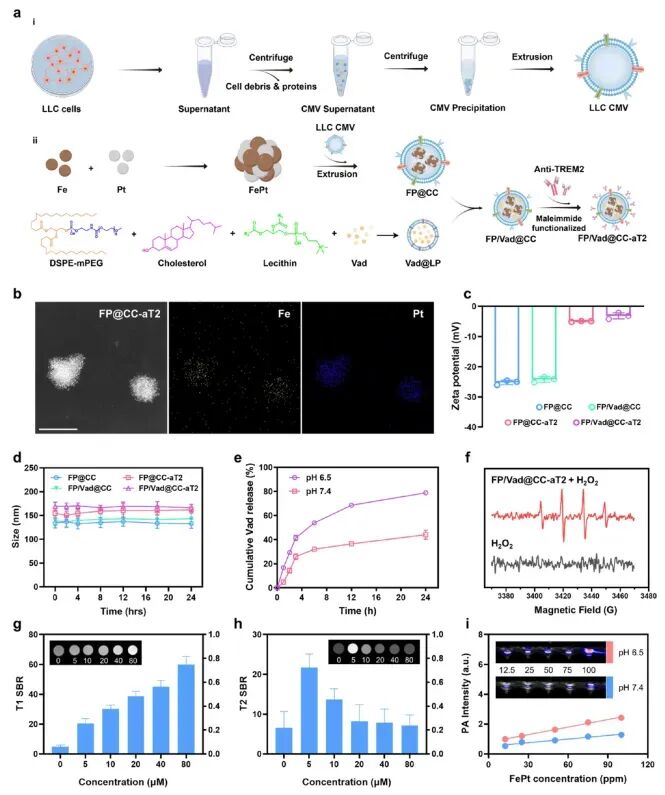
图2.纳米囊泡的合成和综合表征
随后通过细胞实验证明,纳米颗粒能被肿瘤细胞高效摄取。在X射线照射下,其FePt核心能催化Fenton反应,显著提升细胞内活性氧(ROS)和脂质过氧化物(LPO)水平,并下调关键抑制蛋白GPX4的表达,从而有效诱导铁死亡。这种细胞死亡可被铁死亡抑制剂Fer-1所逆转。抗TREM2显著增强RAW264.7巨噬细胞对肿瘤球的迁移、浸润与吞噬,证实了其作用机制。
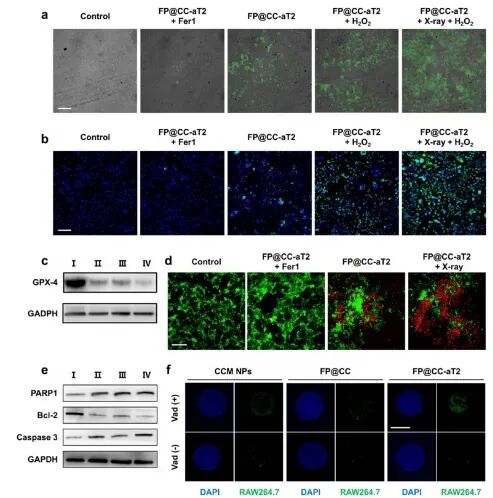
图3.基于FP@ CC-aT 2的纳米平台的体外研究
接下来的动物实验表明,纳米颗粒注射后能在肿瘤部位高效富集,并在4小时左右达到峰值。其作为造影剂能提供清晰的T1/T2加权磁共振(MRI)和光声(PA)成像信号,实现了对肿瘤的精准定位和药物富集过程的实时监控,为后续治疗时机的选择提供了依据。
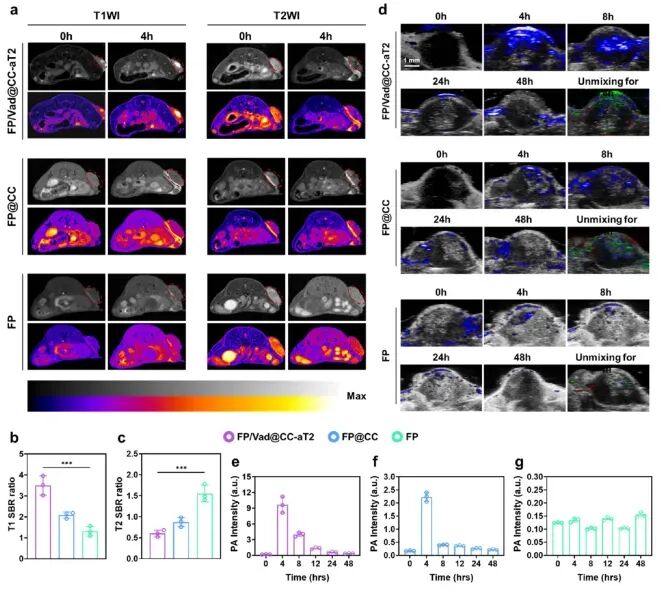
图4.在注射FP/Vad@CCaT2、FP@CC和FP后不同时间点(0、4、8、24和48小时)的LLC荷瘤小鼠的体内PA和MR图像
在皮下肺癌模型中,FP@CC-aT2 联合X射线治疗组显示出最佳的肿瘤抑制效果,能显著诱导免疫原性细胞死亡(ICD),并延长小鼠生存期,且未观察到明显的系统性毒性,证明了其良好的生物安全性。
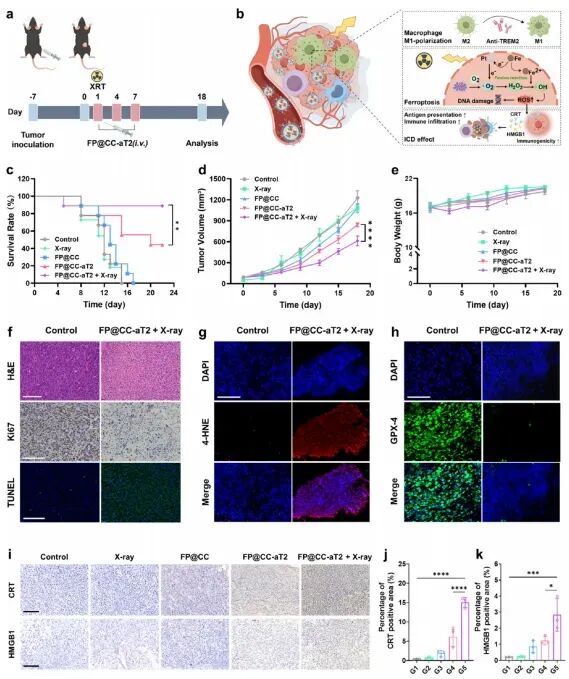
图5. FP@ CC-aT 2和X射线在抑制LLC原发性肿瘤生长中的协同抗癌作用和作用机制
对肿瘤组织的RNA测序分析揭示,纳米颗粒治疗显著改变了免疫相关基因的表达谱,富集了T细胞分化、自然杀伤细胞介导的细胞毒性等通路,从基因组层面证实了其能将免疫抑制性微环境重塑为免疫激活状态。
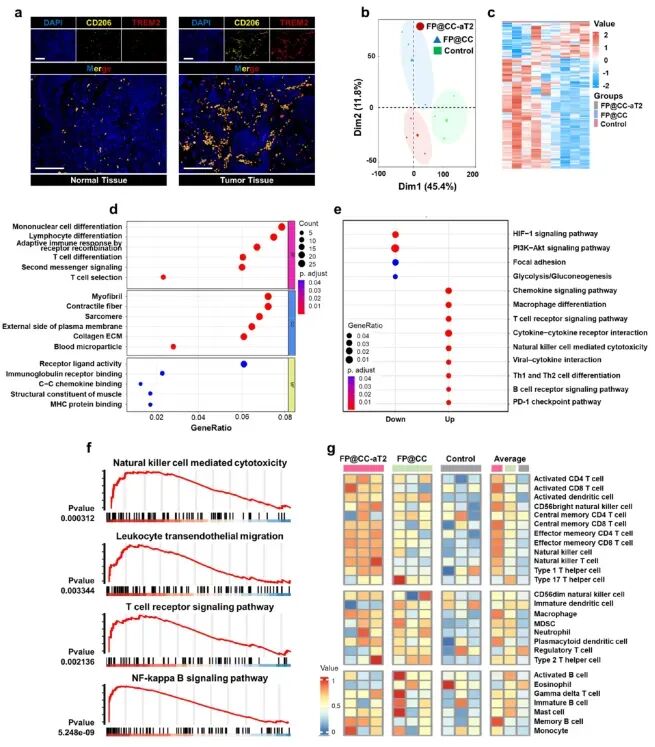
图6.通过转录组学分析确定FP@ CC-aT 2介导的抗肿瘤免疫治疗机制
更具转化意义的是术后复发模型与原位肺癌复发风险模拟中,FP/Vad@CC-aT2+X射线显著延长生存、抑制复发,个体肿瘤生长曲线呈一致性响应;机制层面,肿瘤组织中p-STING/p-TBK1/p-IRF3显著上调,转录组学显示抗原呈递与干扰素通路被整体拉升。
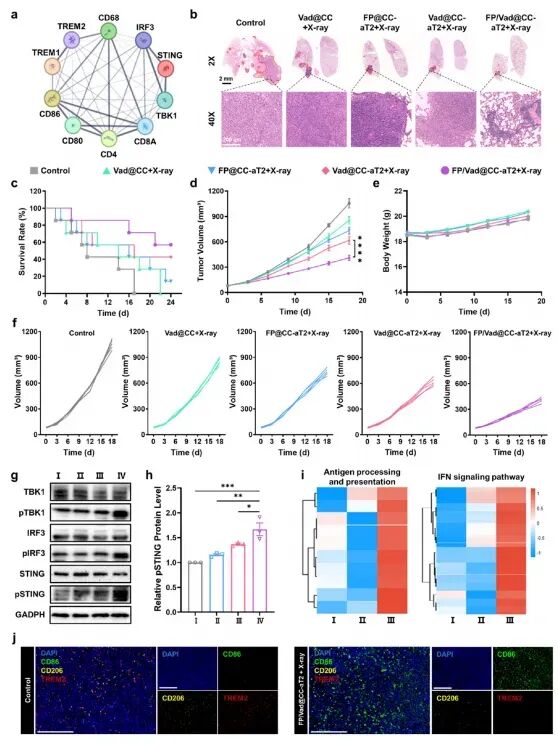
图7. FP/Vad@ CC-aT 2与放射治疗抑制术后LLC复发肿瘤的协同抗癌功效和机制
研究通过流式细胞术、ELISA、免疫荧光等多种技术证实,联合治疗能协同发挥三大作用:①诱导铁死亡;②通过Vad激活STING通路;③通过抗TREM2抗体将M2型巨噬细胞极化为抗肿瘤的M1型。这最终导致树突状细胞(DCs)成熟、细胞毒性T淋巴细胞(CTLs)浸润显著增加,关键细胞因子(TNF-α, IFN-γ)分泌上升,从而彻底逆转免疫抑制微环境,攻克了术后复发肺癌治疗的核心难题。
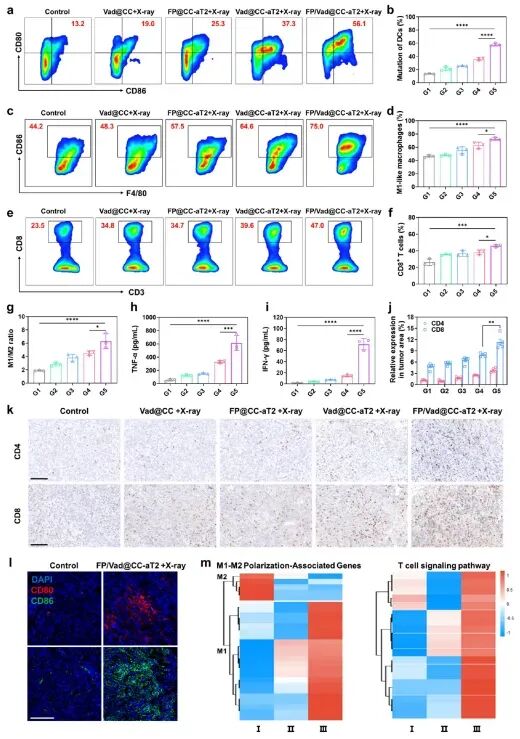
图8.FP/Vad@ CC-aT 2与放射疗法协同逆转免疫抑制性TME
需要强调的现实考量是小分子Vad(DMXAA)存在“鼠人STING选择性差异”的经典问题,后续跨物种转化可能需采用人源STING可激动分子替代,并在临床相关放疗强度、给药时序与ICI联合路径上进行系统优化;同时,TREM2在不同肿瘤谱系的功能异质性、金属纳米材料的长期蓄积与慢性毒性评估也需在GLP与更大动物模型中完善。总体而言,该研究以“仿生递送+影像引导+三轴免疫协同”的整合范式,为术后复发性肺癌这一“免疫冷却型”难治场景提供了强有力的前瞻性方案:先用成像确定富集峰值,再于最佳窗口低剂量放疗触发铁死亡与STING双激活,同时用抗TREM2重编程TAM并放大抗原呈递与T细胞回应;若进一步与PD-1/PD-L1抑制剂进行时序化整合,辅以影像-生物标志物伴随监测,具有发展为可验证、可迭代的临床放-免一体化精准治疗路径的潜力。
参考文献:
Anti-Triggering Receptor Expressed on Myeloid Cells 2-Conjugated Nanovesicles Loaded Vadimezan Reprogram Tumor-Associated Macrophages to Combat Recurrent Lung Cancer,ACS Nano,DOI: 10.1021/acsnano.5c10375;
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.5c10375
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)