首页 > 医疗资讯/ 正文
摘 要
目的 探讨亚厘米非小细胞肺癌气腔播散(spread through air space,STAS)与临床特征及影像学特征的相关性,构建nomogram风险预测模型,为亚厘米非小细胞肺癌患者术前规划提供参考。方法 回顾性分析2022年1月—2023年10月于南京大学医学院附属鼓楼医院接受手术治疗且术后病理确诊为亚厘米非小细胞肺癌患者的临床资料。根据病理诊断肿瘤是否伴随STAS,将其分为STAS阳性组以及STAS阴性组。收集两组患者的临床和影像资料,进行单因素logistic回归分析,将差异具有统计学意义的变量纳入多因素分析,最终筛选出肿瘤发生STAS的独立危险因素,并构建nomogram模型。根据约登指数计算出灵敏度和特异度,并通过曲线下面积(area under the curve,AUC)、校准曲线和决策曲线分析(decision curve analysis,DCA)评估模型的效能。结果 共纳入112例患者。STAS阳性组17例,其中男11例、女6例,平均年龄(59.0±10.3)岁;STAS阴性组95例,其中男30例、女65例,平均年龄(56.8±10.3)岁。单因素logistic回归分析显示,男性、抗GAGE7抗体阳性、平均CT值、毛刺征与STAS的发生相关(P<0.05)。多因素logistic回归分析表明,STAS与男性[OR=5.974,95%CI(1.495,23.872)]、抗GAGE7抗体阳性[OR=11.760,95%CI(1.619,85.408)]和平均CT值[OR=1.008,95%CI(1.004,1.013)]相关性仍然显著(P<0.05),而与毛刺征的关联不再显著(P=0.438)。基于上述3项独立预测因素构建亚厘米非小细胞肺癌STAS的nomogram模型。模型AUC值为0.890,灵敏度为76.5%,特异度为91.6%,校准曲线拟合良好,提示对于STAS有较好的预测效能;DCA图显示模型具有临床实用性。结论 男性、抗GAGE7抗体阳性和平均CT值是亚厘米非小细胞肺癌STAS的独立预测因素,本研究构建的nomogram模型具有良好的预测价值,对患者的术前规划具有参考意义。
正 文
2024年国家癌症中心报告显示,肺癌仍高居我国肿瘤死亡病因首位[1]。近年来随着低剂量螺旋CT的不断推广和应用,以及人们健康体检意识的广泛提高,早期肺癌的检出率不断上升,其中亚厘米非小细胞肺癌的数量也在增多[2]。随着临床试验JCOG0804、JCOG0802、CALGB140503的结果相继发布,研究证明对于直径≤2 cm 的外周型早期非小细胞肺癌,亚肺叶切除有望成为新的标准手术方式[3-5]。亚厘米非小细胞肺癌总体预后较好,但仍有部分患者存在转移或复发的风险[6]。气腔播散(spread through air space,STAS)是一种独立的肺癌传播类型,指肿瘤细胞以微乳头簇、实体巢或单个细胞的形式通过空气扩散至主瘤边缘以外的肺泡腔内[7]。STAS不仅存在于腺癌中,在其他类型肺癌如鳞状细胞癌(鳞癌)、类癌、神经内分泌肿瘤中同样也有发现[8-9]。对于伴STAS的早期非小细胞肺癌是否适用于亚肺叶切除术是当前胸外科领域的研究热点。一项涉及10 883例Ⅰ期非小细胞肺癌患者的Meta分析[10]显示,对于STAS阳性患者,接受亚肺叶切除手术具有更高的5年复发风险[HR=3.44,95%CI(2.49,4.76)]与死亡风险[HR=3.40,95%CI(2.05,5.64)]。Ikeda等[11]通过对555例ⅠA期非小细胞肺癌患者的回顾性研究发现,楔形切除术是ⅠA期STAS患者不良无复发生存(recurrence-free survival,RFS)以及总生存(overall survival,OS)的独立危险因素。因此,术前、术中获知肿瘤是否伴有STAS对指导外科医师选择手术方式具有重大意义。
术中快速病理对STAS的诊断具有较高的特异性,但灵敏度较差[12-13]。因此近年来基于术前临床和影像学特征构建模型预测STAS的研究方兴未艾。研究[14-15]表明临床特征如男性、癌胚抗原(carcinoembryonic antigen,CEA)阳性、影像学特征如肿瘤实性成分占比(consolidation tumor ratio,CTR)、结节类型、分叶征、毛刺征等与STAS密切相关。Liao等[16]通过结合影像组学技术,开发了预测Ⅰ期肺腺癌STAS的预测模型,模型的灵敏度为82%,特异度为80%。Wang等[17]通过分析241例肺腺癌的临床影像特征,构建的nomogram的曲线下面积(area under the curve,AUC)在训练集和验证集分别为0.860和0.919。
上述部分研究中纳入的病例分期不局限于早期,预测中晚期肺癌是否伴随STAS的临床价值有限;而影像组学技术操作较复杂,不便于临床推广;仅纳入影像学特征的预测模型诊断效能中等;对肺癌自身抗体预测STAS价值的探讨也同样缺乏。此外,目前并没有研究对象为亚厘米非小细胞肺癌的STAS模型。亚厘米肺癌患者数量逐年增加,且病变大多属于早期,总体预后好;但仍有少部分病变恶性程度高,甚至出现STAS。本研究旨在探讨ⅠA期亚厘米非小细胞肺癌发生STAS的独立危险因素,并基于此构建nomogram术前预测模型,为患者术前手术方式选择提供参考。
1 资料与方法
1.1 临床资料和分组
回顾性分析2022年1月—2023年10月在南京大学医学院附属鼓楼医院胸外科接受手术治疗并且术后病理学诊断为非小细胞肺癌的4 667例患者的临床资料。病理分期以国际肺癌研究协会(International Association for the Study of Lung Cancer,IASLC)制定的第9版TNM分期为参照依据。纳入标准:(1)病理诊断为原发性肺癌;(2)术前1个月内在我院行胸部CT检查;(3)ⅠA期亚厘米非小细胞肺癌。排除标准:(1)微浸润性腺癌[根据2021年世界卫生组织(World Health Organization,WHO)胸部肿瘤分类[18]];(2)患者术前行新辅助化疗;(3)存在多发肺癌;(4)住院后缺乏肺癌自身抗体检测。根据病理诊断肿瘤是否伴随STAS,将患者分为STAS阳性组和STAS阴性组。
1.2 组织病理学评估
将手术切除的肿瘤标本置于10%中性福尔马林液中固定12~48 h后进行取材、石蜡包埋、制片、苏木精-伊红染色,光镜观察。由2名具有丰富临床经验的病理科医师依据WHO对STAS的定义,对患者术后肺切除标本进行评估,结果不一致的病例经讨论后达成共识。STAS定义为肿瘤细胞以微乳头簇、实体巢或单个细胞的形式通过空气扩散至主瘤边缘以外的肺泡腔内。免疫组织化学染色用于区分肺泡巨噬细胞与真正的STAS。
1.3 影像学特征分析
术前行胸部CT检查,使用两种CT机:荷兰飞利浦IQON-Spectral 128排CT机和荷兰飞利浦iCT 256排CT机。设置参数:管电压120 kV,管电流自动调节,采用1.0~2.0 mm的薄层重建图像,肺窗窗位−600 HU,窗宽1500 HU。
通过肺窗和纵隔窗进行CT成像分析。选择肺算法或标准算法重建,使用非对比度增强图像进行分析。2位具有2年以上胸部影像学诊断经验的住院医师各自独立分析肿瘤的影像学特征,包括病变位置、分叶征、毛刺征和平均CT值。于结节最大横切面处测量平均CT值,尽可能避免小肺血管、小支气管和钙化灶的干扰。结论不一致之处由2名副主任医师商讨解决。
1.4 肺癌自身抗体检测
术前空腹取静脉血(约4 mL)。用血凝管分离血清,3 500 r/min离心10 min。血清保存在−80°C的冰箱中。采用酶联免疫吸附法检测7种肿瘤相关自身抗体的血清浓度,检测抗p53、PGP9.5、SOX2、GAGE7、GBU4-5、MAGEA1和CAGE抗体。7种自身抗体的正常参考区间由试剂盒说明书获得并经实验室验证。
1.5 统计学分析
采用SPSS 29.0软件和R统计软件(R 4.2.3版)进行统计分析。采用Shapiro-Wilk检验对计量资料进行正态性检验。如果符合正态分布,则采用均数±标准差(x±s)描述,组间比较采用独立样本t检验,否则采用中位数(四分位数间距)描述,组间比较采用Mann-Whitney U检验。计数资料采用频数和百分比描述,组间比较采用χ2 检验或Fisher确切概率法。通过单因素和多因素logistic回归分析筛选预测STAS的临床和影像学特征。方差膨胀系数(variance inflation factor,VIF)用于评估自变量之间是否存在多重共线性。VIF<5表明自变量之间不存在多重共线性。采用“rms”包构建基于独立预测因素的nomogram模型,并通过绘制校准曲线、受试者工作特征(receiver operating characteristic,ROC)曲线和决策曲线分析(decision curve analysis,DCA)对模型进行评价。采用Bootstrap法重复采样1 000次进行内部验证,以减少模型的过拟合偏差。双侧P≤0.05为差异有统计学意义。
1.6 伦理审查
本研究已通过南京大学医学院附属鼓楼医院伦理委员会审查,审批号:2024-076-03。
2 结果
2.1 患者临床及影像学特征
本研究共纳入112例患者。STAS阳性组17例,其中男11例、女6例,平均年龄(59.0±10.3)岁;STAS阴性组95例,其中男30例、女65例,平均年龄(56.8±10.3)岁。两组患者的性别、抗GAGE7抗体、平均CT值、毛刺征差异具有统计学意义(P<0.05);具体的临床及影像学特征见表1。

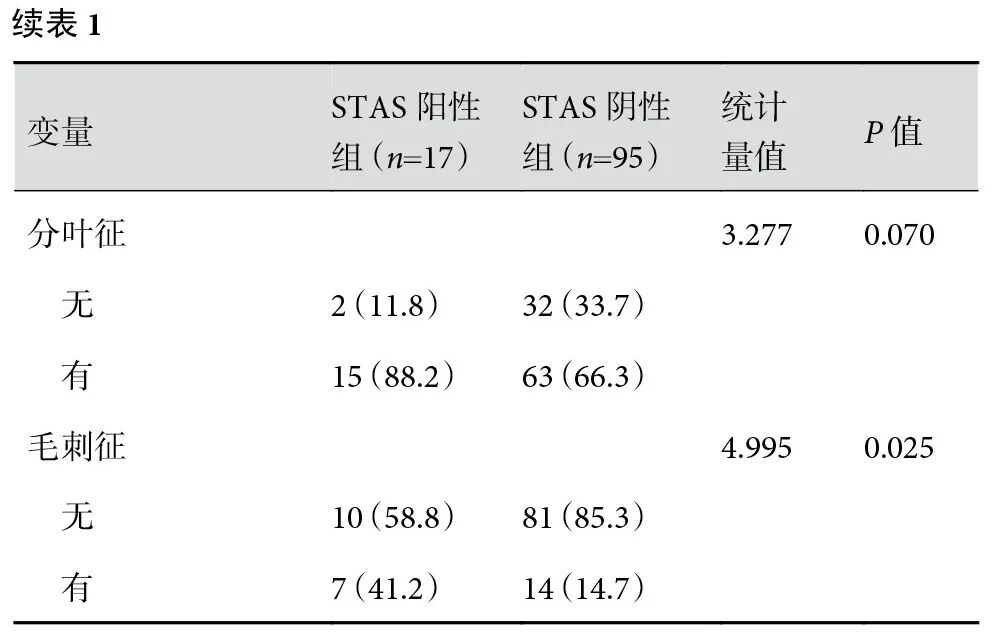
2.2 STAS预测因素筛选的单因素和多因素logistic回归分析
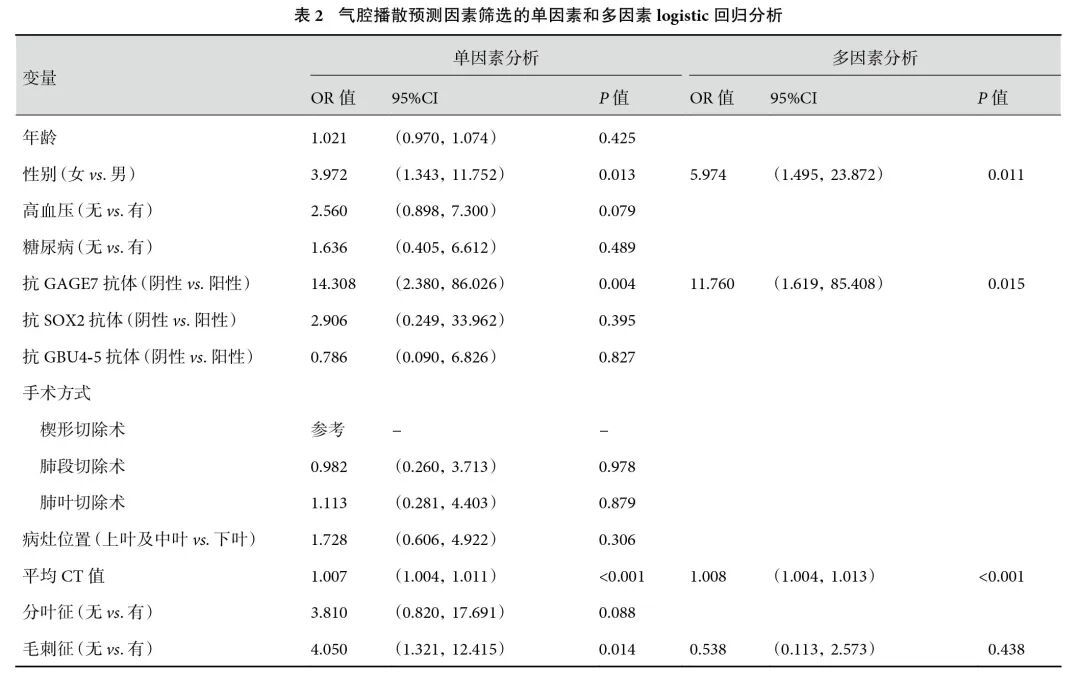
单因素logistic回归分析显示,男性[OR=3.972,95%CI(1.343,11.752),P=0.013]、抗GAGE7抗体阳性[OR=14.308,95%CI(2.380,86.026),P=0.004]、平均CT值[OR=1.007,95%CI(1.004,1.011),P<0.001)、毛刺征[OR=4.050,95%CI(1.321,12.415),P=0.014]与ⅠA期亚厘米非小细胞肺癌发生STAS显著相关;见表2。将上述特征进一步纳入多因素logistic回归分析,结果表明男性[OR=5.974,95%CI(1.495,23.872),P=0.011]、抗GAGE7抗体阳性[OR=11.760,95%CI(1.619,85.408),P=0.015]和平均CT值[OR=1.008,95%CI(1.004,1.013),P<0.001]是STAS阳性的独立预测因素。毛刺征与STAS的相关性不再具有显著性(表2)。对上述3个因素进行共线性分析,结果显示VIF值分别为1.004、1.036、1.032,均<5,表明上述3个因素之间不存在多重共线性。
2.3 Nomogram模型的构建和效能评估
基于多因素logistic回归分析筛选的独立预测因素(男性、抗GAGE7抗体阳性、平均CT值),回归方程为Logit(P)=−1.711+1.707×性别+2.370×抗GAGE7抗体+0.007×平均CT值,利用R语言构建预测STAS的nomogram模型(图1)。从图1中可见,每个变量有对应的得分,分值大小与变量的OR值相关,得分总和对应STAS阳性的风险率。校准曲线显示模型预测STAS阳性风险与实际STAS阳性风险具有良好的一致性(图2)。Hosmer-Lemeshow检验表明模型具有良好的区分能力(P=0.432)。进一步采用ROC曲线评估nomogram模型与各自变量对STAS预测区分度的差异。结果证明,nomogram模型的AUC为0.890(灵敏度为76.5%,特异度为91.6%),优于平均CT值的0.844(灵敏度为76.5%,特异度为80.0%)、男性的0.666(灵敏度为64.7%,特异度为68.4%)和抗GAGE7抗体阳性的0.607(灵敏度为23.5%,特异度为97.9%,图3)。DCA图显示模型预测STAS的阈值概率范围为0~75%和88%~95%时患者净获益良好,具有临床实用性(图4)。
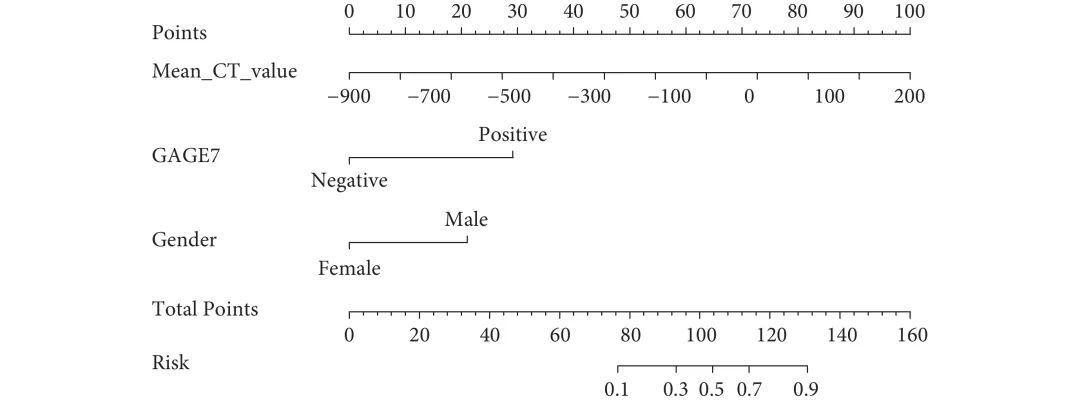
图 1 预测ⅠA期亚厘米非小细胞肺癌气腔播散的nomogram模型
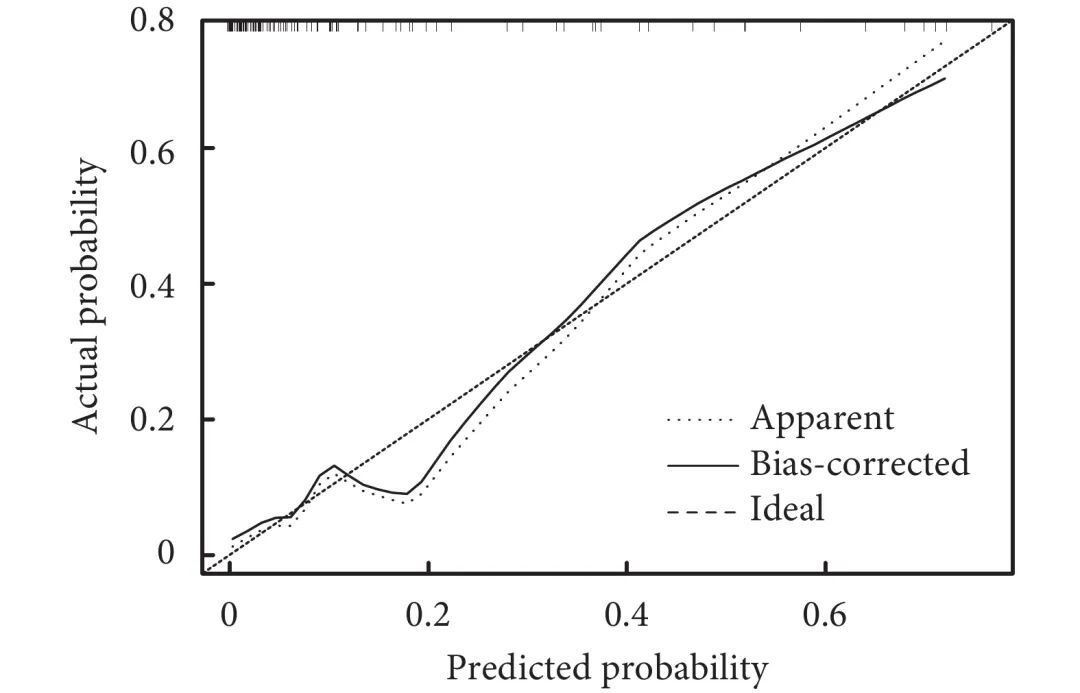
图 2 评估nomogram模型的校准曲线
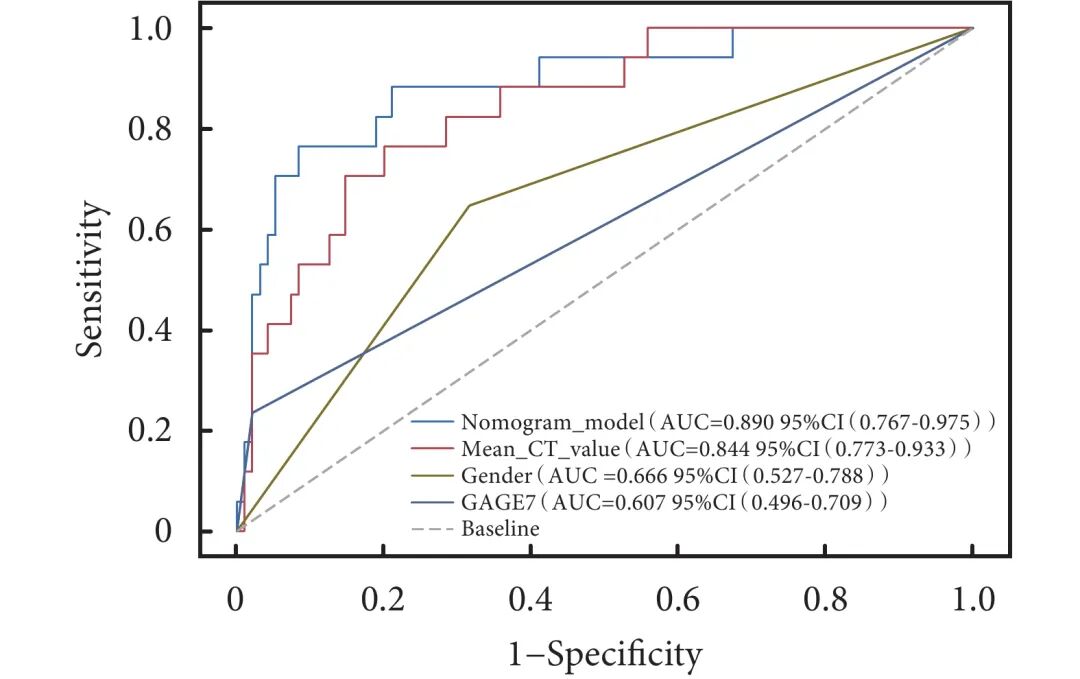
图 3 预测ⅠA期亚厘米非小细胞肺癌STAS 的ROC曲线
STAS:气腔播散;ROC:受试者工作特征;AUC:曲线下面积
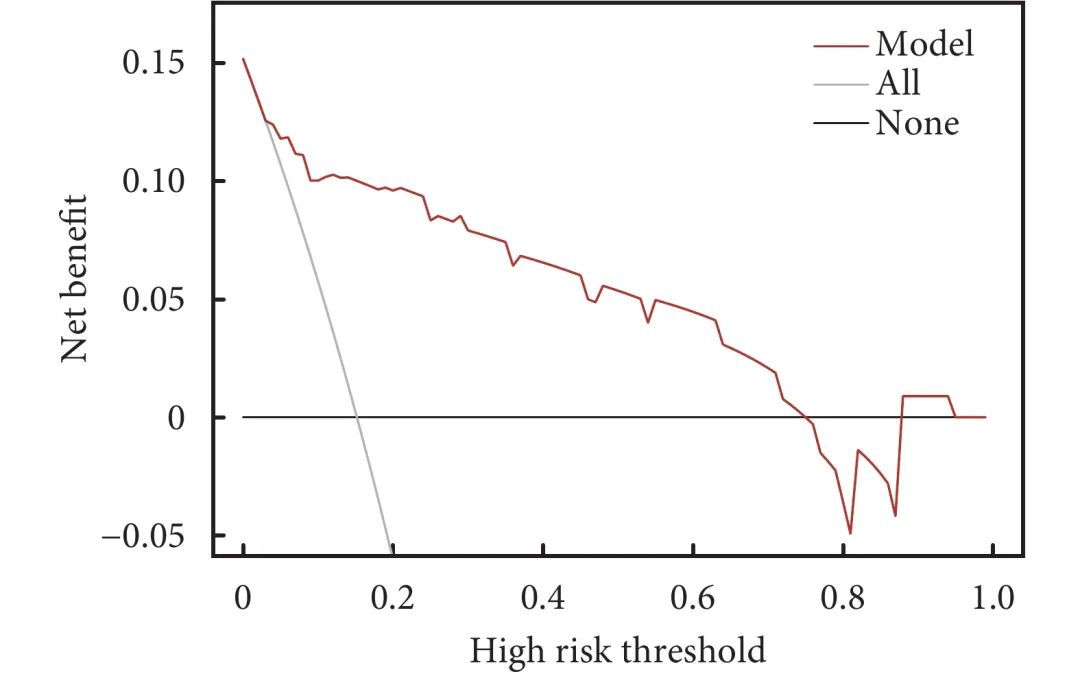
图 4 预测模型的决策曲线分析
3 讨论
手术切除是治疗早期肺癌最有效的手段,而亚肺叶切除术已经成为目前临床常见的处理早期肺癌的手术方式,并得到了广大胸外科医师及肺癌患者的认可。临床试验JCOG0804、JCOG0802以及CALGB140503也为此提供了良好的循证医学证据[3-5]。STAS是WHO于2015年正式提出的概念,被确认为肺癌的一种新型侵袭模式;STAS是影响早期非小细胞肺癌患者预后的独立危险因素[7,18]。多项研究[10-11]表明STAS对接受局限性切除的患者具有显著的预后不良影响,尤其是楔形切除术。因此,术前、术中预测早期肺癌患者是否伴随STAS具有重要意义,有助于综合评估制定手术方案。
有学者[12-13]提出通过术中快速病理检查来检测STAS,但此方法与常规病理切片相比,灵敏度差。也有研究提出通过术前活检判断STAS。Cao等[19]回顾性分析了111例肺腺癌患者的术前经皮经胸穿刺活检标本及术后切除标本,发现微乳头状/实性组织亚型、瘤内出芽、结缔组织增生与STAS独立相关。但是有创操作难以在早期肺癌患者中推广。Jia等[20]在CTR与STAS的相关性研究中发现,CTR通过广义加法模型与STAS线性相关,基于CTR的多变量回归模型显示OR值为1.24,P值为0.015。然而,该研究采用了倾向性评分匹配的方法,因为选择偏倚,影响了该模型的推广。Liao等[16]利用影像组学技术构建模型预测STAS,模型虽具有较高的预测效能,但影像组学技术操作流程复杂,故难以在临床上推广。Wang等[17]通过联合影像学特征与临床特征,构建预测STAS的nomogram模型,然而研究的入组病例分期并不局限于早期,预测中晚期肺癌是否伴随STAS的临床意义有限。
血清学对于STAS的预测意义,既往研究往往局限于对CEA的探讨,而忽视了肺癌自身抗体的潜在价值。此外,目前并没有研究对象为亚厘米非小细胞肺癌的STAS模型。亚厘米非小细胞肺癌患者数量逐年增加,腺癌患者病变多为原位腺癌以及微浸润性腺癌,手术治疗后总体预后好;但仍有少部分病变恶性程度高,在亚厘米尺寸的基础上发展成为浸润性腺癌,甚至出现STAS。本研究共纳入112例ⅠA期亚厘米非小细胞肺癌患者,单因素回归分析提示,临床特征包括男性、抗GAGE7抗体阳性以及影像学特征包括平均CT值、毛刺征与STAS相关。多因素回归分析显示男性、抗GAGE7抗体阳性、平均CT值为STAS的独立预测因素,毛刺征的相关性不再显著。
性别是评估肺癌是否存在STAS的重要参数,大量研究[11,14-15,21-22]表明STAS多见于男性患者。然而其中的原因目前仍不明确,可能与男性吸烟者比例高以及基因异质性有关。表皮生长因子受体(epidermal growth factor receptor,EGFR) 突变是早期非小细胞肺癌患者中最典型的突变类型,其总体患病率约为32.3%[23]。EGFR属于酪氨酸激酶受体家族,位于7号染色体的短臂上。研究[24-25]发现,EGFR突变存在明显的地域以及性别差异,其在亚洲、女性中发病率高,而在欧美以及男性患者中发病率偏低。同时,关于STAS的基因突变特征也有诸多报道,多项研究[26-27]显示STAS与EGFR野生型具有显著的相关性。因此,我们认为,EGFR的基因状态可能是STAS在性别分布上存在差异的原因之一。
抗GAGE7抗体是一种与肺癌相关的自身免疫抗体,在早期肺鳞癌的诊断中具有一定的价值,目前多用于早期肺癌的筛查,在STAS中的预测价值目前未见报道。本研究中,抗CAGE7抗体单独预测STAS的AUC为0.607(灵敏度为23.5%,特异度为97.9%),诊断价值较低。然而,其与性别、平均CT值联合诊断STAS,可以大大提高模型的预测性能,并且各变量之间VIF值均<5,提示并不存在共线性干扰问题。CEA属于一种广谱性肿瘤标志物,脏器特异性低。目前已有多项STAS临床研究[14,21]将CEA纳入模型变量中,显示出良好的预测效能。本研究提示肺癌自身抗体在预测肺癌STAS方面存在一定价值,为STAS的临床研究提供了新的方向,未来可以进一步探讨其在STAS患者预后中的研究价值。
平均CT值属于定量特征,肿瘤细胞侵袭正常肺组织导致肌成纤维细胞变性增厚,可导致平均CT值增加。研究[28]发现平均CT值与肿瘤侵袭性具有一定的相关性。STAS是一种新的肺癌浸润方式,属于肿瘤高侵袭性的表现,这可能是STAS阳性组患者的平均CT值显著高于STAS阴性组患者的原因。Yamamoto等[29]指出,平均CT值是预测STAS的独立危险因素,平均CT值>−251.8 HU的早期肺癌更有可能存在STAS,AUC值为0.738,灵敏度为80.5%,特异度为65.4%。而我们的研究表明,平均CT值>−90.6 HU时,诊断STAS的效能最大,AUC值为0.844,这可能是由两项研究纳入患者的标准不同所致。Yamamoto等[29]纳入的研究对象为临床分期N0期的肺腺癌患者,肿瘤的直径变化范围大,恶性程度普遍较亚厘米非小细胞肺癌高,这可能导致了平均CT值最佳截断值的不同。
基于上述3个临床影像学特征构建的nomogram模型,其对ⅠA期亚厘米非小细胞肺癌是否伴随STAS具有良好的区分度,优于单个变量特征的预测效能。这可能与我们的患者纳入排除标准、变量的选择以及患者的数量相关。目前亚厘米非小细胞肺癌患者的数量日渐增多,手术方式的选择可能会对存在STAS的患者预后产生影响,本研究设计的预测模型可以很好地满足临床需要。此外,nomogram模型具有可视化、易推广等优势,更加符合临床实践。
本研究存在一些局限性:首先,本研究为单中心回顾性研究,数据收集存在不可避免的偏倚;其次,本研究STAS阳性患者数量较少,研究结果可能受到影响。此外,不同的CT设备可能会影响图像的审阅,导致测量误差。未来需要前瞻性多中心试验来进一步验证。
总之,我们基于术前临床特征结合影像学特征构建了亚厘米非小细胞肺癌STAS的nomogram预测模型,并通过验证得出该模型具有较高的预测准确率。该模型解决了术前STAS状态难以诊断的困难,便于外科医师全面评估和制定合理的手术策略,具备临床实用价值。
利益冲突:无。
作者贡献:王萧负责设计、开展研究,撰写论文;张耀、朱康乐负责查阅文献,分析数据,英文部分润色;赵怡、史经伟负责收集、整理、核验数据;徐倩倩、刘政呈负责论文的审核和修改。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)