首页 > 医疗资讯/ 正文
浆细胞疾病
克隆性浆细胞疾病涵盖多种疾病谱,包括多发性骨髓瘤(MM)、意义未明的单克隆丙种球蛋白病(MGUS)、冒烟型多发性骨髓瘤(SMM)、华氏巨球蛋白血症(WM)以及免疫球蛋白轻链(AL)淀粉样变性。型在 MGUS、SMM 和 MM 中,疾病进展风险差异显著,受肿瘤负荷、细胞遗传学异常、骨髓微环境和宿主因素等多重因素共同影响。尽管华氏巨球蛋白血症通常呈惰性病程,但其分子异常谱系独特,临床结局差异显著。而在 AL 型淀粉样变性中,疾病进展轨迹主要由受累器官的性质及受累程度决定。
《Leukemia》近日发表综述,汇总了当前用于各类克隆性浆细胞疾病的风险分层体系,重点分析了主要风险分层模型的优势与局限,并对临床实践提出相应建议。

多发性骨髓瘤
多发性骨髓瘤(MM)约占所有新诊断血液恶性肿瘤的 10%,美国每年新发病例超过 36000 例,相关死亡逾 12000 例。过去二十年间,治疗格局显著扩展,患者结局大幅改善。5 年总生存(OS)率从 1990 年代的 32% 提升至过去十年的 60% 以上,无高危因素的患者中超半数可达到 OS 超过 10 年。四药诱导方案及复发阶段免疫效应治疗的应用有望进一步改善预后。然而,高危患者的预后仍不理想,即使接受新型和免疫治疗,OS 仅为 3–5 年。因此,精准识别高危患者并实施个体化治疗策略至关重要。
多年来,针对活动性 MM 患者已开发出多种预后模型和风险分层系统。1975 年引入的 Durie-Salmon 分期系统主要基于疾病负荷对患者进行分类,是一个真正的分期系统。2005 年,国际分期系统(ISS)通过结合血清白蛋白和 β₂-微球蛋白水平,将患者分为三个风险类别,提供了一个预后风险分层系统。尽管这些系统在治疗反应有限的时代有效,但它们在捕捉疾病的潜在生物学异质性方面存在局限性。通过间期荧光原位杂交(FISH)发现高危细胞遗传学异常(HRCAs)——特别是 del(17p)、t(4;14) 和 t(14;16)——促使风险分层向基于细胞遗传学的方向转变。2014 年,国际骨髓瘤工作组(IMWG)将高危 MM 定义为国际分期系统(ISS)II/III 期疾病,并伴有 del(17p) 或 t(4;14),识别出一个中位 OS 为两年的患者群体。修订版国际分期系统(R-ISS)结合细胞遗传学数据、乳酸脱氢酶(LDH)升高和 ISS 分期来定义高危疾病,该疾病占患者的 23%,中位 OS 为 3.6 年。第二次修订版(R2-ISS)进一步细化了细胞遗传学特征的预后权重,纳入 1q21 获得/扩增(1q21+),并排除 t(14;16),识别出一个中位 OS 为 3.3 年的高危患者群体。此外,梅奥加性分期系统(MASS)是一个简化的模型,包括 LDH 升高和 HRCAs,识别出 31% 的患者为高危,中位 OS 为 4.3 年。附表 1 提供了活动性 MM 常用风险分层方案。
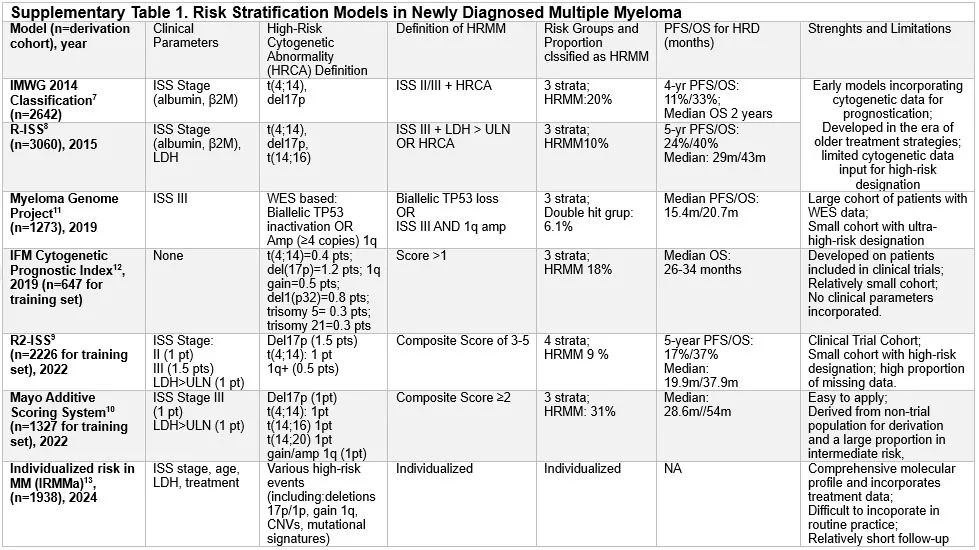
此外,对其他基因组异常的预后影响的理解也在不断发展。双等位 del(1p32)(可能由于 CDKN2C 缺失)和 TP53 突变/失活的存在预示着明显较差的预后。同样,对于已确定的不良预后标记(如 1q21+)的患者,其结果存在异质性,部分原因是与大规模基因组事件(如染色体碎裂/模板插入)相关,存在额外的高危细胞遗传学异常以及 1q 的额外拷贝数量。在携带 t(4;14) 的患者中,NSD2 的断裂点位置可以决定预后,而“晚期破坏”(在 NSD2 基因内)的存在与更差的结果相关。
MAF 易位,t(14;16) 和 t(14;20),存在于 1–3% 的新诊断 MM 患者中,并在 APOBEC 突变特征中富集。MAF/MAFB 易位常与 1q21+ 和 del(17p) 相关联,很可能是 MAF/MAFB 易位与继发性 HRCAs 的共同存在推动了不良预后。在前面讨论的风险分层模型中纳入的大多数患者接受的治疗在当代疗效不佳。纳入大量变量(特别是 1q 获得)导致超过 50% 的 MM 进入高危类别,因此限制了风险分层的临床意义。
对此,国际骨髓瘤学会(IMS)和 IMWG 在 2024 年引入了一个新的风险分层框架(表 1)。

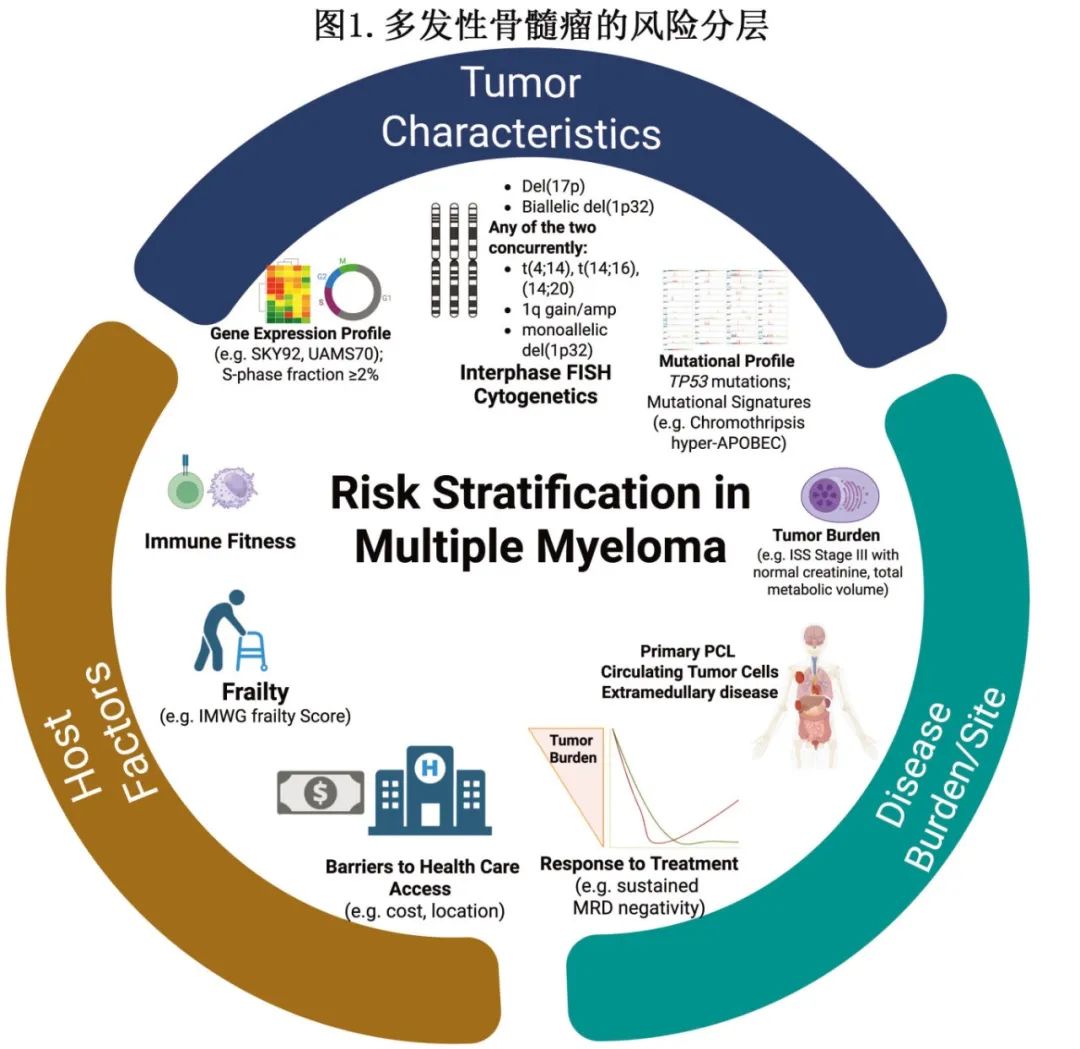
该分类将高危 MM 定义为单独存在 del(17p) 和/或 TP53 突变以及双等位 del(1p32)。在血清肌酐正常(<1.2 mg/dL)的情况下,β₂ -微球蛋白升高(>5.5 mg/L)与较差的生存率相关,并在新的 IMS/IMWG 分类中作为一个独立的高危特征。此外,携带两种或更多中危异常(1q21+(获得或扩增)、t(4;14)、t(14;16)、单等位 del(1p32))的患者也归类为高危。采用这一新方案,大约 20% 的患者定义为高危。建议在新诊断的多发性骨髓瘤中采用新的 IMS/IMWG 定义,以实现一致且稳健的风险分层。采用统一的风险分层方案将有助于协调开展针对高危 MM 的临床试验的努力。随着进入风险适应治疗的时代,预计通过纳入肿瘤特异性因素(如循环肿瘤细胞和髓外疾病的存在、高危基因表达谱)、宿主特异性因素(如虚弱程度和免疫健康度)以及反应参数(如可测量残留病)来进一步完善这些方案(图 1)。
意义未明的单克隆丙种球蛋白病
MM都是由一种称为MGUS的癌前病变发展而来。MGUS 的定义是循环单克隆(M)蛋白 <3 g/dL、骨髓浆细胞(BMPCs)克隆 <10%,且无由浆细胞疾病引起的终末器官损伤的证据。尽管 MGUS 在普通人群中相对常见,影响 50 岁以上成年人的 3–6%,但只有少数 MGUS 患者会出现临床后果。MGUS 进展为需要治疗的 MM 或相关恶性肿瘤的年风险约为 1%。然而,MGUS 患者的进展风险存在显著异质性。在梅奥诊所对 1384 例 MGUS 患者的研究中,存在以下三个危险因素中的三个——血清游离轻链(sFLC)比值异常、M 蛋白浓度 ≥1.5 g/dL 或非 IgG 型——与 20 年内进展为 MM 的 58% 风险相关。相比之下,没有这些危险特征的患者在同一时期内进展的风险仅为 5%。该风险分层模型随后被IMWG采纳,建议用于 MGUS 患者的初始诊断评估(表 2)。
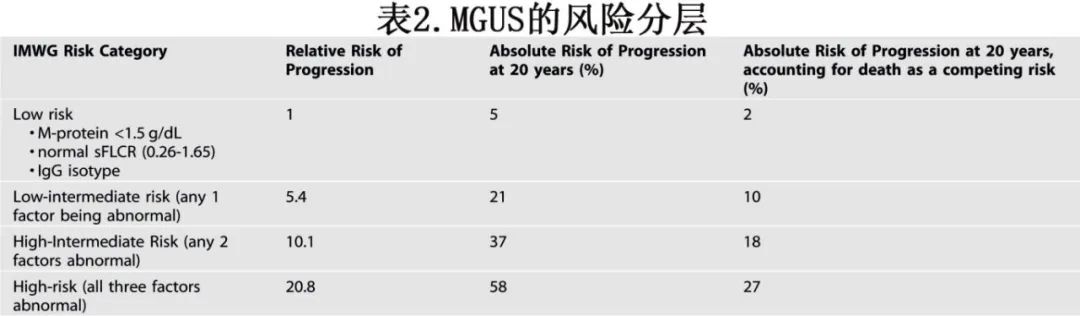
值得注意的是,IMWG 模型在随访中的纵向应用仍可显示出强大的预后价值。存在免疫麻痹(以≥2 种未受累免疫球蛋白的抑制为特征)和骨髓中克隆浆细胞比例高是与 MGUS 早期进展相关的其他重要危险因素。
MGUS 的风险分层在指导基线评估和监测策略方面发挥着关键作用。例如,在低危 MGUS 中,基线时识别出 ≥10% BMPCs 或骨骼病变的概率通常<5%,因此可能不需要进行广泛的诊断检查。同样,在最初 6–12 个月内证明临床稳定后,低危 MGUS 的随访可以降低频率。iStopMM 研究通过在原有三个变量的基础上纳入血清免疫球蛋白水平,进一步完善了 IMWG 模型的预测能力,以更好地预测 BMPC 浸润。
冒烟型骨髓瘤
SMM 定义为存在≥3 g/dL的血清单克隆蛋白和/或至少10%的克隆BMPC,无骨髓瘤定义事件。与MGUS不同,SMM 进展为活动性 MM 的风险显著更高,在诊断后的前 5 年内每年进展风险约为 10%。直到最近,由于未对 MGUS 患者进行常规骨髓穿刺,SMM 的确切患病率尚不清楚。瑞典癌症登记处此前估计的每 10 万人中有 0.44 例 SMM 患者可能低估了其患病率,因为这一数字低于估计的 MM 发病率。iStopMM 研究对 75422 名个体(冰岛 40 岁以上个体的 51%)进行了筛查,发现符合条件的筛查人群中 SMM 的发病率为 0.53%。
在 SMM 中,识别那些有高进展风险、可以从早期干预和参与临床试验中受益的患者至关重要。多种风险分层模型已被用于确定 SMM 的进展风险。西班牙模型通过流式细胞术检测 ≥95% 的异常浆细胞表型和未受累免疫球蛋白的减少(每项计 1 分),识别出一个高危 SMM 患者群体(总分 2 分),其中位至进展时间(TTP)为 23 个月。
随后,梅奥诊所的 20/2/20 风险分层模型对 421 名 SMM 患者进行了风险分层,将其分为三个风险组,分层标准包括骨髓浆细胞比例(>20%)、血清 M 蛋白水平(>2 g/dL)和血清游离轻链(sFLC)比值(>20),如表 3 所示。根据 20/2/20 标准定义的高危 SMM 患者的中位 TTP 为 29 个月。该模型在一个大型国际队列中得到了验证,该队列报告称,根据梅奥 20/2/20 标准,有 ≥2 个风险因素的患者在 2 年内的进展风险为 44%。从生物学角度来看,大多数低危和中危 SMM 患者以及几乎所有的高 SMM 患者的恶性肿瘤特征与 MM的特征相同。
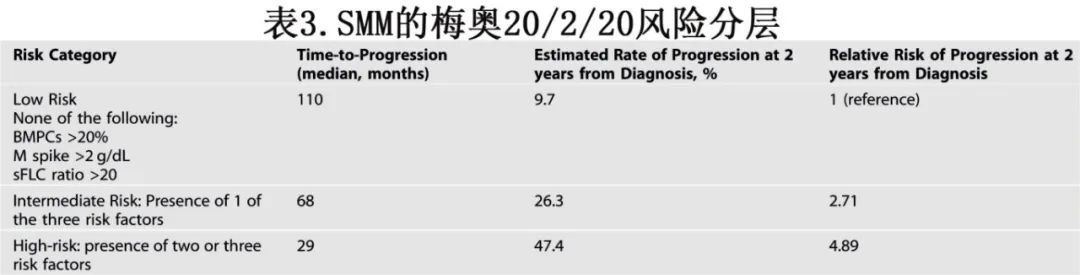
如果可以获得细胞遗传学结果,则梅奥 20/2/20 风险分层模型可以进一步完善。IMWG评估了FISH数据的影响,发现 t(4;14)、t(14;16)、+1q 和 del(13q) 与较短的 TTP 相关。将这些 FISH 数据纳入梅奥模型后,有≥3个风险因素的患者群体在 2 年内的进展风险为 63%。在后续随访的各个时间点应用 20/2/20 模型也显示出临床实用性。同样,随访评估期间血清单克隆蛋白的变化模式也可能进一步增强 SMM 的风险分层。随着越来越接近探索高危 SMM 的治疗策略,拥有一个稳健的SMM风险分层工具至关重要。鉴于其简单性和可重复性,推荐 20/2/20 风险分层方案作为评估 SMM 进展风险的可靠框架。
华氏巨球蛋白血症
WM是一种分泌IgM的淋巴浆细胞淋巴瘤(LPL),起源于活化的B细胞。在美国,每年大约有1500人被诊断出患有WM,年龄调整后的发病率为每10万人年0.42例。大约20%的患者在发展为活动性或症状性疾病之前,有冒烟型WM(SWM)的既往诊断。SWM的定义为骨髓中LPL的浸润≥10%和/或M蛋白水平≥3 g/dL,且不存在需要治疗的WM相关症状;这些症状包括血红蛋白≤10 g/dL、血小板计数≤100×10⁹/L、显著疲劳、B症状、症状性器官肿大、高黏滞度、冷球蛋白血症、组织学转化、ALH淀粉样变性、肾功能不全以及由WM引起的具有临床意义的感觉运动性周围神经病变。
多年来,WM已开发出多种风险因素和风险分层系统。在一个包含489例无症状WM和IgM MGUS患者的队列中,以下被确定为进展的独立风险因素:血清IgM≥4500 mg/dL、骨髓LPL浸润≥70%、血清β₂ - 微球蛋白≥4 mg/dL以及血清白蛋白<3.5 g/dL。这些变量被纳入比例风险模型中作为连续因素,并分为四分位数。高危组(高于第三四分位数)的中位TTP为1.8年,中危组(四分位间距)为4.8年,低危组(低于第一四分位数)为9.3年。值得注意的是,由于当时数据不足,该模型未纳入MYD88L265P和CXCR4突变状态。MYD88WT基因型与显著更短的TTP至活动性WM相关(中位TTP为1.8年;风险比:2.7)。同样,与CXCR4WT相比,携带CXCR4突变的患者TTP更短(中位数51个月 vs 未达到)。重要的是,SWM患者的OS与普通人群相当,即使是高危SWM患者,也应在满足治疗标准时才开始治疗。
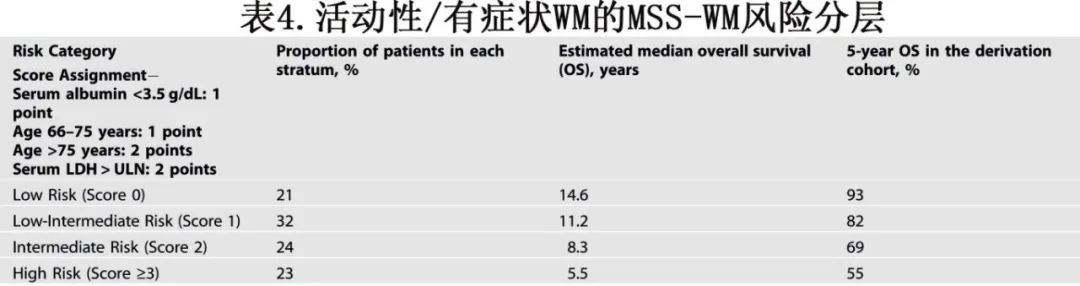
活动性WM患者的中位OS接近十年,但存在异质性。WM的国际预后评分系统(IPSS-WM)基于五个因素(年龄、血小板计数、血红蛋白水平、β₂-微球蛋白和IgM水平)将患者分为三个风险类别。高危组的5年OS为36%。然而,IPSS-WM是在2001年之前接受治疗的患者队列中开发的,并未探究随后在WM中发现的MYD88L265P突变的预后影响。最近,提出了WM的改良分期系统(MSSWM),基于年龄、血清LDH和血清白蛋白将患者分为四个风险组。在推导队列中,最高危组的5年OS为55%,最低危组为93%(表4)。这些发现在外部验证队列中得到了复制,最高风险组的5年OS为57%,最低风险组为93%。即使考虑非WM相关死亡作为竞争风险,MSSWM仍保持预后意义,并且表现优于IPSS-WM。在MSSWM的推导或验证队列中,未发现MYD88L265P具有预后价值。将β₂-微球蛋白升高(≥4 mg/dL)纳入高危MSS-WM中,可能会识别出一个超高危队列,其平均OS为2.5年。鉴于其简单性、外部验证以及在现代治疗格局中的相关性,建议在活动性WM中使用MSS-WM进行风险分层。应注意的是,MSS-WM队列中的大多数患者接受过一线免疫化疗(目前的标准治疗)。未来的努力应旨在在一线接受BTK抑制剂治疗的队列中验证MSS-WM,并评估CXCR4突变状态的预后效用。
AL型淀粉样变性
AL型淀粉样变性是一种由克隆性浆细胞疾病引起的免疫球蛋白轻链(或罕见的重链)过度产生,这些异常蛋白在多种器官中以错误折叠的形式沉积,导致器官损伤。在梅奥诊所对1900年至2015年居住在奥姆斯特德县的个体进行的一项研究中,AL型淀粉样变性的发病率为每10万人年1.2例,美国每年估计新诊断病例为2200至3500例。全球范围内,发病率估计为每百万人年3至12例。
AL型淀粉样变性的预后主要受累及器官的程度影响,心脏受累与较差的预后密切相关。多年来,已开发出多种分期系统以帮助分层风险(表5)。
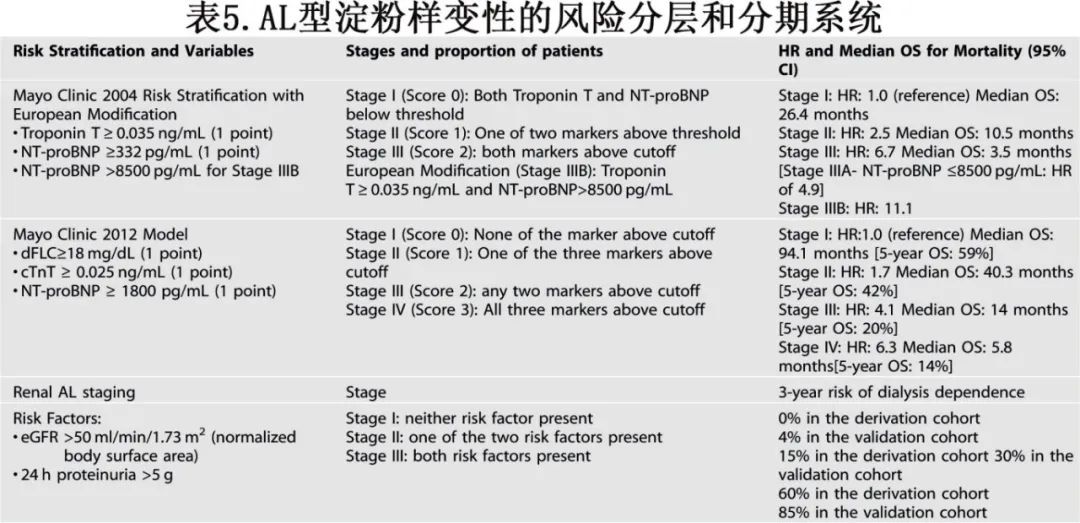
梅奥诊所2004年分期系统基于肌钙蛋白T(>0.035 ng/mL)和NT-proBNP(>332 pg/mL),将患者分为三个风险组,高危组患者的中位OS为3.5至4个月。2013年,欧洲对梅奥2004系统进行了修改,识别出一个超高危队列(IIIB期),定义为肌钙蛋白T > 0.035 ng/mL且NT-proBNP > 8500 pg/mL或收缩压 < 100 mmHg。该组患者的中位OS为3个月,与心脏生物标志物正常的I期患者相比,死亡风险比(HR)为11.1。梅奥诊所2012年分期系统将游离轻链差值作为额外的预后标志物纳入,与既定的心脏生物标志物一起。该模型将患者分为四个风险组,分布更加平衡。IV期患者的中位OS为5.8个月,与I期相比,死亡风险比为6.3。相比之下,梅奥2012系统对长期生存的预测更好,而梅奥2004系统(欧洲改良版)在识别早期死亡风险患者方面更准确。因此,建议在基线风险评估中同时使用梅奥2012模型和改良后的梅奥2004模型。随着高敏感度肌钙蛋白T的出现,已提出了并验证了改良后的临界值。
波士顿大学的研究人员还提出了一个基于BNP和心脏肌钙蛋白I的风险分层模型,与梅奥诊所2004模型高度一致。在肾AL淀粉样变性患者中,一个重要的临床相关终点是透析依赖的风险。Palladini等人证明,估算肾小球滤过率(eGFR)<50 ml/min/1.73m²和24小时蛋白尿>5 g/dL可靠地预测透析依赖的风险,当这两个风险因素同时存在时,3年率在60%至85%之间。随着AL淀粉样变性治疗选择的进步和达雷妥尤单抗在一线治疗中的纳入,早期死亡率开始下降,这些预后标志物的当代意义仍有待研究。
总结
浆细胞疾病的分层风险评估本质上较为复杂,需要综合考虑克隆相关特征、肿瘤负荷和宿主特异性因素。随着进入一个越来越个性化的治疗时代,准确识别死亡风险最高的患者变得至关重要:这不仅是为了量身定制治疗干预措施,也是为了优先开发旨在改善预后的新治疗策略。相反,预计长期生存率极佳的个体可能从降低治疗强度的方法中受益。对于这些患者,探索降级策略有望在不降低疗效的情况下最小化毒性并保持生活质量。这些进展的核心是准确和个性化的风险评估,这是真正个体化护理的基础。本综述总结了当前最先进的风险分层系统,建议在治疗克隆性浆细胞疾病谱患者时用于临床实践。
参考文献
Zanwar, S., Rajkumar, S.V. Current risk stratification and staging of multiple myeloma and related clonal plasma cell disorders. Leukemia (2025). https://doi.org/10.1038/s41375-025-02654-y
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)