首页 > 医疗资讯/ 正文
抗原呈递是疫苗引发免疫反应的核心过程,涉及抗原的摄取、处理以及向T细胞的呈递。这一过程的效率直接影响疫苗的效果,决定免疫系统如何响应病毒或肿瘤。传统疫苗策略依赖抗原呈递细胞(Antigen-presenting cells,APCs)来完成这一过程,但这一过程常常受到一些因素的影响,比如APCs的激活状态、免疫环境、抗原的特性、载体的稳定性、免疫耐受性,以及APCs在体内的分布和迁移情况。如何提高抗原呈递的效率,增强疫苗的免疫效果,是疫苗研发中的一个重要挑战。
近期,浙江大学唐睿康教授团队在《Small》杂志在线发表了题为“Nanoadjuvant-Mediated EV-Derived Artificial APC to Trigger Protective Immunity Against Virus Infection”的工作。该研究提出了一种新策略,利用细胞外囊泡(Extracellular vesicles,EVs)绕过体内APCs抗原处理步骤,直接激活T细胞,从而提升抗原呈递效率。EVs可以将抗原信息传递给目标细胞,帮助调节免疫反应。然而,它们的免疫效果往往取决于源细胞的激活状态。为了增强EVs的免疫效果,该研究设计了一种基于纳米壳聚糖(nChi)的多功能抗原递送体系,用于激活APCs并促进EVs的产生(图1)。该方法不仅能提高EVs的免疫作用,还能避免基因工程带来的复杂步骤和高成本。
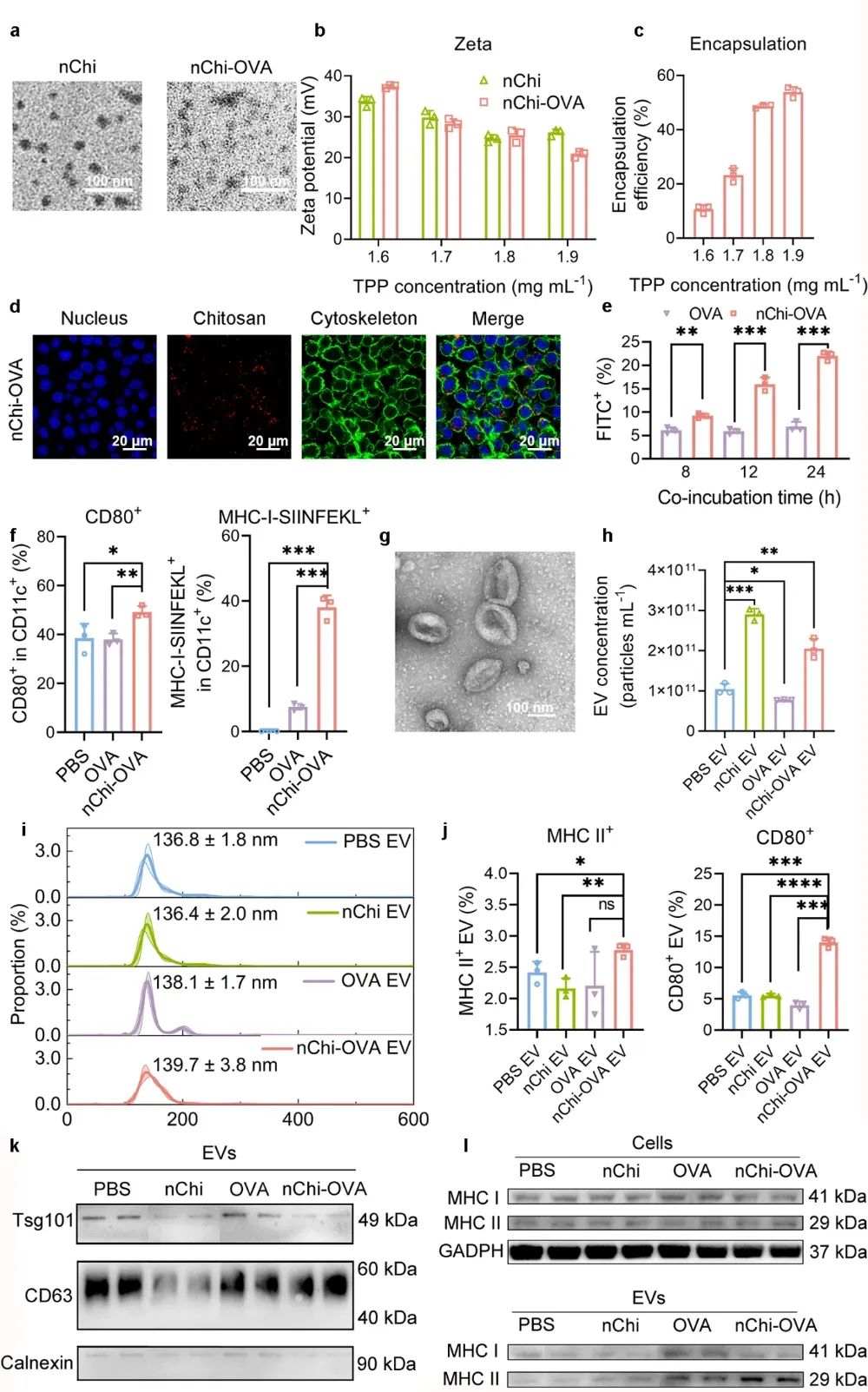
图1 nChi-OVA的物化性质及细胞摄取表征
在交联剂三聚磷酸钠(Sodium tripolyphosphate, TPP)作用下,模型抗原卵清蛋白(Ovalbumin,OVA)通过静电作用负载于nChi上,形成的壳聚糖-抗原复合纳米颗粒(nChi-OVA)具有良好的纳米特性,通过电荷驱动的细胞黏附作用,显著增强APCs对抗原的摄取。作为一种优良的佐剂,nChi还能激活APCs,增强EVs来源细胞主要组织相容性复合体(Major histocompatibility complex, MHC)和共刺激分子CD80的表达,从而提升EVs的免疫效果。
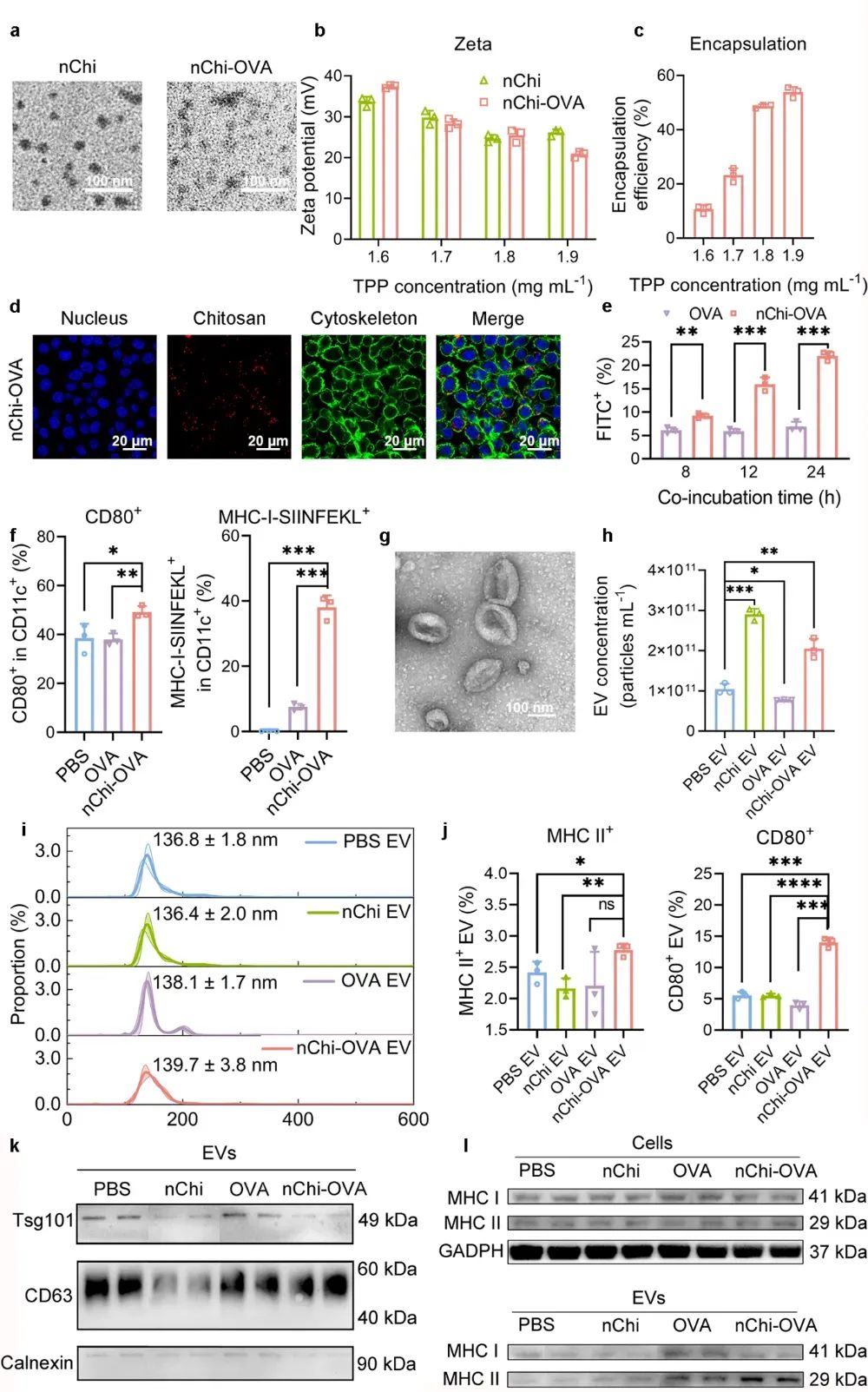
图2 nChi-OVA EV的鉴定及免疫标志物分析
APCs经nChi-OVA处理后,研究者使用多步离心和超滤分离获得EVs,称为nChi-OVA EV。经过蛋白质印迹法(Western blot, WB)、纳米颗粒跟踪分析(Nanoparticle tracking analysis, NTA)和透射电镜(Transmission electron microscopy, TEM)等方法的鉴定,研究者进一步通过WB和单EV流式细胞术检测EVs表面免疫相关蛋白的丰度,包括T细胞激活的第一信号分子MHC和第二信号分子共刺激因子CD80/CD86(图2)。结果表明,经nChi-OVA处理后,EVs表面的MHC分子和共刺激因子丰度显著增加,具有良好的激活T细胞的潜力。
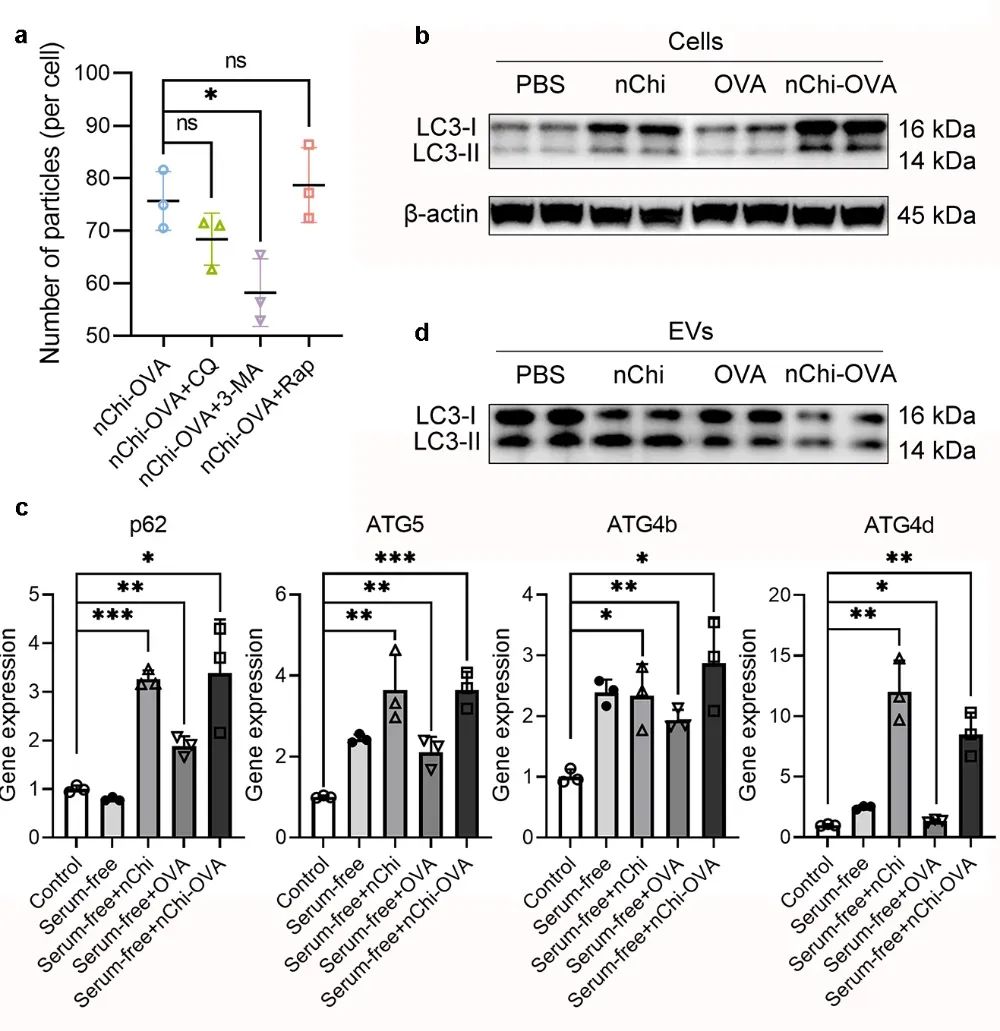
图3 nChi-OVA增强细胞自噬,从而促进EVs分泌
研究者对nChi-OVA对细胞的调控机制进行了初步探究,通过逆转录聚合酶链式反应(Reverse transcription polymerase chain reaction, RT-PCR)分析发现,nChi-OVA处理后,细胞中自噬相关基因(如p62、ATG5、ATG4b和ATG4d)的表达水平显著上调(图3)。研究者进一步使用自噬调节剂雷帕霉素(Rapamycin)、3-MA(3-Methyladenine)和氯喹(Chloroquine)干扰nChi-OVA对细胞的调控。结果表明,促进自噬能提高EVs的产量,而抑制自噬则会减少其分泌量。这说明,nChi-OVA可能通过调节自噬途径促进EVs的合成,从而增加EVs的分泌。
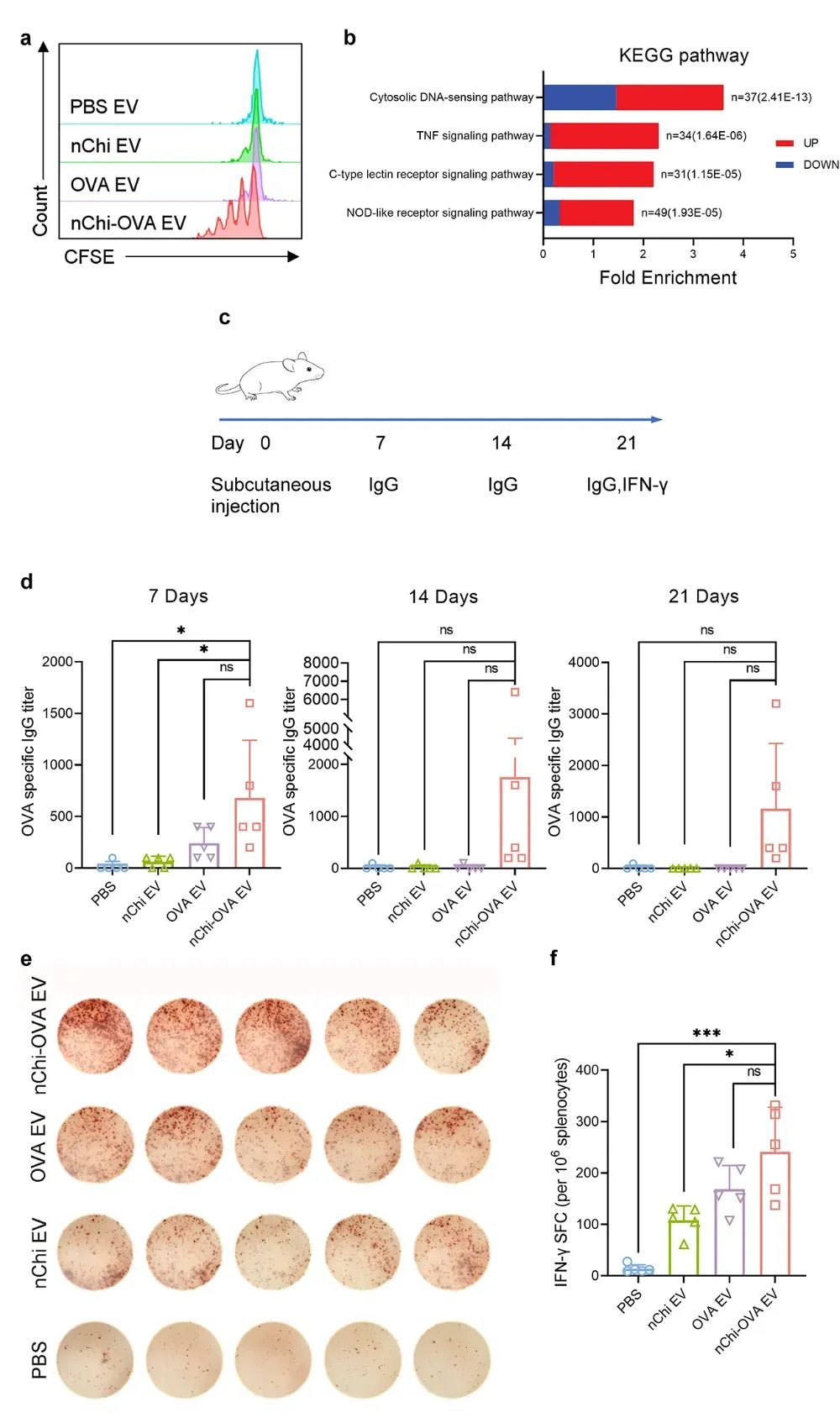
图4 nChi-OVA EV携带免疫相关信号,促进抗原特异性T细胞增殖
研究者在体外评估了nChi-OVA EV对T细胞活化的影响。为此,研究者使用OT-1小鼠模型,该小鼠携带特异性识别OVA257-264的转基因T细胞受体,广泛用于研究抗原特异性免疫反应。在实验中,分离自OT-1小鼠的CD3+ T细胞与nChi-OVA EV共培养三天。流式细胞术结果表明,nChi-OVA EV有效促进了抗原特异性T细胞的增殖,增殖率达到36.3%,明显高于对照组(图4)。这说明,nChi-OVA EV能够无需依赖其他APCs,直接激活T细胞,促进抗原特异性T细胞增殖。它不仅携带抗原信息,还能作为人工纳米抗原呈递细胞(nano-APCs),直接呈递抗原并有效激发特异性免疫反应。为评估该策略在跨物种中的应用潜力,研究者利用经nChi-OVA处理的人类巨噬细胞制备了EVs,并测试其激活T细胞的能力。与Jurkat细胞共培养后,流式细胞术显示nChi-OVA EV显著增加了CD69阳性细胞的比例,表明其能够有效激活T细胞。该结果与小鼠细胞来源EVs一致,进一步验证了该疫苗平台在不同物种中的应用潜力。此外,对EVs的蛋白质组学分析揭示,与PBS EV组相比,nChi-OVA EV中显著差异表达蛋白涉及多个免疫相关的信号通路,包括细胞质DNA感应通路、肿瘤坏死因子信号通路、C型凝集素受体通路和NOD样受体信号通路,这些结果进一步支持了nChi-OVA EV的免疫激活潜力。
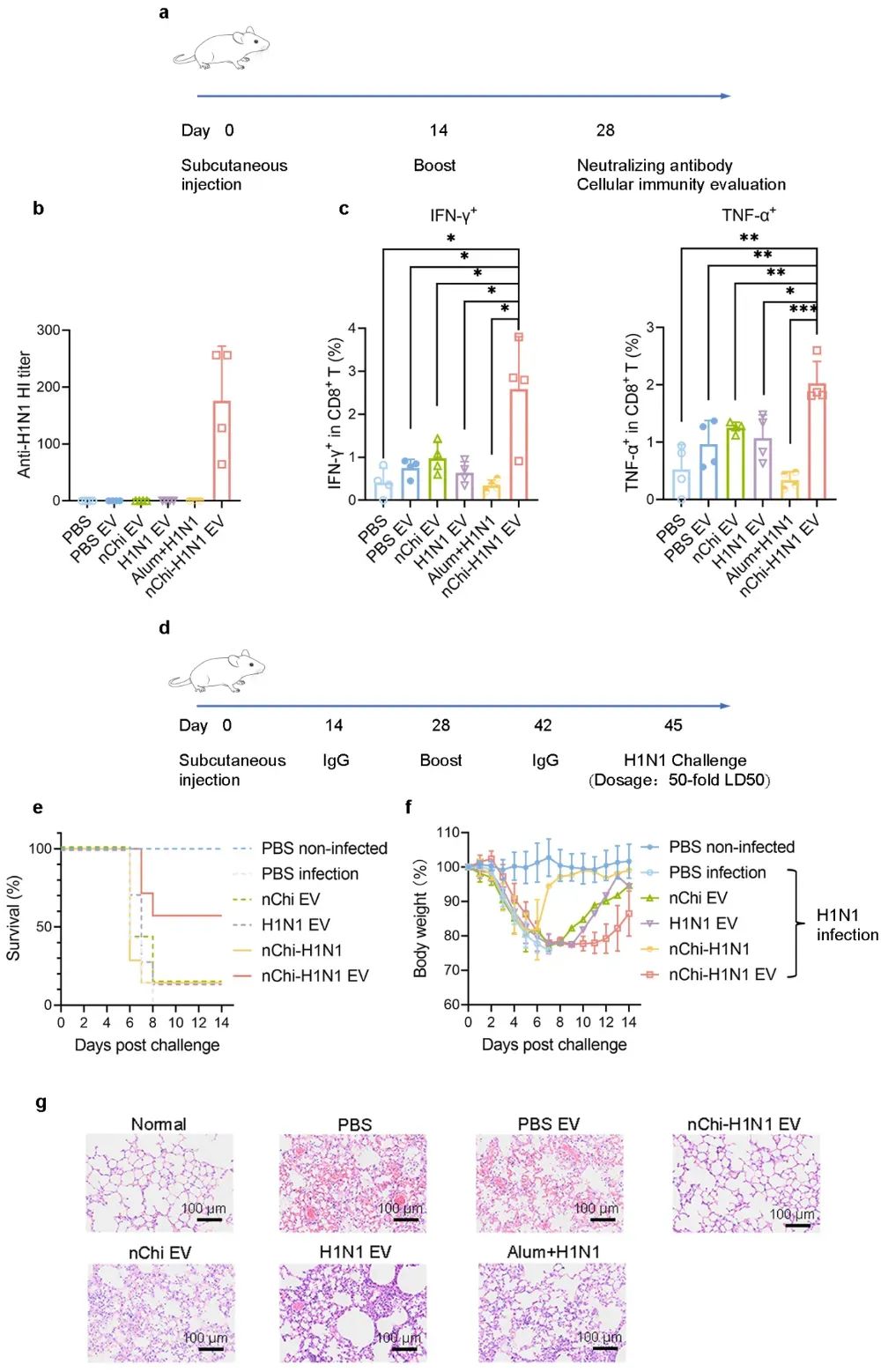
图5 nChi-H1N1 EV在流感模型中诱导的体液免疫与细胞免疫反应
为进一步验证该EV疫苗策略的通用性与实用性,并评估其对特定病毒的防护效果,研究者用类似的合成方法制备了用于防护流感病毒的nChi-H1N1 EV疫苗。流感病毒具有高度变异性,每个流行季节出现不同的变异毒株。因此,需研发能够快速制备并针对特定毒株的疫苗,以有效应对这些变异。在流感小鼠模型中,研究者评估了nChi-H1N1 EV疫苗对体液免疫和细胞免疫的激活效果。血凝抑制实验表明,与对照组相比,nChi-H1N1 EV显著提高了血清中的特异性中和抗体水平;而通过胞内细胞因子染色及流式细胞术分析,研究发现nChi-H1N1 EV显著促进了CD8+ T细胞分泌IFN-γ和TNF-α,诱导了更强的细胞毒性免疫反应(图5)。与传统的铝佐剂+H1N1组相比,nChi-H1N1 EV具有更高的抗原呈递效率,进而诱导了更强大的体液免疫和细胞免疫反应。
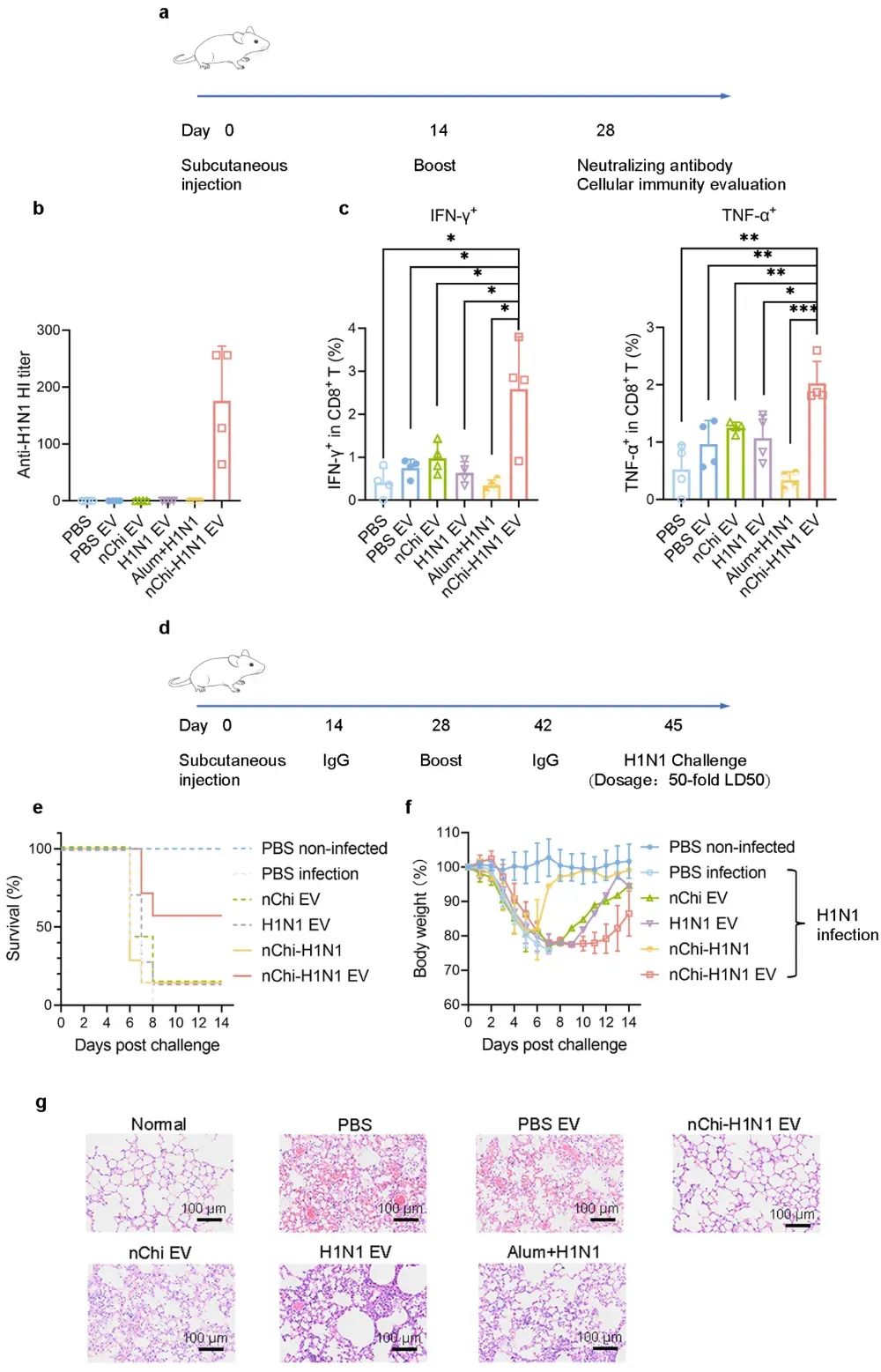
图6 nChi-H1N1 EV在流感模型中的保护效果
nChi-H1N1 EV能够直接激活T细胞,迅速诱导强烈的细胞免疫反应,利用细胞毒性T细胞在病毒入侵初期识别并杀伤被感染细胞,抑制病毒的进一步扩增,展现出应对高病毒载量的潜力。在病毒挑战实验中,研究者采用50倍LD50的攻毒剂量,nChi-H1N1 EV组小鼠的生存率为57.1%,显著高于其他对照组(图6)。组织学分析进一步证实,nChi-H1N1 EV有效缓解了肺部炎症,表现出明显的抗病毒保护作用。结果表明,nChi-H1N1 EV作为新型疫苗策略,能够有效诱导特异性免疫反应,并具有较强的抗病毒保护能力。
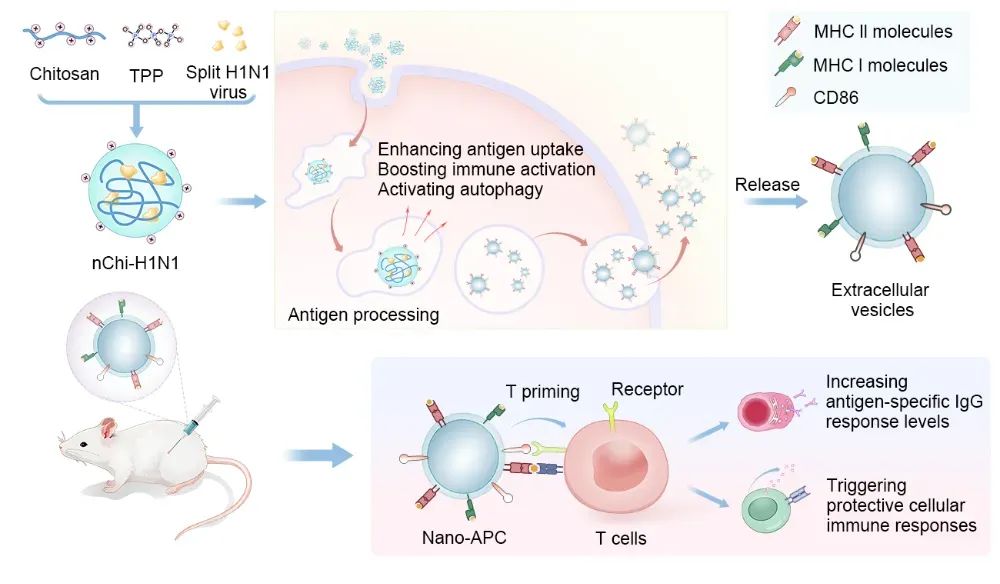
图7 具备抗原呈递功能的囊泡(nano-APC)的制备与应用示意图
【结论与展望】
综上所述,该研究开发了一种新型疫苗策略,通过壳聚糖-抗原复合纳米颗粒高效激活APCs,促进EVs的产生并增强其免疫激活能力。获得的EVs能够独立激活T细胞,促进抗原特异性T细胞增殖,展现出人工纳米抗原呈递细胞(nano-APCs)的功能,从而提高抗原呈递效率,增强疫苗效果。该平台不仅高效、安全及快速,还具备大规模生产和跨物种应用的潜力,为疫苗开发提供了新思路。
浙江大学化学系唐睿康教授和王晓雨副研究员为该论文的共同通讯作者,化学系研究生潘兴微为本论文的第一作者,在读研究生吕益聪、郑梓桐、李辰、胡丽杉和林佳科参与了该工作。该研究受到国家自然科学基金(22037005)、浙江省重点研发计划(2024SSYS0027)以及中央高校基本科研业务费专项资金(2024FZZX02-01-04)的共同资助。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/smll.202501291
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)