首页 > 医疗资讯/ 正文
呼吸机依赖(ventilator dependence)指患者在急性期治疗后仍无法脱离机械通气,需要长期呼吸机支持的状态。研究显示,大约5–10%的机械通气患者会发展为延长机械通气,即需≥7天甚至≥21天的呼吸支持。这些患者预后较差:未能成功撤机者的ICU死亡率显著升高,在一项全球多中心研究(WEAN SAFE,481个ICU,50个国家,5869例患者)中,未能撤机患者的ICU内死亡率高达78%。机械通气时间越长,相关并发症(如呼吸机相关肺炎、气道损伤、ICU获得性衰弱)风险越高。因此,识别影响呼吸机依赖的因素并采取干预,以尽早实现撤机和拔管,对于改善患者预后至关重要。
针对延长机械通气和困难撤机开展了大量研究,包括预测因子分析、早期预警工具和优化撤机策略等。本文重点综述:(1) 呼吸机依赖的预测因素;(2) 潜在呼吸机依赖患者的早期识别策略;(3) 防治措施,特别是撤机和拔管时机的评估工具与指南;(4) 老年及合并慢性疾病患者的特殊呼吸功能特点与应对措施。我们将在各节注明相关研究年份、主要结论及适用人群,并辅以必要的表格总结关键评估工具和干预措施。
一、呼吸机依赖的预测因素
1. 人口学因素与基础疾病:
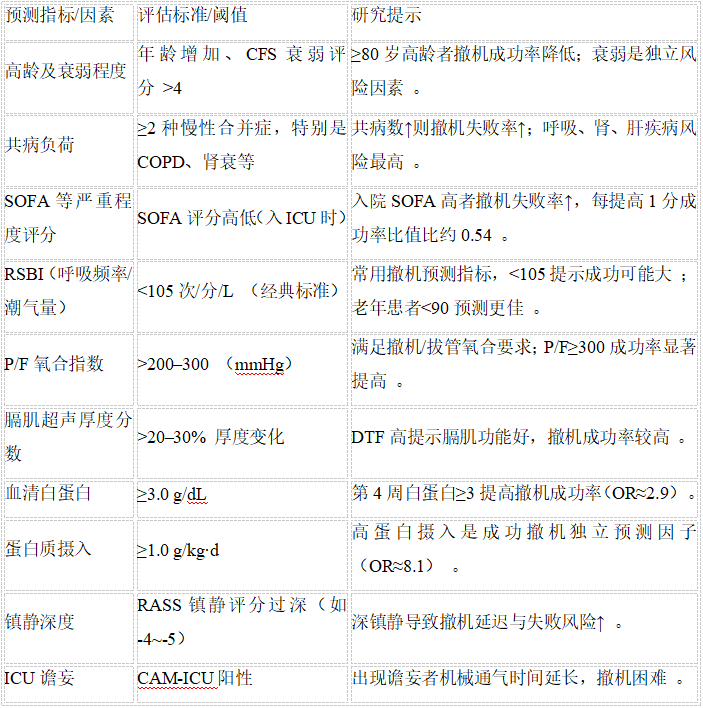
高龄和多种基础疾病是呼吸机依赖的重要风险因素。年龄:多项研究表明,较高年龄段患者发生撤机失败和长期机械通气的概率更高 。一项2024年针对德国呼吸康复中心915例延长机械通气患者的回顾分析发现,≥80岁的超高龄患者撤机成功率仍可达64%,但总体上随年龄增加成功率下降,持续依赖机械通气的可能性升高。但是高龄并不应作为放弃撤机尝试的理由;相反,应综合考虑患者的生理储备和共病情况。衰弱(frailty):近年更强调使用临床衰弱评分(CFS)评估老年患者的生理储备。一项发表于2025年的国际多中心分析(WEAN SAFE子研究,纳入约4600例患者)显示,相对于纯粹的高龄,衰弱状态对撤机结局影响更大:不伴衰弱的≥80岁老年患者撤机失败率约19%,而伴衰弱的老年组失败率高达25%。多变量分析证实衰弱(CFS>4)是独立预测撤机延迟和失败的因素,而高龄(≥80岁)对撤机失败风险也有独立影响,但作用不及衰弱明显。提示临床应关注高龄患者的综合评估,尤其是衰弱程度。
基础疾病和合并症:患者的既往疾病负担直接影响机械通气转归。WEAN SAFE主研究(Lancet Respir Med. 2023)报告,在进入撤机流程的4523例患者中,约65.5%具有至少一种慢性合并症,最常见为慢性神经肌肉疾病(23%)、慢性呼吸系统疾病(21%,如COPD)、糖尿病(21%)等 。共病越多,撤机失败率越高:撤机失败率随着合并症数量从0增加到≥3而逐步上升 。具体而言,具有慢性呼吸系统疾病(如COPD)、慢性心功能不全、慢性肾功能不全、神经肌肉疾病或免疫功能低下等诊断的患者,其撤机失败的几率显著升高。以COPD为例,慢阻肺患者平喘后仍常残留肺功能不全和二氧化碳潴留,容易在自主呼吸试验中出现高碳酸血症和呼吸肌疲劳,撤机难度较大。这类患者在ICU人群中比例高,据一项2024年系统综述统计,在接受撤机的ICU患者中超过20%有慢性呼吸系统疾病病史。心功能不全亦是常见合并症,心衰患者在撤机过程中易出现肺水肿(称为“心源性撤机失败”),需要警惕和干预。慢性肾病患者往往存在液体潴留、电解质紊乱和代谢产物堆积,影响膈肌和呼吸中枢功能,在撤机阶段也更易失败。需要注意的是,并非所有合并症都同等影响撤机:WEAN SAFE的数据提示,慢性心血管疾病尽管增加住院死亡率 ,但对ICU阶段撤机成败的直接预测作用相对小于呼吸、肾脏等疾病 。总体而言,多重慢病共存的患者撤机失败风险显著升高(有3种及以上共病者撤机失败风险较无共病者增加约79%)。临床上对此类患者应更早介入康复、营养和疾病优化管理。
2. 急性期病情严重程度:
患者急性危重状态的严重程度也是影响长期通气的因素。ICU入院时的评分如APACHE II、SOFA等可一定程度反映持续依赖呼吸机的风险 。2025年以色列的一项研究(88例机械通气>14天的患者队列)发现,入院时SOFA评分越高,撤机失败率越高,SOFA每提高1分,成功撤机的比值比约为0.54 。换言之,多器官功能不全程度严重的患者,后续撤机独立呼吸的可能性显著下降。这与其他研究一致:入ICU时严重的ARDS、脓毒症休克等往往需要更长机械通气时间 。另外,急性期呼吸衰竭本身的病因也有影响:例如COPD急性加重、重症肌无力危象等原发呼吸系统问题的患者,撤机难度可能大于单纯肺炎导致的呼吸衰竭患者。在一项系统回顾中,不同疾病导致的撤机失败率存在差异 。因此,初始病情越重、器官功能损伤越广泛,患者演变为慢性呼吸机依赖的几率越大。
3. 呼吸机支持过程中的生理指标:
在机械通气支持过程中,一些呼吸生理参数能够预测撤机成败,被称为撤机预测指标。大量文献在过去几十年研究了超过100种可能的预测指标 。2024年一项系统综述归纳了145种曾被研究的撤机失败预测因子,归类为影像学指标、生理参数、评分/指数和机器学习模型四大类 。最常研究和应用的指标包括:
·浅快呼吸指数(RSBI):即呼吸频率与潮气量之比,经典阈值<105次/分/升提示较高撤机成功可能性。RSBI是应用最广泛的单一预测参数,在不同人群多次验证有效。例如,一项2024年的营养支持研究中,撤机成功组平均RSBI明显更低(成功组RSBI≈80–90,失败组>100)
· 氧合指标:动脉氧分压/吸氧浓度比值(P/F比)常用于评估氧合储备。一般认为在执行自主呼吸试验(SBT)前,患者应达到P/F > 150–300(常用标准>200或>300)才能耐受拔管 。P/F越低(氧合越差)撤机失败率越高。一项2024年研究发现,SBT第四周时若P/F ≥300,撤机成功率显著提高(OR≈2.56)。
· 膈肌超声参数:超声测量膈肌厚度变化百分比(膈肌增厚分数,DTF)和膈肌移动幅度近年受到重视 。文献报道DTF阈值约>30%提示膈肌收缩功能尚可,与撤机成功相关。Frontiers in 2023的一项研究指出,在重症肺炎机械通气患者中,30分钟膈肌移动幅度变化率对预测撤机成功有良好效能。
· 其它指标:循环系统状况(如心率血压变化)、肺功能储备(如深吸气负压MIP > -30 cmH₂O、最大肺活量)、呼吸驱动(0.1秒口腔压力P0.1)等也在研究中。尽管单一指标的预测值有限,但综合评分模型和机器学习模型开始出现。过去十年里,更复杂的综合指数(如综合撤机指数IWI、CORE指数等)和机器学习模型显示出AUC>0.85的较高预测性能 。不过临床应用仍需更多验证。
需要强调,任何单项指标都不能绝对预测撤机结果,必须结合整体临床评估 。因此指南建议,在满足一系列撤机标准后直接进行SBT,以SBT本身作为最终试金石,而不应过度依赖某一预测值。
4. 营养与代谢状态:
营养不良和代谢紊乱会削弱呼吸肌力,从而增加呼吸机依赖风险。低白蛋白血症是营养不良的指标之一。Bartal等(以色列,2025年J Clin Med)对一组通气>14天患者研究发现,入院时低白蛋白(严重营养不良)患者撤机失败的风险是正常白蛋白患者的5.7倍 。营养不良导致的骨骼肌和膈肌衰减被认为是撤机困难的重要原因 。相反,足够的营养支持,尤其是蛋白质供给,有助于改善肌力和撤机结局。一项台湾呼吸照护病房的研究(2024年,289例PMV患者,平均年龄73.5岁)对比了撤机成功与失败者的营养摄入,结果撤机成功组每日蛋白摄入显著更高(平均1.22 g/kg vs 0.99 g/kg)。多因素分析显示,每日蛋白摄入≥1.0 g/kg是独立的成功撤机预测因素(OR高达8.10)。此外,第4周时血清白蛋白≥3 g/dL也显著提高撤机成功率(OR≈2.89)。这些结果提示,改善营养(尤其蛋白质)状态能够提高长期机械通气患者的撤机可能。临床实践中,应尽早进行营养评估和支持,包括纠正低白蛋白、提供高蛋白饮食等,以防止和减轻ICU获得性肌肉减少症对撤机的不利影响。
5. 镇静和谵妄:
镇静过深、镇静药物的长期应用以及ICU谵妄也与呼吸机依赖密切相关。过度镇静会抑制患者自主呼吸驱动和咳嗽能力,并延缓脱离呼吸机的时机。一项覆盖50国的观察研究(Lancet Respir Med. 2023,John Laffey等)发现两个可修改的关键因素:较高的镇静评分和延迟开始撤机均与撤机失败独立相关。具体而言,镇静程度越深,患者达到撤机标准的时间越迟,进而错过最佳拔管时机。研究者指出,过深镇静导致撤机启动延迟,而启动延迟本身又增加撤机失败风险。此外,ICU谵妄常与过度镇静和长期机械通气互为因果。有研究表明,ICU出现谵妄的患者机械通气时间延长,住院死亡率也升高。因此,提倡“醒脱控制”策略,包括轻镇静、每日唤醒(sedation vacation)和谵妄管理,以缩短通气时间。国际指南(例如2021年韩国KSCCM指南)亦强调:“深度镇静和谵妄会导致ICU停留和机械通气时间延长” 。总之,镇静管理不当是可导致呼吸机依赖的危险因素,应通过优化镇痛镇静方案、预防谵妄和约束,促进患者尽早清醒配合撤机。
6. 心理和社会因素:
患者的心理状态也可能影响撤机配合和呼吸驱动。有研究探索焦虑、抑郁等心理因素对撤机结局的影响。例如2023年的一项研究发现,存在明显焦虑、抑郁症状的患者撤机失败率更高 。另一项针对慢性呼吸机患者的研究报告,接近一半(42%)的延长机械通气患者在撤机过程中出现抑郁障碍,而有抑郁的患者撤机失败和死亡风险显著增加 。这些发现提示,需要多学科团队关注ICU患者的心理需求,必要时给予心理支持或药物干预,以利于撤机过程顺利进行。
综上,呼吸机依赖的发生涉及多维度因素,包括患者特征(高龄、衰弱、多共病)、急性期病情严重程度、呼吸生理储备(RSBI、氧合等)、营养肌力状态、镇静谵妄管理以及心理因素等。表1总结了部分主要预测指标及其评估标准。这些因素中,有些是固定不可变的(如年龄),但许多是可干预的可逆因素(如营养、镇静管理),为我们预防和减少呼吸机依赖提供了重要切入点。
二、可能发生呼吸机依赖患者的早期识别策略
1.每日系统评估撤机准备:
早期识别的核心是在尚未发生撤机失败前,及时甄别出高风险患者并采取干预。国际指南(如ACCP/AARC撤机指南)均强调对所有机械通气患者进行每日撤机准备评估 。典型做法是每天由床旁医护按照标准清单检查患者是否满足SBT条件,包括病因好转、意识清醒、循环稳定、氧合达标(如FiO₂≤0.4、PEEP≤5 cmH₂O,P/F>150-200)等 。一旦满足条件,即可进行SBT尝试。如果患者符合撤机标准却因疏忽未及时评估,可能导致撤机启动不必要延迟 。延迟撤机启动本身已被证明与不良结局相关:2023年一项涉及50国ICU的研究发现,在满足条件后每延迟一天开始撤机程序,撤机失败风险显著增加 。因此,采用标准化的每日评估和撤机方案(即“liberation protocol”)可帮助尽早识别有自主呼吸潜力的患者,并防止因流程原因造成的延误 。例如,JAMA的一项大型观察研究发现,实施每日呼吸治疗师/护士驱动的撤机评估protocol能提高及时SBT率并缩短机械通气时间 。总之,将撤机准备评估常规化、制度化是早期发现可撤机患者、减少不必要延迟的关键策略。
2.应用预测模型和评分:
针对高危患者的早期识别,除床旁评估外,还可借助一些风险预测工具。其中一个典型例子是ProVent评分。ProVent是“长期机械通气预后”模型,由Carson等基于大规模研究提出,用于在患者接受≥21天机械通气时预测其一年生存可能。原始ProVent评分包含四个变量:年龄>50岁、血小板计数<150×10^9/L、持续使用血管加压药、需要肾脏替代治疗,每项计1分 。总分0–5对应不同生存率。一项奥地利单中心研究(2022年,780例通气≥21天患者)对ProVent进行了外部验证,结果显示ProVent评分与一年死亡率密切相关:在该队列中ProVent评分0分、2分、5分的患者1年死亡率分别约15%、57%、76% 。虽然原模型在不同队列需校准,但总的来说,高ProVent分值提示患者长期预后不佳,可能持续依赖机械通气 。因此,对于已通气2–3周仍未能脱机的患者,应用ProVent或类似模型,可帮助早期识别哪类患者极可能成为“呼吸机依赖者”,从而指导预先介入(如与家属沟通预后、考虑专业康复或长期照护计划等)。另外,临床衰弱评分(CFS)也可作为ICU早期评估工具:前述2025年研究提示,ICU收治时CFS评分高的患者撤机不良结局更多 。因此,对高龄患者可在入院时评估frailty,高分者列为重点监测对象。需要注意,预测评分是辅助工具,不应取代临床判断。但合理应用风险评分可以使医护对可能演变为慢性呼吸机依赖的患者“心中有数”,及早制定相应计划。
3.重视可干预风险因素的早期控制:
在识别出高风险患者后,应尽快针对可逆因素采取干预,以防止其演变为长期依赖。镇静管理即是一例。如前述,高镇静水平与撤机延迟和失败有关 。因此在机械通气早期阶段就应采取浅镇静策略,维持患者在可合作状态(如目标RASS -2~0),每天尝试唤醒评估自主呼吸情况 。这方面SCCM推出的“ICU Liberation(A-F)”套件包含了疼痛-镇静-谵妄-运动-家庭参与的综合措施,被证实可减少谵妄发生和缩短机械通气天数 。又如营养问题,早期就应筛查营养不良,给予足够热量和蛋白质,以防后期出现严重肌无力。对于入ICU时白蛋白很低的患者,可考虑输注白蛋白和强化营养支持,并监测后续肌肉质量的变化 。物理康复也应尽早介入——研究显示,ICU内实施早期活动锻炼,可加速撤机、缩短ICU逗留时间 。因此,对于可能长期卧床的重症患者,应该尽快开始渐进的运动(床上被动运动、坐起、下床训练等)以减少ICU获得性衰弱的发生。再如呼吸肌锻炼,对需要较长通气支持的患者,可以从恢复期开始采用简易的膈肌训练(阀门呼吸训练、间歇自主呼吸训练)等,增强其自主呼吸耐力。一些呼吸康复中心采用间歇性自主锻炼策略,使患者每天逐步延长自主呼吸时间 。总之,在机械通气过程尽早识别并干预营养、镇静、运动等可控风险因素,能预防一部分患者发展为难以脱机的状态 。
4.提前规划气道管理决策:
对于早期评估已明确短期内无法脱机的患者,应及时考虑气道管理调整,如尽早行气管切开。早期气管切开可降低气道阻力、减少镇静需求并利于分泌物管理,这可能改善长期撤机成功率。一项针对康复中心的回顾研究提示,在插管后14天内进行气管切开的患者,其后续成功脱机比例高于延迟切开的患者(早期切开组45% vs 延迟组仅34%,p<0.05) 。该研究认为,晚期(>14天)才行切开的患者往往病情更复杂,长期依赖呼吸机概率更高 。因此,对于预计>2周仍难拔管的ICU患者,可在第1–2周时就启动气管切开评估,以利于后续慢速撤机。在选择气管切开时机时,应综合考虑疾病可逆性、气管插管耐受性和患者意愿等。目前多数指南建议在21天左右评估是否气管切开,但对于明确需要延长通气的情况,也有研究支持10天左右早期切开的益处。提前规划的另一个方面是在识别高风险患者后,应多学科团队和家属沟通预后。对于可能长期依赖呼吸机者,及早讨论长期ICU治疗意愿、康复转介或姑息照护方案,有助于在患者演变为“呼吸机长期使用者”时避免仓促决策。总之,早期识别高危患者不仅在于医学评估,还包括提前做好临床决策规划,如必要的气道处理和治疗目标调整等。
三、呼吸机依赖的防治策略:撤机与拔管时机评估、工具及指南
1. 撤机困难的分级定义:
制定适当的撤机策略需要首先明确患者属于哪种撤机难度类别。国际上通用的分类来自2007年ATS/ERS/SCCM等的共识,并在2017年有所更新 。按撤机尝试次数和时间长短,可分为三类:
· 简单撤机(simple weaning):首次自主呼吸试验即可成功撤机并拔管。这类患者约占大多数。
· 困难撤机(difficult weaning):需要2–3次SBT或多达7天才成功撤机。文献报道约15–20%的患者属于此类 。
· 延长/顽固撤机(prolonged weaning):经过≥3次SBT且>7天仍未成功撤机 。这部分患者比例约5–10%,即通常所说的呼吸机依赖人群。
对于延长撤机的患者,又可进一步分出仍可能撤机和永久依赖两种结局。采用这一分类,有助于在临床实践中识别需要特殊干预的困难/延长撤机患者,并参考相应指南采取措施。例如,欧洲呼吸学会(ERS)建议,对于进入“延长撤机”范畴的患者,应转入专门的呼吸康复/撤机中心进行后续管理。德国已建立了认证的延长撤机中心网络(WeanNet),提供多学科团队和规范流程管理。据报道,这类中心可提高顽固撤机患者的成功脱机率,降低长期居家带机的比例,同时具有成本效益 。因此,明确撤机困难级别是实施下一步针对性策略的基础。
2. 撤机(Weaning)策略与工具:
撤机过程通常包括评估撤机准备、逐步减低通气支持、进行自主呼吸试验(SBT),最后拔管或拔除人工气道。核心目标是在尽早且安全的时机让患者摆脱呼吸机。主要策略和评估工具包括:
· 病因治疗和全身状况优化:指南强调在撤机前应尽可能纠正导致呼吸衰竭的可逆原因,如控制感染、纠正酸碱失衡、改善心衰或解除支气管痉挛等 。只有当引起呼吸衰竭的急性病因好转,患者才具备撤机基础。
· 撤机准备标准检查表:如前述,每日进行评估。常用标准包括:①疾病病情改善(如肺部炎症吸收);②氧合指标达标(PEEP和FiO₂低需求,P/F>150–300);③循环稳定(无需升压药);④无显著酸中毒;⑤神志清醒、咳嗽有力;⑥无过多分泌物等 。只有在满足这些条件后才启动正式SBT,以避免过早撤机失败。
· 自主呼吸试验(SBT):SBT是评估患者脱机能力的金标准试验。通常采用两种方式之一:T管试验(拔除患者与呼吸机连接,仅给予湿化氧气)或低压支持试验(呼吸机给予低水平压力支持,一般PS=5–8cmH₂O,PEEP=0–5)。SBT持续时间传统为30分钟至2小时。有研究探索更长时间(如1–2天)的SBT对延长撤机患者的作用。2022年Thille等在NEJM发表的多中心试验比较了PSV模式SBT vs T管SBT在高危患者中的效果,结果两者在7天内的拔管率和再插管率无显著差异。因此临床可根据习惯采用任一SBT方式。重要的是在SBT过程中密切观察患者耐受情况,包括呼吸频率、节律、气体交换和主观症状等 。SBT的阳性标准一般是患者在试验中无明显呼吸窘迫或不耐受,如呼吸频率<35次/分、SpO₂保持>90%、心率无剧烈波动等 。若SBT成功,则可进入拔管评估阶段;若失败,则需查找原因、处理后隔日再试。值得注意的是,有文献指出首次SBT失败的患者中约70%以上在随后几天可成功撤机 ,因此不应因一次失败就放弃努力。
· 逐步减低通气支持:对于不能一次性通过SBT的患者(困难或延长撤机者),可采用渐进式撤机方案。常见模式包括:①间歇T管锻炼:每天让患者脱机呼吸一定时长(如最初5分钟),逐日延长脱机时间,再其余时间回接呼吸机休息 。这种方法锻炼患者耐力,同时避免持续疲劳。②压力支持递减法:每日将PS水平从较高值逐步下降(如每日减2–4 cmH₂O),直到低水平,再行拔管尝试 。③SIMV序贯减少法:逐渐减少强制通气频率,过渡到自主呼吸 。④组合方案(如TIPS协议):即同步间歇通气+压力支持+T管锻炼的综合步骤 。一项2021年的系统回顾比较了这些策略在慢性呼吸机依赖患者的效果,结果差异不大,但个体化调节很重要:对于衰弱或边缘状态患者,压力支持渐减可能更平稳,而对重症COPD患者,间歇脱机锻炼有时更合适 。因此,应根据患者耐受情况选用合适的渐进撤机策略。无论采用何种模式,均建议多学科团队(医师、治疗师、护师等)每日评估进展,并及时调整方案。
· 拔管前评估:通过SBT后,还需评估患者拔除气管插管后能否维持气道通畅和有效咳痰 。具体包括:意识和保护性反射(患者应清醒、能指令性咳嗽,吞咽反射正常)、分泌物情况(痰量不至于频繁堵管,患者能自行咳出或吸引),咳嗽力度(可用峰流速仪测定,咳嗽峰流速<60 L/min提示咳痰无力)等。如果患者神志昏蒙或极度衰弱,即使SBT耐受也可能因不能保护气道而拔管失败。常用的套囊漏气试验(cuff leak test)**可帮助评估拔管后喉头水肿风险:在撤机前放掉气管插管套囊,观察吸气潮气量与呼气量差值,差值过小(如<110 mL)提示无漏气,说明喉头水肿可能严重,贸然拔管易致窒息 。此时应推迟拔管或先行气管切开。总的来说,拔管决策需慎重考虑SBT结果与以上气道保护评估,两者都通过时方可安全拔管 。
· 拔管及拔管后支持:拔管应选择在患者状态最佳的时段(通常白天),备好再插管的设备。拔管后早期严密监测是必要的,前48小时是拔管后呼吸衰竭(PERF)高发期 。对于拔管高风险患者(如高龄、COPD、心功能不全、之前有一次拔管失败等),预防性无创通气(NIV)或高流量鼻氧(HFNC)支持是近年推荐的做法 。多个RCT和Meta分析显示,在高危患者拔管立即给予NIV可以显著降低再插管率,尤其适用于COPD伴高碳酸血症、充血性心衰患者 。HFNC则在低氧血症风险患者(如肺部疾病)中效果确切,可替代传统面罩氧疗提供恒定低水平正压和高浓度氧,从而减少拔管后低氧和呼吸窘迫 。一项2015年的NEJM研究表明,HFNC在降低拔管后呼吸衰竭率方面优于常规氧疗且不劣于NIV,对中等风险患者是简便有效的选择。值得一提的是,在一些需要长期通气的气管切开患者,NIV还能作为拔机但不拔管的过渡手段:先拔除呼吸机连接管,让患者经人工气道接口用NIV支持,以减少有创通气时间 。总之,围拔管期的适当辅助通气(如NIV、HFNC)是现代撤机策略的重要组成,可提高拔管成功率和患者舒适度 。
3. 老年和共病患者的特殊策略:
针对老年、有慢性疾病的呼吸机依赖高风险人群,防治策略需有所侧重:
· 加强康复与营养支持:这类患者往往基础体能和肌肉储备较差,因此超早期、强化的运动康复尤为关键。可以考虑每日两次甚至更多频次的物理治疗、床旁肌力训练等,以对抗衰弱带来的运动功能衰退 。营养方面则要个体化制定高蛋白饮食方案,必要时加用肌肉生成促进剂(如维生素D、促睾酮等)帮助改善肌肉质量。
· 延长撤机计划:老年及多共病患者多属于困难或延长撤机类别,宜采用“慢调慢放”的撤机计划。ACCP等建议对>7天未脱机患者采取“慢速撤机”:逐日增加自主呼吸时间或降低支持,避免过度疲劳 。如上文提到的多种渐进撤机模式,应根据患者耐受进行更细致的调节。例如80岁合并COPD的患者,第一天也许只能脱机5分钟,逐步递增;而对肾功能不全者,则在透析日慎重SBT选择时间(透析后酸碱平衡改善时进行)。
· 合并症管理:在撤机过程中要同步积极处理基础疾病,多学科协作。COPD患者应全程给予支气管扩张剂、排痰治疗,并严密监测二氧化碳潴留情况,必要时在SBT末期即接无创通气协助吹除CO₂ 。心功能不全患者应在撤机当天给予适度的利尿剂或扩血管药物,防止拔管后心衰诱发急性肺水肿(一些中心会在拔管前测BNP水平或床旁超声评估心功能,以指导用药)。慢性肾衰患者则可安排在规律透析后进行撤机,避免尿毒症或电解质紊乱干扰呼吸驱动;同时注意透析导致的碱中毒(过高的HCO₃⁻可抑制呼吸中枢)并调整透析液配方。若患者合并慢性感染或免疫抑制,则拔管后预防性加强气道管理,减少感染复发导致的再插管。
· 精神心理支持:老年患者常伴焦虑、抑郁或谵妄,撤机前给予充分的解释安抚,必要时使用小剂量焦虑药物(谨慎使用避免抑制呼吸)。有条件的话,让家属在床旁陪护参与康复,可显著缓解老年患者的不安,提高配合度 。有研究指出,家庭参与ICU护理有助于改善老年危重患者的治疗结局,包括认知和心理状态,从而间接有利于撤机 。
· 转诊专科机构:对于医院ICU内反复撤机失败的老年/多共病患者,应考虑转入呼吸机依赖专科单位。这些单位配备物理治疗师、呼吸治疗师、营养师和社会工作者等,可以提供更加全面的慢性期管理。在专科康复医院,延长撤机患者往往有更高几率实现迟发撤机独立。一项报道指出,在ICU判定为“无法撤机”的患者中,转入慢性呼吸照护后仍有超过50%最终成功撤机。因此,不应轻易放弃对老年合并症患者的撤机尝试,而应考虑环境和团队的转换,以最大化成功可能。
四、特殊人群的呼吸功能特点与应对措施
1.老年患者:
高龄患者呼吸储备和代偿能力下降,表现出撤机耐受性差和并发症多的特点。其呼吸肌肉强度和肺弹性降低,容易在脱机后发生肺不张或二氧化碳潴留。同时,老年人常合并认知障碍或谵妄,难以配合自主呼吸锻炼。针对老年患者,应特别关注衰弱综合征的管理,上述临床衰弱评分有助于区分“健康高龄”与“脆弱高龄”患者。研究表明,尽管高龄降低撤机成功率,但很多80岁以上患者在适当支持下仍能成功脱机(Heidelberg Weaning Center数据显示≥80岁成功率达64%)。因此,对老年患者应坚持积极尝试撤机,同时提供额外的支持:包括增加护理人手帮助清除气道分泌物,使用带薄雾的湿化系统保护黏膜,防治谵妄(如调整昼夜节律、家属陪伴),营养上给予更高热卡蛋白比值等。对极衰弱老年人,可考虑更早进行气管切开,在清醒状态下逐步训练自主呼吸,以避免反复经口插管带来的创伤和应激。还需注意老年人拔管后可能发生延迟性呼吸衰竭,因此出ICU后也应继续随访呼吸功能,一旦有疲劳征兆及时干预(比如短期无创通气辅助)。同时严防各种并发症。衰弱老人的撤机成功不仅取决于呼吸治疗技术,更取决于整体综合照护和康复 。
2.COPD患者:
慢阻肺患者是ICU常见的呼吸机依赖高危人群,其特点是呼吸道阻力高、呼气延长和气体陷闭,导致撤机时呼吸做功大、容易疲劳。此外,COPD患者平时以高碳酸血症容忍为特点,突然脱机可能出现CO₂急剧升高。为此,针对COPD患者的措施有:①尽可能纠正可逆因素:如强化支气管扩张、排痰、无创机械辅助咳痰,减少气道阻力和死腔;②渐进撤机:COPD患者往往需要更长的撤机过渡期,可以采用压力支持递减法,逐步锻炼其通气能力,而非一次性SBT;③二氧化碳监测:撤机过程中通过血气或经皮CO₂监测,及时了解患者通气是否足够,必要时在SBT中后段给予短暂无创通气帮其“冲洗”CO₂;④拔管后无创通气:对COPD患者,预防性无创通气是最有效的干预措施之一。Nava等的经典研究以及其后的系统综述均证实,在COPD拔管后立即给予NIV能显著降低再次插管率和病死率,现已成为标准建议 。此外,部分重度COPD患者可能需要长期呼吸支持,若撤机失败而又不适合插管,可考虑带机出ICU,改行NIV在普通病房甚至居家继续通气支持 。
3.心功能不全患者:
合并充血性心力衰竭(CHF)或左室功能不全的患者在撤机时容易发生心源性肺水肿,这是撤机/拔管失败的重要原因之一,称为“撤机相关心血管衰竭”。其机制在于拔除正压通气后胸腔内负压增大,回心血量骤增,加之交感兴奋使心率血压升高,结果心脏负荷过重引发急性肺水肿。临床上,可通过以下措施应对:①撤机前心功能评估:检查有无肺部啰音、测BNP水平、超声评估左室射血分数和充盈压。如指标异常,应先强化利尿等治疗。②拔管时机:尽量选择患者血容量相对低、心功能代偿好的时刻拔管。例如透析患者在透析后拔管,心衰患者在强力利尿后第二天拔管。③药物优化:在SBT当天,可预防性使用小剂量扩血管药物(如硝酸酯类)减轻后负荷;必要时联合正性肌力药以支持心输出量。有研究建议对于既往有撤机心衰的患者,在撤机试验中加用连续的无创CPAP(提供5 cmH₂O左右的PEEP)可能有助于减少肺水肿发生。④拔管后监护:这类患者拔管后除常规氧疗外,应密切观察心率、血压和呼吸,必要时提早使用面罩CPAP或NIV以给予一定正压减少心脏前负荷。如果出现轻度肺水肿征象(如湿啰音增加、低氧),应立即给予无创通气和静脉利尿,不要等待发展到严重呼吸窘迫才处理。总的方针是防患于未然:认识到心衰患者撤机风险高,在撤机过程给予针对性循环支持,才能提高成功率。
4.慢性肾功能不全患者:
慢性肾病(CKD)患者在ICU常见,特别是终末期肾衰接受透析者。他们的特殊性在于容量和电解质波动以及代谢产物蓄积。液体过多会诱发肺水肿、胸腔积液,直接影响氧合和呼吸功效;而电解质紊乱(如高钾、低磷)和代谢性酸中毒/碱中毒均可抑制膈肌收缩力或呼吸驱动。对此类患者,撤机策略上要强调:①容量管理:确保患者在靠近枯干体重状态撤机,透析患者尽量在透析清除多余水分后进行SBT。若无透析条件则给予利尿,将中心静脉压控制在较低水平。②纠正电解质:低磷、低钙、低镁等均可导致肌无力,应在撤机前纠正到正常。③调整酸碱度:透析患者常存在代谢性碱中毒(透析液高碱度所致),碱中毒会降低呼吸中枢兴奋,因此拔管前应适当降低透析液碱度或给予轻度补酸,使血液pH维持在7.35–7.40,以利于自主呼吸。④预防负荷波动:撤机当天避免大量液体入量(如先不做输血等),以防心肺负担突然加重。另外,如前述,将拔管安排在透析后,以减少拔管后短期内容量超负荷的风险。对于透析间期发生拔管的患者,要警惕随后体重增加,必要时加强超滤频率。在康复阶段,肾功能不全患者因尿毒症亦可能食欲差、营养不良,需要特别的高热量高蛋白饮食来保持肌肉力量(透析患者蛋白需要量比一般ICU患者更高)。
5.其他特殊疾病:
神经肌肉疾病(如ALS、肌营养不良、重症肌无力等)患者往往是典型的慢性呼吸机依赖人群。这些疾病导致呼吸肌麻痹,很多最终需要长期机械通气甚至家庭呼吸机支持。对于可逆的神经肌肉危象(如格林巴利综合征、重症肌无力危象),则应在病因治疗同时采用长时间渐进通气支持,耐心等待肌力恢复,不可贸然拔管。这类患者恢复期可借助膈肌起搏器、咽喉肌电刺激等新技术辅助撤机。一些案例报道使用膈神经起搏器成功帮助高位截瘫患者摆脱呼吸机,为特殊人群提供了新思路。此外,肥胖低通气综合征患者(OHS)在ICU撤机时也要注意其肥胖特性,可考虑在拔管后过渡一段双水平气道正压通气以防CO₂蓄积和气道塌陷。慢性肺疾病晚期(如终末期肺纤维化)患者可能在撤机后因基础肺储备太低而失败,此时可能需要评估是否进行肺移植或长期机械通气作为“桥接”。对于确无撤机希望的患者,则应启动姑息治疗方案,注重患者舒适和生活质量。
总的来说,不同基础疾病和年龄的患者在撤机过程中遇到的障碍不同,需个体化制定对策。应在一般撤机指导原则下,结合每位患者的特定病理生理情况调整方案,并借助各专科团队的协作,实现量身定制的呼吸支持撤离过程。
五、小结
呼吸机依赖已成为ICU领域面临的重大挑战之一。近五年的研究进展使我们对其预测因素、早期识别和防治措施有了更深入的认识:高龄、衰弱、多重共病、严重的急性疾病、营养不良、过深镇静等都会显著提高患者长期依赖机械通气的风险 。幸运的是,其中许多因素是我们可以干预的。通过每日规范化评估及时发现具备撤机条件的患者 、运用风险模型提前识别潜在的“撤机困难”人群 、以及在机械通气的全过程中优化镇静、营养、康复等管理 ,我们有望降低呼吸机依赖的发生率。
在撤机和拔管阶段,循证的评估工具(RSBI、SBT、咳嗽力量等)和循证的支持策略(如拔管后NIV/HFNC应用)已被纳入指南推荐 。对于老年和伴慢性疾病的患者,更需要多学科的精细化管理和耐心,很多此类患者在专科团队的努力下依然能迟延但成功地脱离呼吸机。
当然,也有部分患者最终将成为“不可撤机”的慢性呼吸机依赖者,对这些患者我们应在人道关怀的基础上提供长期通气支持或姑息治疗方案。总之,呼吸机依赖的防治是一项复杂的系统工程,需要将最新循证医学证据融入临床实践,制定个体化的撤机计划,同时持续评估和改进。在实践中贯彻“尽早解除机械通气负担”的理念、识别并消除可逆障碍,以及整合ICU内外资源进行康复,是提高呼吸机依赖患者预后的关键 。未来随着对呼吸衰竭慢性期机制的更多研究,以及新技术(如人工智能辅助决策、膈肌康复技术等)的出现,我们有望进一步提高疑难危重患者的撤机成功率,减少长期呼吸机依赖的发生,从而改善患者的长期生存和生活质量。
参考文献
1.Sterr F, et al. Critical Care. 2024;28(366): Predictors of weaning failure in ventilated ICU patients: a systematic evidence map
2.Shah NM, et al. Breathe (Sheff). 2024;20(3):240122. “Prolonged weaning from mechanical ventilation: who, what, when and how?”
3.University of Galway - WEAN SAFE study Press Release, Jan 2023
4.Laffey CM, et al. Annals of Intensive Care. 2025;15(13): Impact of frailty and older age on weaning from invasive ventilation (WEAN SAFE sub-study)
5.Bologheanu R, et al. BMJ Open Respir Res. 2022;9:e001327: External validation of the ProVent score
6.Bartal A, et al. J Clin Med. 2025;14(13):4427: Predictors of weaning success in prolonged mechanical ventilation
7.Chang CH, et al. Front Nutr. 2024;11:1449240: Higher protein intake benefits prolonged mechanical ventilation patients
8. Thille AW, et al. N Engl J Med. 2022;387(17):1843-1854: Spontaneous-Breathing Trials with Pressure Support vs T-Piece
9.Nava S, et al. JAMA. 2005;293(7):851-859
10.Spadaro S, et al. Critical Care. 2022;26(1):11: Weaning practices in Europe
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)