首页 > 医疗资讯/ 正文

本研究选用小鼠肝细胞癌细胞系H22和人源HCC细胞系Huh7、LM3进行细胞实验。采用西方印迹(Westernblot)、RT-qPCR检测PD-L1蛋白及mRNA水平;利用蛋白酶体、溶酶体及自噬抑制剂(MG132,氯喹CQ,3-MA)探究PD-L1降解途径;结合网络药理学、分子对接及分子动力学模拟确定大黄素的靶点;通过生物素-链霉亲和素拉下法验证大黄素与GSK-3β的直接结合;应用选择性GSK-3β抑制剂TDZD-8和过表达质粒调控GSK-3β水平,观察对PD-L1表达和大黄素作用的影响。动物实验采用H22细胞皮下移植小鼠模型,评估大黄素单独或与抗PD-L1抗体联合治疗的抗肿瘤效果,结合流式细胞术分析肿瘤浸润CD8+T细胞的数量及功能。最后,进行肿瘤组织的RNA测序,分析大黄素对肿瘤微环境免疫基因表达的调控。
研究结果
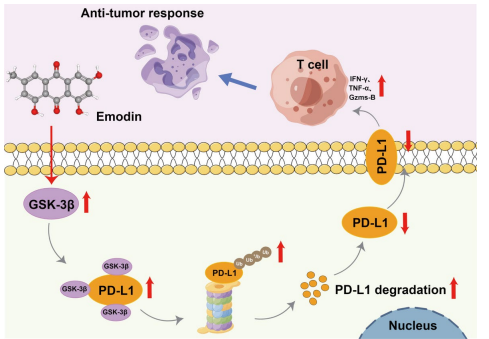
大黄素剂量依赖性降低H22、Huh7及LM3细胞的PD-L1蛋白水平,但不影响其mRNA表达,提示作用于蛋白稳定性层面。细胞蛋白合成抑制剂环己酰亚胺(CHX)试验显示大黄素显著缩短PD-L1蛋白半衰期。蛋白酶体抑制剂MG132阻断了大黄素诱导的PD-L1降解,而溶酶体和自噬抑制剂未见效果,表明蛋白酶体途径介导此过程。网络药理学筛选出GSK-3β作为大黄素的重要潜在靶点,分子对接与动力学模拟显示大黄素与GSK-3β结合稳定,生物素-链霉亲和素拉下实验进一步证实两者直接结合。
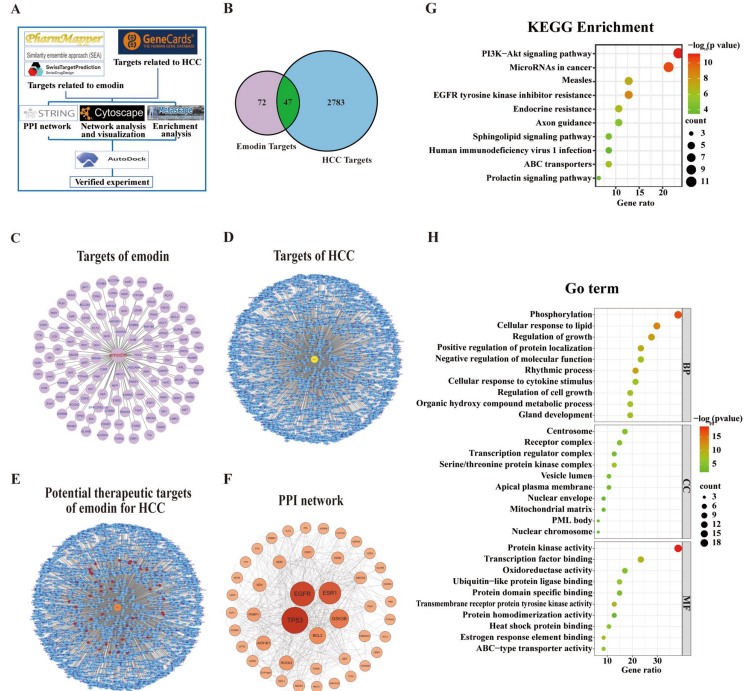
图:大黄素在肝细胞癌中的网络药理学分析
在细胞水平,GSK-3β抑制剂TDZD-8抑制GSK-3β活性后,PD-L1蛋白表达恢复,大黄素对PD-L1的抑制作用被逆转;反之,GSK-3β过表达降低PD-L1表达,并增强大黄素作用。大黄素处理后,肿瘤组织中CD8+T细胞浸润明显增加,细胞因子TNF-α、IFN-γ及颗粒酶B的分泌水平升高,显示较强的抗肿瘤免疫反应。
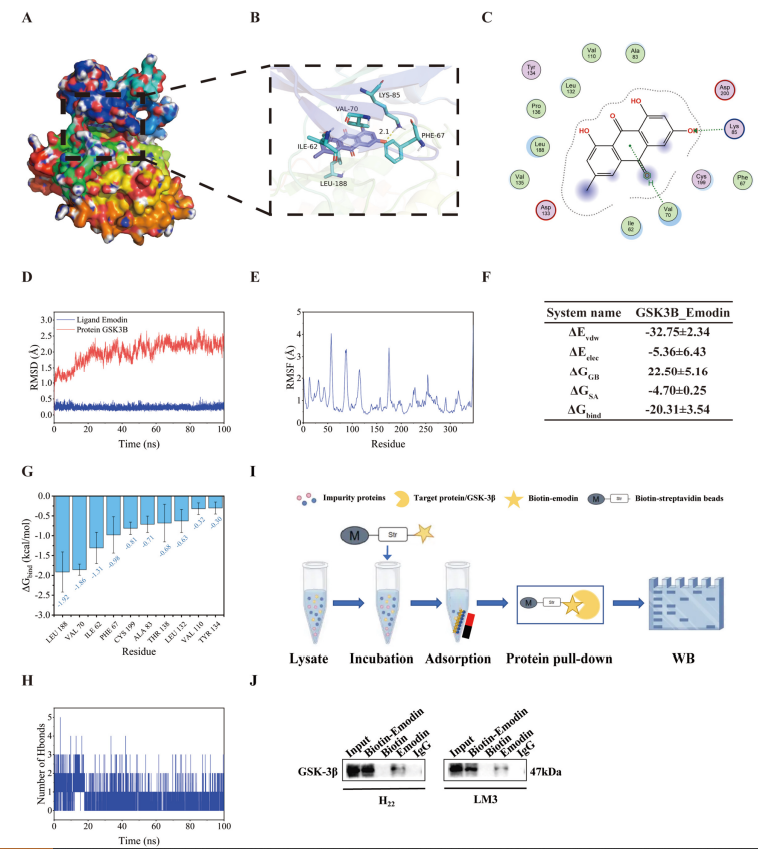
图:大黄素与GSK-3β的相互作用
RNA测序分析发现大黄素上调了肿瘤微环境中化学因子信号通路相关基因,促进免疫细胞的迁移和活化。在H22小鼠皮下移植模型中,大黄素联合低剂量抗PD-L1抗体相比单独使用抗体显示协同抗肿瘤效果,肿瘤体积和重量显著下降,且未见明显毒副作用。
研究结论
本研究揭示了大黄素通过直接靶向GSK-3β,促进肝细胞癌中PD-L1蛋白的蛋白酶体介导的降解过程,降低肿瘤细胞表面PD-L1表达,从而解除对CD8+T细胞的免疫抑制,增强其抗肿瘤效应。大黄素不仅具有潜在的单药抗肿瘤活性,还能与抗PD-L1抗体协同提升免疫治疗效果,减少剂量相关毒性。这为肝细胞癌免疫治疗提供了一种天然小分子药物的新策略。
本研究也存在一定的局限性,例如本研究主要基于细胞系和小鼠异种移植模型,尚需在更复杂的人源化模型及临床样本中验证大黄素的治疗效果及安全性。此外,GSK-3β在肝癌中的角色复杂,未来研究需进一步阐明其调控机制及大黄素的其他潜在靶点。同时,如何精准筛选适合大黄素联合治疗的患者群体及优化联合用药方案,将是临床转化的关键环节。
原始出处
Yang, X., Chen, W., Sun, H. et al. Emodin promotes GSK-3β-mediated PD-L1 proteasomal degradation and enhances anti-tumor immunity in hepatocellular carcinoma. Chin Med 20, 126 (2025). https://doi.org/10.1186/s13020-025-01146-6
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)