首页 > 医疗资讯/ 正文
1 病例资料
患者,女性,79岁。自2024年10月起,患者因反复出现吞咽困难,并伴有反酸、乏力、消瘦及食欲下降等症状,于2024年11月15日于当地医院行胃镜检查,结果提示胃底贲门癌侵及食管;胸部CT检查提示食管下段胃底贲门部黏膜不均匀增厚,考虑为恶性肿瘤,并存在胃小弯侧多发淋巴结转移的可能性。2024年11月17日后,患者吞咽困难症状加重,遂于2024年11月26日转诊至南方医科大学珠江医院,门诊以食管胃结合部肿瘤收治。自发病以来患者饮食较差, 2个月内体重下降3 kg。体格检查发现,左下腹壁背部可触及一长梭形肿物,大小约5 cm×4 cm,肿物质韧、活动度差,其余系统检查未见明显异常。
实验室及辅助检验结果显示,胃肠肿瘤标志物中癌胚抗原(carcino-embryonic antigen,CEA)为64.2 μg/L[正常参考范围:0~5.0 μg/L)];糖类抗原19-9(carbohydrate 19-9, CA19-9)为7 062.0 μg/L[正常参考范围:0~37.0 μg/L)];糖类抗原72-4(carbohydrate 72-4,CA72-4)为9.51 μg/L[正常参考范围:0~6.9 μg/L)]。患者于2024年11月27日接受胃十二指肠镜检查,结果提示食管及贲门处肿物(图1)。内镜下取活组织经石蜡包埋病理学检查结果显示:① 食管下段为低分化腺癌,免疫组织化学检测结果显示,CK(+), CK7(部分+),CK20(+),CK5/6(-),P40(-), P53(突变型表达),Ki-67增殖指数高(约为80%)。② 贲门处检查结果显示亦为低分化腺癌,免疫组织化学检测结果显示,CK(+),CK7(部分+),CK20(+),CK5/6 (-),P40(-),P53(突变型表达),Ki-67增殖指数高(约85%)(图2)。因此诊断为食管胃结合部腺癌。2024年11月27日 程序性死亡配体1(programmed death ligand 1,PD-Ll)蛋白伴随诊断,会诊组织切片H-E染色结果显示:(胃底、食管活检组织)腺癌,中-低分化;免疫组织化学检测结果显示,人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)为阴性;PD-L1为(+),联合阳性评分(combined positive score,CPS)评分约为4 (图2)。2024年11月27日行胸腹盆CT平扫+增强扫描,结果显示:① 食管下段-贲门壁增厚,考虑恶性肿瘤性病变可能性大;网膜囊多发淋巴结肿大,双侧胸壁及左下腹壁背部软组织多发结节,双侧肾上腺增大并不均匀强化,考虑转移可能。② 右肺中叶外侧段及左肺下叶散在小结节,炎性结节与转移灶相鉴别(图3)。
完善检验检查后经多学科联合诊疗组(multidisciplinary team,MDT)讨论评估,患者确诊时已存在皮肤、淋巴结、肾上腺等多发性远处转移,分期为Ⅳ 期。根据美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)指南推荐,Ⅳ期肿瘤应以全身系统性治疗为主,手术仅适用于局部症状控制或寡转移病 例[1]。此外,考虑到患者高龄(79岁)、一般状况欠佳且耐受性有限,扩大切除范围进行根治性手术的手术并发症发生率可能较高,因此判断患者暂无手术根治适应证,皮肤转移瘤切除活检为可行操作,后续拟行“肿物切除活检+恶性肿瘤晚期一线治疗”。患者于2024年11月29日行“侧腰背部肿物切除活检术”,术后病理学检查显示:左侧腰背部肿物为转移癌,考虑为食管胃结合部腺癌转移,癌细胞CK(+)、CK7(+)、CK20(大部分+)、P53(过表达,错义突变)、Ki-67增殖指数约为95% (图4)。排除化疗禁忌证后,患者于2024年11月30日接受第1个疗程化疗,方案为XELOX(奥沙利铂150 mg,静脉滴注,第1天,每3周1次+卡培他滨1 500 mg,口服,每日2次,第1~14天,每3周1次);并于2024年12月1日接受第1个疗程免疫治疗,方案为信迪利单抗(200 mg,静脉滴注,第1天,每3周1次)。化疗全程患者可耐受,无严重不良反应或不良事件发生,于2024年12月2日出院。
患者后续分别于2024年12月24日、2025年1月14日、2025年2月6日在南方医科大学珠江医院日间化疗中心接受第2、3、4个疗程的治疗,方案为XELOX(奥沙利铂150 mg,静脉滴注,第1天,每3周1次+卡培他滨1 500 mg,口服,每日2次,第1~14天,每3周1次)+信迪利单抗(200 mg,静脉滴注,第1天,每3周1次)。患者于2025年2月25日返院复查,肿瘤标志物检查结果结果如下:CEA为5.3 μg/L[正常参考范围:0~5.0 μg/L)];CA19-9为21.3 μg/L[正常参考范围:0~37.0 μg/L)];CA72-4为0.94 μg/L[正常参考范围:0~6.9 μg/L)]。2025年2月26日,患者复查电子胃十二指肠镜,结果显示:① 慢性萎缩性胃炎伴糜烂?(木村-竹本分类:O3),胃幽门螺杆菌(Helicobacter pylori,HP)(-);② 胃多发息肉;③ 食管胃底结合部癌(图5)。同日,患者复查胸腹盆CT平扫+ 增强,结果显示:① 输液港植入术+左侧腰背部肿物切除术+恶性肿瘤化学治疗后复查,食管下段-贲门壁增厚程度较前减轻,结合病史及病理结果,考虑为腺癌;网膜囊多发肿大淋巴结较前明显缩小,左下腹壁背部较大结节术后切除,术区残留条片状等密度模糊影,考虑术后改变,未见肿瘤残留及复发征象,余双侧胸壁结节范围均较前明显缩小;② 右肺中叶外侧段及左肺下叶散在小结节较前变化不大,需注意炎性结节与转移灶的鉴别;两肺多发间质性炎症较前稍加重;左肺门及纵隔数枚小、稍大淋巴结,部分较前稍增大;右侧输液港植入,管头位于上腔静脉;③ 双侧肾上腺轻度结节状增大,程度较前明显减轻,考虑转移瘤可能性大(图6)。
患者在接受4个周期的XELOX方案化疗与信迪利单抗免疫治疗后,疗效显著:肿瘤标志物(CEA、CA19-9、 CA72-4)降至正常或接近正常范围,影像学及胃镜复查提示原发灶及转移灶均明显退缩。考虑到晚期食管癌复发风险高,MDT团队在此时(2025年2月底)评估认为患者此前化疗+免疫治疗方案治疗效果较好,建议完成原计划6周期联合治疗(剩余2个周期分别于2025年3月18日、2025年4月8日完成),但考虑到患者在联合治疗过程中曾出现四肢稍麻木症状,MDT团队前瞻性规划患者6个周期联合治疗后的维持方案:在完成剩余2个周期XELOX+信迪利单抗后,转为卡培他滨+信迪利单抗维持治疗,以进一步巩固疗效并降低肿瘤负荷。此调整主要基于以下两点:其一,减少奥沙利铂长期使用相关的神经毒性风险(患者已经出现四肢麻木症状);其二,通过低强度化疗联合免疫治疗持续抑制肿瘤微环境,延缓肿瘤整体耐药发生。该策略符合欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)指南对晚期食管癌维持治疗的推荐,即对维持治疗阶段优先选用耐受性良好方案以平衡疗效与安全性[2]。截至2025年5月底,患者达到部分缓解(partial response,PR):靶病灶直径总和缩小≥30%,且非靶病灶明显退缩(胃镜及影像学证实),肿瘤标志物降至正常范围。目前患者已行6个周期化疗及免疫治疗,以及1周期卡培他滨+免疫治维持治疗(2025年4月29日),现患者因经济负担及不良反应顾虑表示不同意进一步免疫维持治疗,只同意行卡培他滨单药治疗,目前予患者卡培他滨单药维持治疗(1 500 mg,口服,每日2次)。
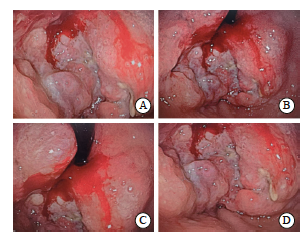
图1 2024年11月27日电子胃十二指肠镜检查图像
Fig. 1 Electrogastro-duodenoscopy diagnosis on November 27, 2024
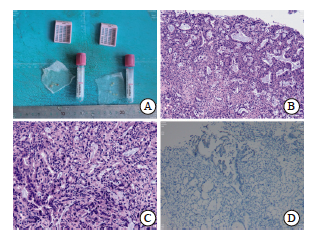
图2 电子胃十二指肠镜取活组织病理学检查
Fig. 2 Biopsy was taken by electronic gastroduodenoscopy for histopathological examination and immunofluorescence staining
A: Biopsy tissues; B-C: H-E staining (×200); D: Immunofluorescence staining, 22C3, DaKo staining (×40).
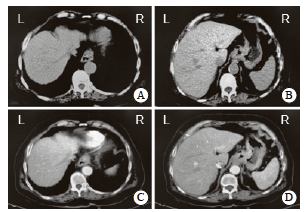
图3 2024年11月27日患者胸腹盆CT平扫及增强扫描图像
Fig. 3 Plain and enhanced scan images of the patient’s chest, abdomen and pelvis on CT on November 27, 2024
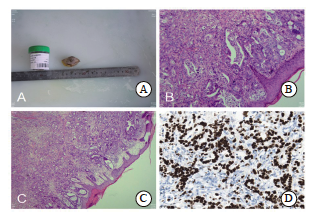
图4 患者左侧腰背部肿物术后病理学检查结果
Fig. 4 Postoperative pathological examination results of the tumor on the left lumbar and dorsal side of the patient
A: Biopsy tissues; B-C: H-E staining (×200); D: Immunofluorescence staining Ki-67 proliferation, 30-9, Roche staining (×40)
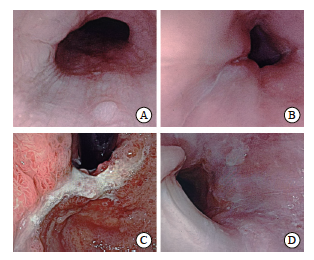
图5 2025年2月26日电子胃十二指肠镜检查图像
Fig. 5 Electronic gastro-duodenoscopy diagnosis on February 26, 2025
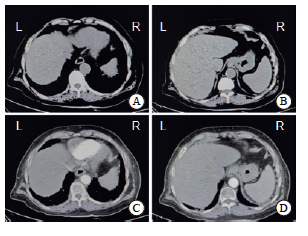
图6 2025年2月26日患者胸腹盆CT平扫及增强扫描图像
Fig. 6 Plain and enhanced scan images of the patient's chest, abdomen and pelvis on CT, taken on February 26, 2025
2 讨论
食管胃结合部腺癌的皮肤转移相对罕见,其发生率较低。根据相关研究报道[3-4],食管胃结合部腺癌的皮肤转移发生率约为1%,通常表现为坚硬的无痛性结节,常见于原发肿瘤邻近的皮肤,也可能出现在远处部位。在本病例中,患者为79岁女性,表现为左下腹壁背部的长梭形肿物,大小约为5 cm×4 cm,这与食管胃结合部腺癌皮肤转移的临床表现相符。尽管皮肤转移的发生率较低,但其出现通常提示疾病已进入晚期阶段,预后较差[5]。食管胃结合部腺癌的皮肤转移涉及多种分子机制。首先,肿瘤细胞的侵袭能力与细胞黏附分子上皮细胞钙黏蛋白(E-cadherin)的表达降低有关。E-cadherin表达减少会导致细胞间黏附力下降,促进癌细胞的转移[6]。其次,转录因子Snail和Slug通过抑制E-cadherin的表达,进一步增强肿瘤细胞的侵袭能力[7]。再次,食管胃结合部腺癌细胞可以通过分泌特定因子促进淋巴管生成,从而为肿瘤细胞的转移提供通道[8]。此外,特定基因的表达调控也参与食管胃结合部腺癌的转移过程。例如,环腺苷酸反应元件结合蛋白1(cAMP responsive element binding protein 1,CREB1)通过调控依赖ATP的DNA解旋酶Q4(ATP dependent DNA helicase Q4,RECQL4)的表达抑制自噬,从而促进食管胃结合部腺癌的转移[9]。在本病例中,病理学检查结果显示,患者左侧腰背部肿物为转移癌,原发灶及转移灶均显示P53基因突变型过表达及Ki-67增殖指数高(>80%),提示肿瘤高度恶性[10-12],结合临床病史和免疫组织化学检测结果,考虑为食管胃结合部腺癌转移。患者不仅出现皮肤转移,还存在多发淋巴结转移和双侧肾上腺增大等远处转移迹象,提示肿瘤已广泛转移。此外,皮肤转移的存在与更高的肿瘤负荷及更差的预后相关,患者的中位生存时间显著短于无皮肤转移的患者[13]。尽管如此,综合治疗策略,包括化疗和免疫治疗,可在一定程度上延长患者的生存期。在本病例中,患者接受了4个周期的XELOX化疗方案和信迪利单抗免疫治疗,结果显示,肿瘤标志物水平显著下降,影像学及胃镜提示原发灶及转移灶明显退缩,皮肤转移灶术后无残留。本病例通过病理学联合免疫组织化学检测(CK7+/CK20+)明确转移灶来源,PD-L1低表达(CPS=4)提示免疫微环境抑制状态,可能影响单药免疫治疗的效果。然而,患者接受XELOX化疗联合信迪利单抗后,肿瘤标志物及影像学检查均显示显著缓解,可能与化疗协同增强免疫应答有关。近期研究[14]提示,奥沙利铂可通过诱导免疫原性细胞死亡增强PD-1/PD-L1抑制剂疗效,这可能是本例治疗得以成功的潜在机制。
本病例分析具有重要的临床意义。首先,该分析结果强调了对食管胃结合部腺癌患者进行全面评估的重要性。临床医师应能够早期识别转移征象,尤其是对于出现皮肤结节的患者。由于皮肤是罕见的转移部位,需与原发皮肤肿瘤进行鉴别诊断,而病理学检查联合免疫组织化学检测是确诊的关键。其次,本病例展示了综合治疗策略在食管胃结合部腺癌皮肤转移患者中的应用价值。即使PD-L1表达阴性或低表达,化疗联合免疫治疗仍可能通过协同作用改善晚期患者的预后,这为类似病例的治疗提供了参考依据。此外,通过对该病例的深入研究,可以进一步探索食管胃结合部腺癌皮肤转移的分子机制,如P53基因突变及Ki-67增殖指数高可作为预后不良的标志,未来需要探索更多针对此类分子特征的靶向治疗策略。本病例为食管胃结合部腺癌皮肤转移的诊疗提供了临床参考依据。长期随访及分子动态监测将有助于进一步优化个体化治疗策略。
第一作者:
李浩,在读硕士,南方医科大学珠江医院。
通信作者:
蔡寨,博士,南方医科大学珠江医院副主任医师。
作者贡献声明:
李浩负责文章的总体构思、框架设计,并撰写了初稿;邓瑾、刘沛华、张泉涌负责文章内容的初步审阅、修改与润色工作;蔡寨负责文章内容的最终审阅及修改。
[参考文献]
[1] AJANI J A, D’AMICO T A, BENTREM D J, et al. Esophageal and esophagogastric junction cancers, version 2.2023, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2023, 21(4): 393-422.
[2] OBERMANNOVÁ R L, LEONG T, ESMO Guidelines Committee. ESMO clinical practice guideline interim update on the treatment of locally advanced oesophageal and oesophagogastric junction adenocarcinoma and metastatic squamous-cell carcinoma[J]. ESMO Open, 2025, 10(2): 104134.
[3] ZHANG S Q, GUO J D, ZHANG H Y, et al. Metastasis pattern and prognosis in men with esophageal cancer patients: A SEER-based study[J]. Medicine (Baltimore), 2021, 100(25): e26496.
[4] MURPHY C M, WANG K, WACHUKU C, et al. Metastatic ga st ri c adenoca rc i noma t o t he c ut aneous neck and chest wall[J]. SAGE Open Med Case Rep, 2024, 12: 2050313X241231515.
[5] CULLEN G. Esophageal cancer: a case study of a rare metastatic esophageal squamous cell carcinoma[J]. Clin J Oncol Nurs, 2020, 24(4): 352-355.
[6] MIYATA M, SHIOZAKI H, IIHARA K, et al. Relationship between E-cadherin expression and lymph-node metastasis in human esophageal cancer[J]. Int J Oncol, 1994, 4(1): 61-65.
[7] WENG W H, YIN J Y, ZHANG Y, et al. Metastasis-associated protein 1 promotes tumor invasion by downregulation of E-cadherin[J]. Int J Oncol, 2014, 44(3): 812-818.
[8] NEMOTO M, ICHIKAWA H, NAGAHASHI M, et al. Phosphosphingosine kinase 1 expression in lymphatic spread of esophageal squamous cell carcinoma[J]. J Surg Res, 2019, 234: 123-131.
[9] ZHENG S Y, ZHANG Y, GONG X Z, et al. CREB1 regulates RECQL4 to inhibit mitophagy and promote esophageal cancer metastasis[J]. J Clin Biochem Nutr, 2024, 75(2): 102-110.
[10] GERDES J. Ki-67 and other proliferation markers useful for immunohistological diagnostic and prognostic evaluations in human malignancies[J]. Semin Cancer Biol, 1990, 1(3): 199-206.
[11] BUTERA A, AMELIO I. Deciphering the significance of p53 mutant proteins[J]. Trends Cell Biol, 2025, 35(3): 258-268.
[12] JANIC A, ABAD E, AMELIO I. Decoding p53 tumor suppression: a crosstalk between genomic stability and epigenetic control? [J]. Cell Death Differ, 2025, 32(1): 1-8.
[13] GSCHNELL M, VOLBERG C, HAUSER C, et al. Cutaneous metastases: from epidemiology to therapy[J]. J Dtsch Dermatol Ges, 2024, 22(7): 974-993.
[14] GAO Y C, ZHANG H C, TANG L, et al. Cancer nanobombs delivering artoxplatin with a polyigniter bearing hydrophobic ferrocene units upregulate PD-L1 expression and stimulate stronger anticancer immunity[J]. Adv Sci (Weinh), 2024, 11(4): e2300806.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)